恢复期血浆治疗新型冠状病毒肺炎疗效及安全性的Meta分析
2021-11-06冷同爱禚度君王利张瑞李春峰陈吉刚杨琛
冷同爱,禚度君,王利,张瑞,李春峰,陈吉刚,杨琛
严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染引起的新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)目前已对全球公共卫生造成了严峻挑战[1]。截至2021年4月,全球累计确诊COVID-19患者1.4亿余例,累计死亡300余万例[2]。COVID-19目前仍无特效治疗手段,临床治疗以抗病毒、免疫调节、对症支持处理为主[3-4]。高龄及有心脑血管疾病、慢性肺部疾病、糖尿病等基础疾病的患者一旦感染SARSCoV-2,病情往往较重,且危重症患者死亡率较高[5]。
恢复期血浆(convalescent plasma,CP)作为一种被动免疫治疗策略,是向患者体内补充针对特定病原体的抗体,有研究显示,COVID-19患者接受康复者CP治疗后临床症状有所改善,病毒载量降低,病情恶化及死亡风险降低[6-8]。但也有研究显示,CP治疗并未使COVID-19患者明显获益[9-11]。鉴于此,本文对国内外CP治疗COVID-19的随机对照试验(randomized controlled trials,RCT)进行Meta分析,以期为临床使用CP治疗COVID-19提供高质量的循证依据。
1 资料与方法
1.1 文献纳入与排除标准
1.1.1 文献纳入标准 (1)国内外RCT;(2)治疗对象为反转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)检测SARS-CoV-2阳性的COVID-19确诊患者;(3)对照组患者接受对症支持处理,包括抗病毒、免疫调节药物、吸氧等治疗,CP治疗组在对照组治疗基础上,联合CP治疗;(4)观察指标至少包含以下1项指标:死亡率、SARS-CoV-2转阴率、临床症状改善情况、病情进展情况、通气治疗率、不良事件发生率。
1.1.2 文献排除标准 (1)病例报告及综述类文献;(2)结果数据报道不完整,与原文作者联系未能获取有效数据的研究;(3)基础类及动物实验等非临床研究。
1.2 文献检索策略 以“coronavirus disease 2019”“COVID-19”“novel coronavirus pneumonia”“convalescent plasma”为英文检索词,检索PubMed、Embase、Cochrane Library以及medRxiv预印本平台。以“新型冠状病毒肺炎”“新冠肺炎”“COVID-19”“恢复期血浆”“康复者血浆”为中文检索词,检索中国知网、万方数据知识服务平台及中国生物医学文献数据库。语种限定为中、英文,检索时间为2019年12月至2021年2月。由2名研究者严格按照文献纳入与排除标准独立筛选文献,先通过阅读文题及摘要进行初筛,对可能符合的文献通过阅读全文进行复筛,进一步检索纳入文献的参考文献,搜寻符合条件的文献。
1.3 资料提取 由2名研究者独立提取纳入文献的以下信息:第一作者、发表年份、国家、样本量、性别、年龄、患者病情严重程度、对照组处理措施、CP治疗组治疗方案、CP抗体滴度、症状出现至治疗时间、结局指标(死亡率、SARSCoV-2转阴率、临床症状改善率、病情进展率、通气治疗率、不良事件发生率)。2名研究者提取信息不一致时,先自行讨论,然后请求专家评判。
1.4 纳入文献方法学质量评价 由2名研究者参照Cochrane风险偏倚评价工具[12],从随机分组、分配隐藏、盲法实施(包含受试者盲法、评价者盲法)、结果数据完整性、选择性报告研究结果、其他偏倚6个方面对纳入文献进行方法学质量评价。方法学质量分低、中、高风险偏倚,其中,低风险偏倚为偏倚不太可能严重影响结论,中风险偏倚为偏倚可能影响结论,高风险偏倚为偏倚严重影响结论的可信度。
1.5 统计学方法 使用Stata 12.0软件进行统计学分析。计数资料采用RR、HR及其95%CI表示。患者病情严重程度可能影响CP治疗效果,如数据充足,进行亚组分析。采用Q检验评估纳入文献间统计学异质性大小,P<0.1提示各研究间有统计学异质性,I2<25%提示异质性低,25%~<50%提示异质性中等,≥50%提示异质性明显,无论各研究间是否存在统计学异质性,均采用随机效应模型进行数据合并分析。以P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果 通过检索国内外数据库,共检索到文献885篇,通过阅读文献摘要及全文,排除不符合纳入标准的文献,最终纳入9篇RCT[9-11,13-18]。共包含1 396例COVID-19患者,其中CP治疗组757例,对照组639例。样本量最小的文献[13]包含40例患者,样本量最大的文献[9]包含464例患者。纳入患者均为成年人。6篇文献[9,11,13-14,16-17]的研究对象为重型COVID-19患者,1篇文献[10]的研究对象为重型及危重型COVID-19患者(该文献分别报道了重型及危重型患者数据,因此Meta分析时分别统计入重型、危重型患者组),1篇文献[18]的研究对象为轻型COVID-19患者,1篇文献[15]的研究对象为住院COVID-19患者(患者病情严重程度采用世界卫生组织COVID-19严重程度评分标准,75.6%患者使用面罩吸氧或无创通气,15.1%患者使用机械通气或合并其他器官支持治疗,因未单独报告数据,Meta分析时将此篇文献纳入重型患者组)。8篇文献[9-11,13-16,18]为多中心研究,1篇文献[17]为单中心研究。文献筛选流程见图1,纳入文献的基本特征见表1。
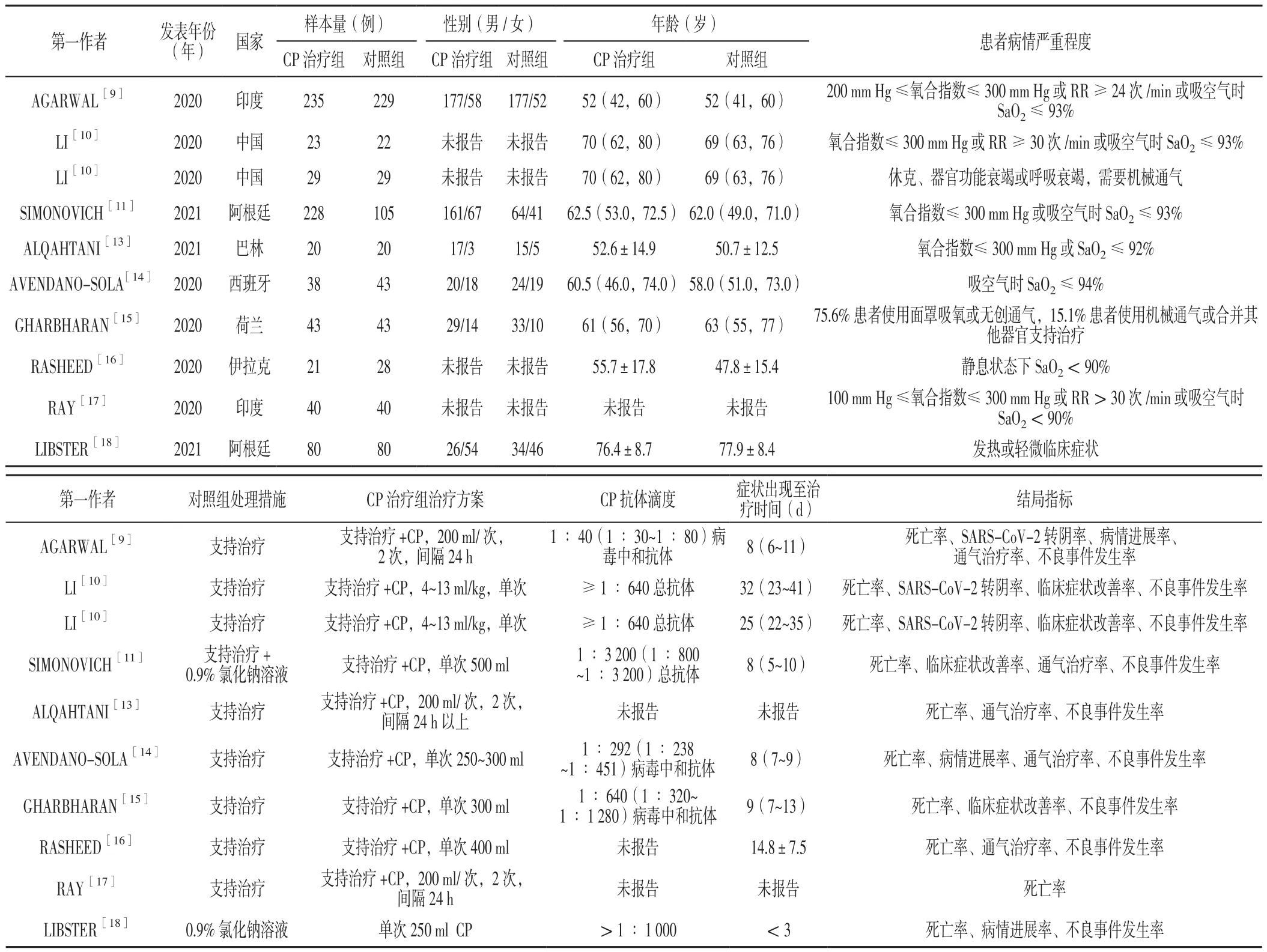
表1 纳入文献的基本特征Table 1 Basic features of the involved literature
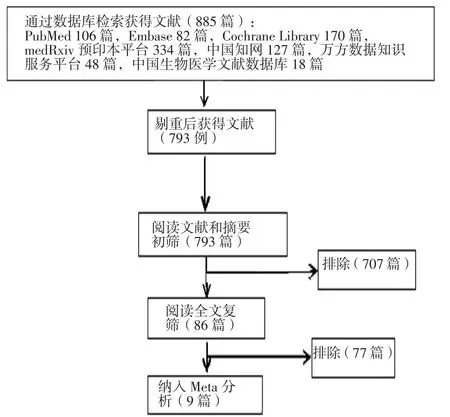
图1 文献筛选流程图Figure 1 Literature screening flowchart
2.2 纳入文献方法学质量评价 9篇RCT[9-11,13-18]全部提及随机分组,其中8篇文献[9-11,13-15,17-18]报告了具体随机方法。4 篇文献[9,11,14,18]报告了分配隐藏,5 篇文献[10,13,15-17]未描述分配隐藏方法。2篇文献[11,18]为双盲研究,6篇文献[9-10,13-15,17]为开放标签研究,1篇文献[16]未提及是否采用盲法。所有文献在结果数据完整性、选择性报告研究结果、其他偏倚来源方面均为低风险偏倚。
2.3 CP治疗COVID-19患者的疗效
2.3.1 CP对COVID-19患者死亡率的影响 9篇文献[9-11,13-18]报道了CP对COVID-19患者死亡率的影响,各研究间无统计学异质性(I2=12.8%,P=0.325)。Meta分析结果显示,CP治疗组与对照组死亡率比较,差异无统计学意义〔RR=0.92,95%CI(0.71,1.19),P=0.528〕。根据患者病情严重程度进行亚组分析,结果显示,CP治疗组轻型、重型、危重型COVID-19患者分别与对照组轻型、重型、危重型COVID-19患者死亡率比较,差异无统计学意义〔RR=0.50,95%CI(0.09,2.65),P=0.416;RR=0.91,95%CI(0.66,1.25),P=0.549;RR=0.80,95%CI(0.37,1.72),P=0.569〕,见图2。
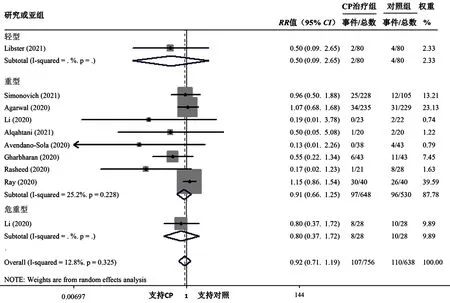
图2 CP治疗组与对照组死亡率比较的森林图Figure 2 Forest plot for comparison of mortality rate between CP treatment group and control group
2.3.2 CP对COVID-19患者SARS-CoV-2转阴率、临床症状改善率的影响 2篇文献[9-10]报道了CP对COVID-19患者SARS-CoV-2转阴率的影响,文献间统计学异质性显著(I2=93.9%,P<0.001)。Meta分析结果显示,CP治疗组SARS-CoV-2转阴率高于对照组,差异有统计学意义〔HR=1.33,95%CI(1.04,1.70),P=0.023〕。
3篇文献[10-11,15]报道了 CP 对 COVID-19患者临床症状改善率的影响,各文献间无统计学异质性(I2=4.7%,P=0.350)。Meta分析结果显示,CP治疗组与对照组临床症状改善率比较,差异无统计学意义〔HR=1.06,95%CI(0.75,1.49),P=0.734〕。
2.3.3 CP对COVID-19患者病情进展率、通气治疗率的影响3篇文献[9,14,18]报道了CP 对 COVID-19患者病情进展率的影响,各文献间无统计学异质性(I2=53.2%,P=0.118)。Meta分析结果显示,CP治疗组与对照组病情进展率比较,差 异 无 统 计 学 意 义〔RR=0.61,95%CI(0.29,1.30),P=0.200〕。亚组分析结果显示,CP治疗组轻型COVID-19患者病情进展率低于对照组轻型COVID-19患者,差异有统计学意义〔RR=0.52,95%CI(0.29,0.94),P=0.031〕;CP治疗组重型COVID-19患者与对照组重型COVID-19患者病情进展率比较,差异无统计学意义〔RR=0.40,95%CI(0.04,4.36),P=0.451〕。
5 篇文献[9,11,13-14,16]报道了 CP 对 COVID-19 患者通气治疗率的影响,各文献间无统计学异质性(I2=27.0%,P=0.242)。Meta分析结果显示,CP治疗组与对照组通气治疗率比较,差异无统计学意义〔RR=1.12,95%CI(0.82,1.55),P=0.476〕,见图3。
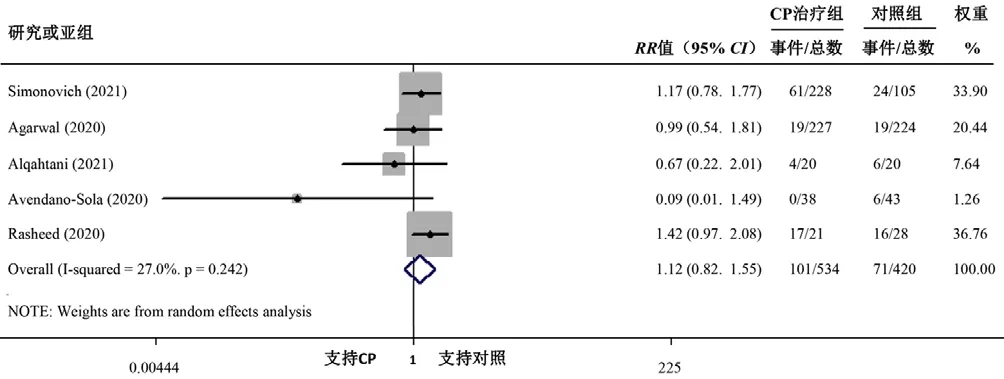
图3 CP治疗组与对照组通气治疗率比较的森林图Figure 3 Forest plot for comparison of ventilation treatment rate between CP treatment group and control group
2.4 CP 治疗 COVID-19 患者的安全性 7篇文献[9-11,13-14,16,18]报道了CP治疗COVID-19患者的安全性。其中6篇文献[9-11,13,16,18]报 道 了 CP 治 疗 COVID-19 患 者 的 总体不良事件发生率,各文献间无统计学异质性(I2=31.4%,P=0.200)。Meta分析结果显示,CP治疗组与对照组总体不良事件发生率比较,差异无统计学意义〔RR=2.00,95%CI(0.70,5.71),P=0.198〕。2篇文献[11,14]报道了 CP治疗COVID-19患者的严重不良事件发生率,各文献间无统计学异质性(I2=0,P=0.595)。Meta分析结果显示,CP治疗组与对照组严重不良事件发生率比较,差异无统计学意义〔RR=1.24,95%CI(0.81,1.90),P=0.321〕,见图 4。
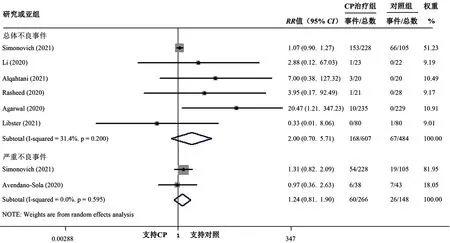
图4 CP治疗组与对照组不良事件发生率比较的森林图Figure 4 Forest plot for comparison of incidence of adverse events between CP treatment group and control group
3 讨论
CP治疗COVID-19的具体疗效目前尚存争议[9-11,18-19]。笔者对目前已完成的9项RCT[9-11,13-18]进行Meta分析,观察CP对COVID-19患者死亡率、SARS-CoV-2转阴率、临床症状改善率、病情进展率、通气治疗率的影响以及CP治疗COVID-19的安全性,以期为临床使用CP治疗COVID-19患者提供循证依据。
COVID-19康复者血浆包含SARS-CoV-2中和抗体[20-22],输注后24 h就能明显提升患者体内抗体水平[11,18]。本Meta分析结果显示,CP治疗组SARS-CoV-2转阴率高于对照组,分析原因可能与抗体通过抗体依赖细胞介导的细胞毒作用、补体激活、吞噬作用等方式促进SARS-CoV-2清除有关[23]。本Meta分析结果显示,CP治疗组轻型COVID-19患者病情进展率低于对照组轻型COVID-19患者,CP治疗组重型COVID-19患者与对照组重型COVID-19患者死亡率、病情进展率比较无统计学差异,分析原因可能与CP使用时机、CP中抗体水平、患者病情等因素有关。
CP治疗作为一种被动免疫治疗策略,在机体充分建立针对病毒的特异性免疫应答前,尽早使用该治疗策略的疗效较好。LIBSTER等[18]研究显示,老年COVID-19患者出现轻微症状3 d内使用CP治疗,患者病情进展至重型的风险明显降低,病情进展时间明显推迟,无创或机械通气治疗率、ICU治疗率、进展至危重型及死亡的风险均有所下降。另一项纳入35 322例患者的研究显示,确诊COVID-19患者早期(≤3 d)使用CP治疗,其第7天及第30天死亡率明显降低,并且疗效优于延后(≥4 d)使用CP[19]。本Meta分析纳入的文献中,仅1篇文献[18]的患者在症状出现3 d内使用CP,其余文献[9-11,13-17]的患者使用CP的时间为症状出现的第8~32天,此时患者体内已产生一定水平的抗体[9,11,14-15],CP治疗效果会受到影响。
CP中抗体水平影响其治疗效果,高水平抗体CP的疗效明显优于低水平抗体CP[16,18-19]。一项包含3 082例患者的分析显示,与低水平抗体CP相比,高水平抗体CP治疗可明显降低COVID-19患者第7、30天死亡率[19]。本Meta分析结果显示,CP治疗组与对照组死亡率比较无统计学差异,可能与纳入的部分文献中CP抗体水平较低有关,如AGARWAL等[9]研究中36.4%的CP供者抗体水平在检测阈值以下。CP抗体水平与供者性别、年龄、疾病严重程度等有关,一般情况下,男性、年长、病情重的康复者血浆中抗体水平较高[17,21,24-25]。因此,筛选抗体水平高及抗病毒活性强的CP用于临床,对于提高疗效至关重要。
患者病情严重程度、支持治疗方案等因素也影响CP疗效。一项包含4 330例患者的研究显示,高水平抗体CP组与低水平抗体CP组患者7 d死亡率比较无统计学差异,但在未插管机械通气的COVID-19患者中,高水平抗体组患者7 d死亡率低于低水平抗体组患者[6]。轻型COVID-19患者CP治疗后病情恶化风险明显降低[18],重型COVID-19患者的CP治疗效果优于危重型COVID-19患者[10],提示患者病情较轻时使用CP的效果较好,如患者病情已较重,再使用CP已不能逆转一些严重的组织器官损伤。本Meta分析纳入的文献中大多数患者为重型COVID-19患者,CP并未降低患者死亡率可能与此有关。此外,患者在CP治疗的同时也使用抗病毒、免疫调节等治疗,这些治疗在一定程度上可能也影响CP的治疗效果。
有研究显示,COVID-19患者CP治疗后血栓栓塞及心脏不良事件发生风险增加[26-27]。至于CP治疗COVID-19的安全性,本Meta分析结果显示,CP治疗组与对照组总体、严重不良事件发生率比较无统计学差异。另一项纳入20 000例患者的多中心研究也显示,COVID-19患者接受CP治疗后严重不良事件发生率很低(<1%)[6]。提示CP治疗COVID-19是安全的。
综上所述,CP可提高COVID-19患者SARS-CoV-2转阴率,降低轻型COVID-19患者病情进展率,但并未降低患者死亡率、临床症状改善率、通气治疗率,且安全可靠。CP未降低患者死亡率、临床症状改善率、通气治疗率可能与多数患者使用CP时机较晚、CP中抗体水平较低、使用CP时患者病情已较重等因素有关。为提供高质量循证证据,本Meta分析仅纳入了RCT,纳入文献样本量多数偏小,且纳入轻型、危重型COVID-19患者的文献均仅1篇,样本量也较小,且报道患者SARS-CoV-2转阴率、临床症状改善率的文献较少,统计学效能受到一定影响,因此,在解读相关数据时需谨慎,CP对COVID-19患者的具体疗效仍有待大样本量的RCT进一步验证。由于数据有限,本Meta分析未能研究CP使用时机、CP抗体水平等因素对其疗效的具体影响。但据目前研究结果来看,根据患者临床特征制定针对性的CP治疗策略,如高龄及伴有心脑血管疾病、慢性肺部疾病、糖尿病等基础疾病的COVID-19高危人群,在疾病早期干预性使用高水平抗体CP,可降低患者病情恶化风险、医疗资源需求及患者死亡率,更符合目前循证证据。
作者贡献:冷同爱、禚度君、王利、杨琛进行文章的构思、设计及可行性分析;冷同爱、禚度君、王利、张瑞、李春峰、陈吉刚进行文献/资料收集、整理;冷同爱撰写、修订论文;杨琛负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。
