基于网络药理学探讨少腹逐瘀汤治疗癌性疼痛机制*
2021-11-05常金圆李淏江正龙冯利
常金圆,李淏,江正龙,冯利
1.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院,北京 100021;2.北京中医药大学,北京 100029
疼痛是癌症诊断中最为常见的表现特征,同时也是癌症患者在整个疾病过程中最为恐惧的症状。大约45%的癌症晚期患者经历了中、重度疼痛[1],然而在临床中这类疼痛往往是难以缓解的[2]。因其发生机制过于复杂,导致治疗方法局限,治疗效果欠佳。目前临床普遍应用WHO“三阶梯止痛疗法”治疗癌性疼痛,然而其带来的不良反应通常导致患者难以持续接受治疗[3-4]。中医将其归于“痛证”范畴,究其病机不外乎“不通则痛”及“不荣则痛”两端。癌毒与痰瘀互结,发为癌肿,导致脉络闭阻,发为疼痛,此为不通则痛;日久邪伤正气,气血虚弱,导致无法濡养脏腑经络,发为疼痛,此为不荣则痛。
少腹逐瘀汤出自王清任《医林改错》一书,由当归、川芎、小茴香、干姜、延胡索、没药、肉桂、赤芍、蒲黄、五灵脂10味药组成,具有养血活血、通利血脉、温经散寒、理气除湿、化瘀止痛的作用。临床普遍应用于妇科及男科疾病的治疗[5],因其化瘀通利的特性,故而在治疗肿瘤相关病症方面也有独特的作用。相关实验结果表明,经少腹逐瘀汤干预后,可使模型大鼠体内白细胞介素-6(interleukin-6,IL-6)及肿瘤坏死因子-α(tumor necrosis factor-α,TNFα)水平降低,抑制炎性介质合成和释放,提高机体免疫力[6]。醋酸扭体实验和棉球肉芽肿实验结果显示,少腹逐瘀汤能明显抑制醋酸所致的小鼠扭体次数,表明其对炎性疼痛具有一定的抑制作用[7]。中药复方因其多中药、多成分、多靶点协同的特点,应用目前现有的研究手段,通常不能全面解释其作用。网络药理学从宏观、系统的角度,探寻药物治疗疾病的整体效应,打破了以往单化合物、单靶点的研究模式,为研究中药复方提供了新的思路。
1 资料与方法
1.1 少腹逐瘀汤活性成分和相关靶点筛选本研究利用TCMSP数据库(https://lsp.nwu.edu.cn/tcmsp.php)及BATMAN-TCM数据库(http://bionet.ncpsb.org/batman-tcm/)构建少腹逐瘀汤化学成分数据库。TCMSP数据库所含中药:依据口服利用度(oral bioavailability,OB)≥30%和类药性(druglikeness,DL)≥0.18为条件,筛选其活性成分[8],及有效化合物相关的靶点。非TCMSP数据库中药:通过BATMAN-TCM数据库查询中药相关活性成分,并设定评分>20,作为活性靶点的筛选依据[9]。并将靶点通过uniprot数据库(https://www.uniprot.org)进行标准化。
1.2 癌性疼痛相关靶点预测以“cancer-related pain”为检索词,检索GeneCards数据库[10](https://www.GeneCards.org/)查询癌性疼痛相关靶点。
1.3 少腹逐瘀汤中药-活性化合物-靶点网络构建将药物-疾病交集靶点以及药物活性化合物导入Cytoscape3.7.2中[11],绘制少腹逐瘀汤与癌性疼痛中药-活性化合物-靶点网络图。
1.4 少腹逐瘀汤化学成分靶点蛋白互作(proteinprotein interaction,PPI)及Hub基因网络的构建将交集靶点上传到String11.0数据库中(https://www.string-db.org),选择物种为人源,最低相互作用阈值设定为0.9,证据类型设置为来源于实验、数据库以及共表达,建立PPI网络。并将网络导入Cytoscape3.7.2软件,应用Cytohubba插件[12],计算网络中各节点的最大中心性MCC值,绘制Hub基因网络图。
1.5 少腹逐瘀汤对癌性疼痛作用靶点生物功能注释分析将交集得到的靶点,利用Bioconductor中的R包clusterprofile v3.12.0,设定P<0.05,进行GO富集分析及KEGG富集分析[13]。
1.6 少腹逐瘀汤治疗癌性疼痛的分子对接验证通过PDB数据库(https://www.rcsb.org)下载蛋白结构,并将其导入对接模拟软件AutoDock,与Degree值排名前5位的关键药效分子进行对接模拟计算,并以靶点蛋白相应的配体作为阳性对照。完成对接模拟之后,根据关键药效分子和靶点蛋白最强亲和力值绘制热图。并筛选结合最稳定的对接结构,利用ligplot绘制对接模式图。
2 结果
2.1 少腹逐瘀汤与癌性疼痛靶点全局性网络分析共收集到化合物1 219种,依据筛选条件进行筛选,删重后共有139种,药物靶点344个,疾病相关靶点906个,其中药物与疾病相同靶点104个(图1A)。通过Cytoscape 3.7.2构建中药-活性化合物-靶点作用网络图,通过network analyze计算网络的拓扑学参数,结果一共得到204个节点,854条边。按照Degree值对活性化合物进行排序,得到排名前5位的化合物为槲皮素(MOL000098)、山柰酚(MOL000422)、β-谷甾醇(MOL000358)、豆甾醇(MOL000449)、益母草素(MOL004215)(图1B)。排名前5位的活性化合物与疾病靶点相互作用见图1C。提示在应用少腹逐瘀汤治疗癌性疼痛中,这些化合物具有关键作用。

图1 少腹逐瘀汤与癌性疼痛靶点全局性网络分析示意图
2.2 少腹逐瘀汤治疗癌性疼痛核心靶点分析将104个交集靶点上传到String11.0数据库,建立PPI网络,共得到74个节点,234条边(图2A)。为了进一步探求PPI网络中核心蛋白之间的相互作用关系,应用cytohubba插件,计算网络中各节点的最大中心性MCC值,并绘制Hub基因网络图(图2B)。其中ADRA2A、ADRA2B、ADRA2C、CHRM2及AVP的MCC值较高。

图2 少腹逐瘀汤治疗癌性疼痛核心靶点分析图
2.3 少腹逐瘀汤对癌性疼痛作用靶点的GO分析和KEGG分析利用R包clusterprofile一共得到GO条目1 718条,主要富集在调节神经元动作电位以及炎症的发生(表1)。KEGG富集显示,少腹逐瘀汤通过调节丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、核因子κB亚单位(nuclear factor kappa B subunit,NF-kappa B)信号通路以及瞬时受体电位信号通路,达到治疗癌痛的作用。见表2。

表1 少腹逐瘀汤生物学功能富集结果
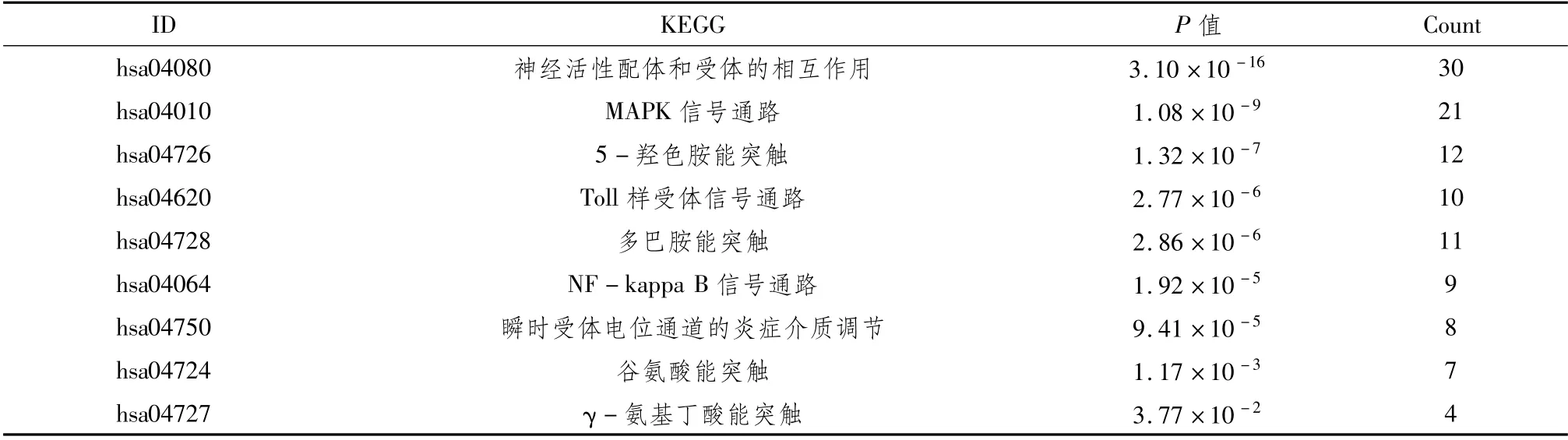
表2 少腹逐瘀汤KEGG富集结果
2.4 少腹逐瘀汤治疗癌性疼痛分子对接结果验证对12个关键靶蛋白及5个关键化合物分子对接的最低结合能做热图(图3)。由图3所示,所有分子与靶标蛋白的最低结合能均小于-1.2 kcal·mol-1,说明所有活性化合物与受体均能结合。其中CHRM2、F2R、P38及TNF-α结合最紧密。靶点蛋白基本信息见表3。

表3 靶点蛋白基本信息表

图3 分子对接结果热图
为了进一步探究CHRM2、F2R、P38及TNF-α与化合物的结合模式,选取各自对接最稳定的结构进行模拟分析,其中,CHRM2与β-谷甾醇结合最紧密,F2R、P38和TNF-α与豆甾醇结合最紧密(图4)。
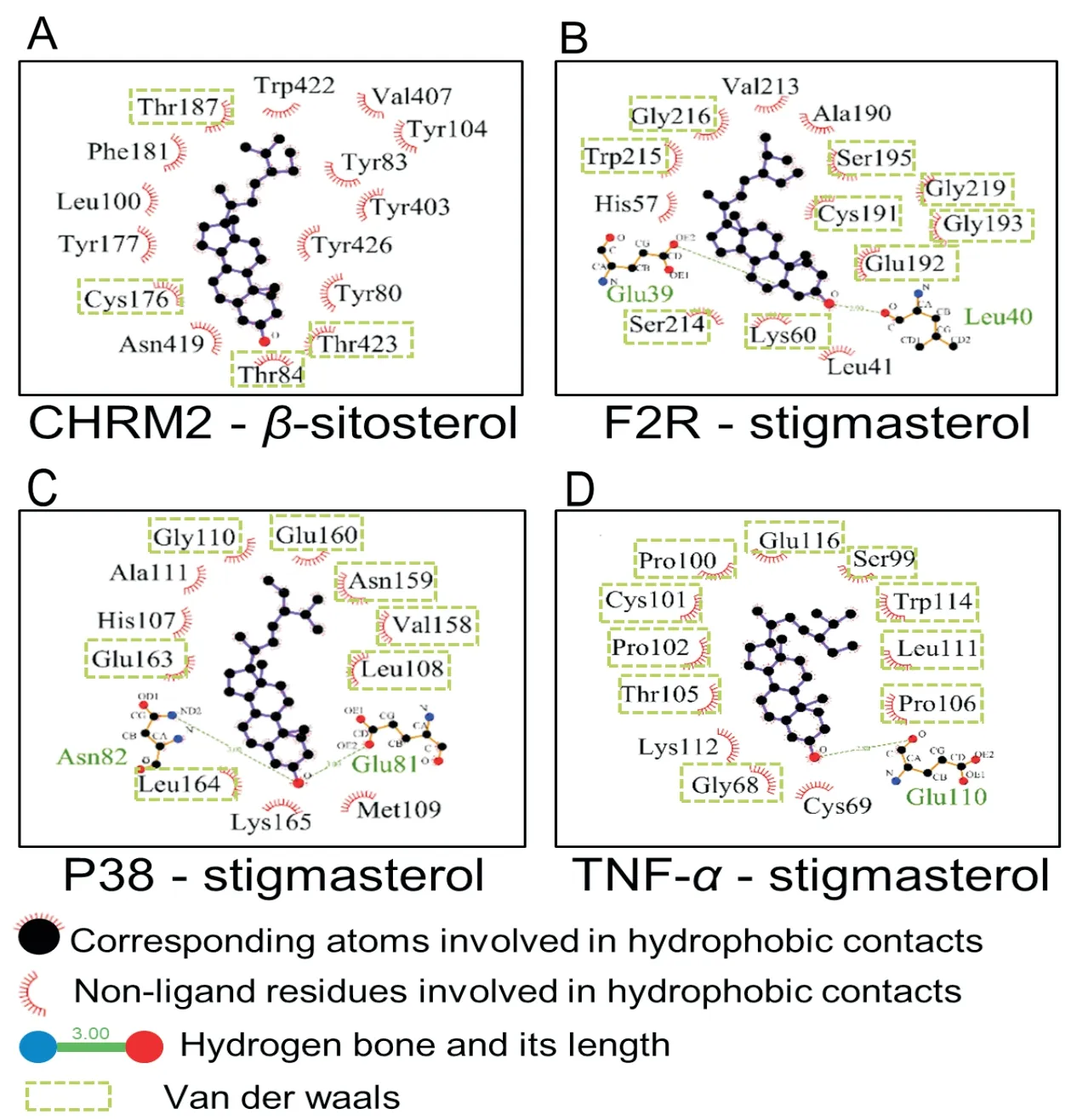
图4 对接结果模式图
结果表明,小分子化合物和蛋白靶点均可通过形成疏水作用以及范德华力从而形成稳定结合,其中,豆甾醇还可以与F2R和TNF-α分别在Leu40和Glu110残基位点上形成氢键,与P38在Glu81以及Asn82残基位点上形成氢键,从而增强结合的稳定性。
3 讨论
少腹逐瘀汤是治疗妇科瘀血内阻的代表方之一,将此方加减后应用于癌性疼痛的治疗,是取此方温经散寒、化瘀止痛之功用,同时也符合肿瘤发生的中医病机[14]。癌性疼痛的发病机制尚未明确,包含了神经病理痛和炎性疼痛的特性,但其机制远比以上两种疼痛复杂,对机制研究的不足也是限制癌性疼痛治疗效果的原因之一。西医治疗手段和靶点相对单一,针对癌痛多靶点的特性,中药复方多靶点、多成分协同作用,使得临床中应用少腹逐瘀汤治疗癌性疼痛往往颇有疗效。
研究发现,槲皮素、山柰酚、β-谷甾醇、豆甾醇及益母草素的Degree值高于其余成分,说明这些药物成分可能是少腹逐瘀汤治疗癌性疼痛的关键成分。槲皮素及山柰酚均属于黄酮类化合物。有研究发现,两者均可影响细胞因子的分泌,快速清除DPPH和ABTS自由基,有效抑制TNF-α的分泌[15];β-谷甾醇及豆甾醇都属于植物甾醇类成分,两者均有抗肿瘤及抗炎作用。有研究发现,β-谷甾醇通过减少NO的合成,抑制IL-6活性,减少TNF等炎性因子的分泌[16];豆甾醇能明显减少由脂多糖(lipopolysaccharide,LPS)刺激增多的环氧化酶-2和诱生型一氧化氮合酶(inducible nitric oxide synthase,iNOS)mRNA的表达,从而达到抑制炎症的作用[17]。分子对接结果表明,这两种植物类甾醇,均可以同CHRM2、F2R、P38及TNF-α稳定结合,从而发挥镇痛的作用。其中延胡索的连接度最高,并且关键化合物中槲皮素、豆甾醇和益母草素均来源于延胡索,证明延胡索治疗癌性疼痛中的炎性来源疼痛确有疗效。
对少腹逐瘀汤治疗癌性疼痛的KEGG富集研究发现,少腹逐瘀汤能够影响促兴奋性氨基酸的合成,并通过神经活性配体-受体相互作用影响疼痛信号的传导,表明少腹逐瘀汤有效成分可能通过影响神经递质的传递,从而达到治疗癌性疼痛的目的。在治疗肿瘤方面,一共富集出肿瘤有关通路15条(9.87%),并主要富集在结直肠癌、膀胱癌、前列腺癌、子宫内膜癌等腹盆腔肿瘤中。这提示应用少腹逐瘀汤在治疗腹盆腔肿瘤所致的癌性疼痛过程中,也会对原发肿瘤产生治疗效果。
分子对接结果显示,CHRM2、F2R、P38及TNF-α与受体对接效果更加紧密,意味着在治疗癌性疼痛方面可能发挥更为重要的作用。CHRM2是毒蕈碱样胆碱能受体(muscarinic cholinergic receptor mAChRs)的M2亚型,通过G蛋白抑制腺苷酸环化酶促使环磷酸腺苷减少,从而在神经调节镇痛方面起到重要作用。诱导CHRM2在神经病理性疼痛中正常表达,可以有效增强毒蕈碱对神经病理性疼痛的镇痛作用[18]。本研究结果发现,小茴香、干姜、当归、没药、蒲黄、赤芍、延胡索可以靶向该蛋白,意味着少腹逐瘀汤通过这些药物可以对癌性疼痛中的神经源性疼痛产生治疗作用。
F2R是PAR-1的别称,是凝血酶受体,属于蛋白酶活化受体家族(protease-activated receptors,PARs),能够被凝血酶激活,并通过传入神经元,降低疼痛阈值。研究发现,鞘内注射凝血酶,可以引起长期的痛觉过敏[19-20]。并且PAR-1在体外通过多种机制参与癌细胞的侵袭和传播,降低上皮细胞钙黏蛋白,并增加α-平滑肌肌动蛋白的表达,两者都是上皮间质转化的标志[21]。最近发现PAR-1在肺癌、大肠癌、前列腺癌和卵巢癌等多种肿瘤细胞株中均有高表达。网络药理学研究发现,少腹逐瘀汤中小茴香、川芎、延胡索、没药、蒲黄均可靶向F2R,说明少腹逐瘀汤不仅能起到止痛的作用,对原发肿瘤也有一定程度的治疗作用。
P38 MAPK信号通路是丝裂酶原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)家族中重要组成部分。MAPK是细胞内重要的信号转导系统之一,多种炎症因子及应激反应可使p38 MAPK的酪氨酸和苏氨酸双磷酸化,从而激活p38 MAPK,参与疼痛的发生和维持[22]。分子对接结果表明,少腹逐瘀汤中的有效化学成分,可以与其紧密结合,参与p38 MAPK的调节。
TNF-α是一种致炎细胞因子,作为一种参与疼痛发生、发展的调节因子,在神经轴突内逆行或顺行运输。正常情况下,TNF在神经组织中表达水平较低,在神经组织自身缺血、受损、炎性病变时,TNF-α的含量迅速升高,能通过多种途径诱导致痛物质前列腺素E2、缓激肽的产生,在疼痛形成与维持的过程中扮演重要角色。延胡索、没药、蒲黄、赤芍均可靶向TNF-α,调节炎症的发生发展,并缓解由炎症所致疼痛。
综上,本研究通过网络药理学及分子对接技术,对少腹逐瘀汤治疗癌性疼痛的机制进行探索。少腹逐瘀汤对癌性疼痛的治疗是基于多组分、多靶点、多通道的综合药理作用,为晚期肿瘤患者疼痛治疗提供参考,也为下一步的研究提供理论基础。
