酸碱溶液中复杂体系质子平衡条件式的推导3溶液为例
——以FeCl
2021-11-05徐嘉睿徐晓文邹桂征张斌
徐嘉睿,徐晓文,邹桂征,张斌,*
1山东大学化学与化工学院,济南 250100
2山东大学泰山学堂,济南 250100
质子平衡条件式(proton balance equation,PBE)是分析化学中酸碱平衡部分的基础,在酸碱平衡体系pH的精确求解、酸碱滴定曲线数学模型的建立、酸碱滴定终点误差计算公式等逻辑推导过程中至关重要[1–3],对于广大学生学习理解与正确掌握酸碱平衡体系具有不可替代的作用。在化学专业基础课《分析化学》(武汉大学主编,第6版,上册,以下简称教科书)酸碱滴定法一章的学习中[4],根据布朗斯特(Bronsted)酸碱质子理论,对于简单酸碱体系质子平衡条件式的书写,可通过选取原始酸碱组分或溶液中大量存在的并与质子转移直接相关的酸碱组分作为参考水准后推导出其PBE。而对于相对较复杂体系质子平衡条件式的书写,如FeCl3溶液体系,质子平衡有多种理解与书写表达方式,在处理和推导其质子平衡条件式时具有一定的难度,较难把握。如何建立处理简单、便于理解的质子平衡体系,进而准确推导出复杂体系的质子平衡条件式,对于广大学生正确理解溶液酸碱平衡体系的基础理论以及对体系中pH等参数计算公式的探讨有着重要的意义。本文以FeCl3水溶液为模型,从三种平衡关系式出发,多角度、系统地讨论了体系中质子平衡条件式的处理和推导结果,并采取不同的方式对质子平衡条件式进行了验证。
1 将FeCl3溶液视为强酸弱碱盐体系的处理方法
1.1 FeCl3溶液与强酸弱碱盐体系的相似性分析
我们通常认为,在FeCl3溶液中Fe(III)以[Fe(H2O)x]3+络离子的形式存在[5],由于Fe3+具有半径小、电荷高的性质,其具有的较强的正电场会对O―H产生极化作用,使得O―H键的极性增大,导致H较容易以H+的形式解离。因此,FeCl3溶液常显示酸性。

1.2 FeCl3溶液质子平衡条件式的推导
在推导质子平衡条件式前首先需要探讨的是[Fe(H2O)x]3+可发生几级水解。参考实验数据[5],[Fe(H2O)x]3+一至三级的水解平衡常数分别为lgK1= 11.87、lgK2= 21.17、lgK3= 29.67。根据元素化学的有关性质[6],Fe(OH)3仅可微溶于浓的氢氧化钠溶液,因此可认为[Fe(H2O)x]3+可发生三级水解。
将[Fe(H2O)x]3+、Cl−与H2O作为参考水准,根据质子守恒的原则,可写出FeCl3的质子平衡条件式(2):
参考教科书有关元素化学的基本性质我们了解到,真实的[Fe(H2O)x]3+应显示淡紫色[7],但是通常得到的FeCl3溶液却为较深的黄色,这是由于水溶液中Fe3+并不主要以[Fe(H2O)x]3+的形式存在,而是以水解后的氢氧根络合物的形式存在。所以若以溶液中大量存在的氢氧根络合物为参考水准,我们将得到另外的质子平衡条件式:
同理,若以Fe(OH)2+为参考水准,可得:

此外,还有资料显示[8],[Fe(H2O)x]3+在水中存在着一种十分稳定的双核配离子[Fe2(OH)4]2+,可以将此离子看做Fe(OH)2+的二聚体形式。如果将其作为参考水准,只需注意对于Fe3+的水解平衡常数lgK2进行修正即可,不会影响体系中质子平衡条件式的正确推导。
2 将FeCl3溶液视为酸碱缓冲溶液的处理方法
2.1 FeCl3溶液质子平衡条件式的推导
在处理以酸碱溶液为例的共轭体系时,教科书采用将这些共轭体系视为由强酸与弱碱或强碱与弱酸反应而来的方法[4],因此其质子参考水准可选取相应的强酸与弱碱或强碱与弱酸。我们将该方法推广到FeCl3体系中,即将FeCl3视作由弱碱Fe(OH)3与强酸HCl反应的产物。
将Fe(OH)3、HCl与H2O作为质子参考水准,根据质子守恒的原则,即可推导出FeCl3的质子平衡条件式:
2.2 两种不同处理方式所推导出质子平衡条件式的证明
对比两种不同处理方法得到的质子平衡条件式,由于选取不同的质子参考水准,所得质子平衡条件式的表达亦不同,下面尝试对于得到的(2)、(5)两个质子平衡条件式进行证明。 将质子平衡条件式(3)−条件式(2):
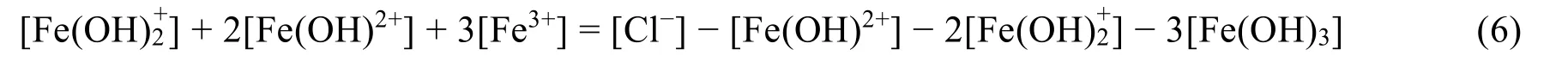
移项整理:
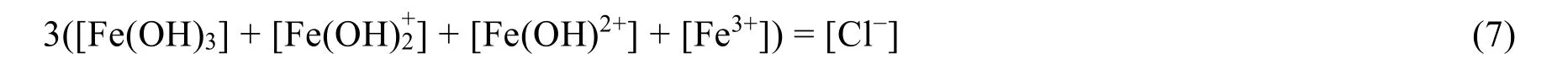
即:

由于溶液中组分FeCl3化学式中nFe:nCl= 1 : 3,因此二者的分析浓度之比亦为1 : 3,故条件式(8)即为体系的物料平衡方程式,因此两种质子平衡条件式的推导结果可证明正确。
3 根据FeCl3溶液中物料平衡与电荷平衡关系的处理方法
3.1 FeCl3溶液体系中的物料平衡与电荷平衡
根据FeCl3溶液中cFe:cCl= 1 : 3,可得体系的物料平衡条件式(7):

根据水的解离平衡可得体系的物料平衡条件式:
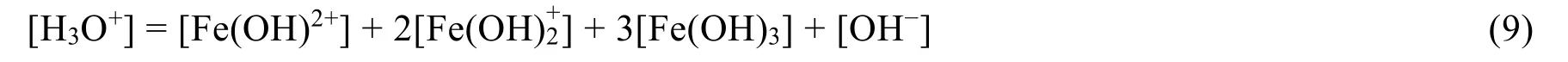
体系中存在的电荷平衡条件式:
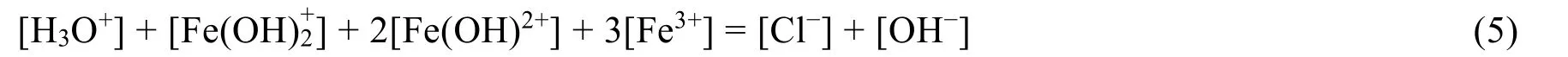
3.2 FeCl3溶液质子平衡条件式的推导
由质子平衡条件式(5)−条件式(7)可得:
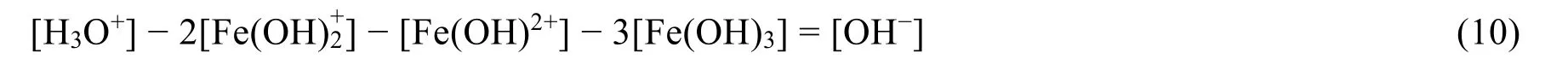
整理得质子平衡条件式(2):
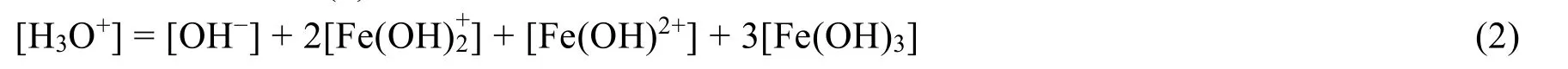
式(9)+式(7):
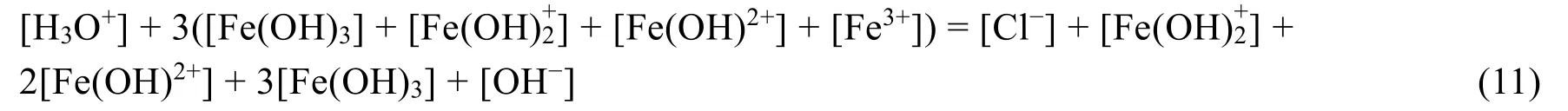
整理得质子平衡条件式(5):
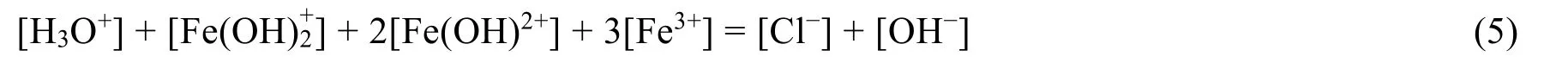
4 三种处理方法的特点与比较
综合上述分析,在推导类似FeCl3溶液体系的质子平衡条件式时,最常用的处理方法是按照强酸弱碱盐体系选取质子参考水准。该方法的质子水平选择单一,易于在此基础上建立质子平衡条件式,但在处理缓冲溶液体系时,由于酸式与碱式型体在体系中都是大量共存的,所以无法选取正确的质子参考水准进而推导出合理的结果。
第二种处理方法将溶液中酸式、碱式型体共存的体系转换为反应前的体系,使得书写更加容易,可以弥补第一种处理方法的不足。但是此方法的局限性在于,由于酸碱反应通常产生中性盐,这些盐本可不出现在质子平衡条件式中,而采用该方法书写便会不可避免地出现,使得书写出的质子平衡式相对冗长,不利于理解与处理。
第三种处理方法可以省略选取质子参考水准的步骤,保证了所推导质子平衡条件式的可靠性,但推导过程中要通过物料平衡与电荷平衡的加减进行,略显繁琐。
对于一般的体系,选取第一种处理方法对于正确书写无疑是有利的,针对第一种方法无法处理的缓冲体系,可选取第二种方法方便地推导出。但对于质子参考水准多或不易正确选取质子参考水准的体系,尤其在推导复杂缓冲体系中的质子平衡式时,选取第三种处理方法得到的平衡式不存在冗余项,优势相对第二种方法更加凸显。
5 其他复杂体系质子平衡条件式推导的应用举例
除FeCl3溶液外,四氯化锡(SnCl4)溶液也是常见的复杂体系之一。在配制SnCl4溶液时,为了防止其水解,一般还需要加入浓盐酸。对于这样的复杂体系,下面应用本文提出的三种处理方法简要推导其质子平衡条件式。
5.1 按照强酸弱碱盐体系进行处理
与FeCl3溶液一样,我们也可以将SnCl4溶液视作强酸弱碱盐体系,选取它与氯化氢分子作为质子参考水准,可得如下的质子平衡条件式:
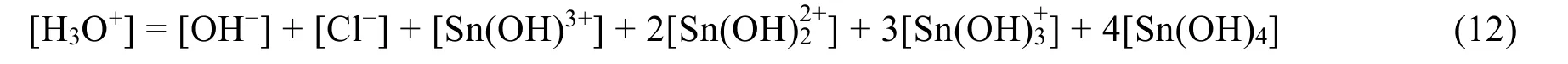
需要注意的是,这里的氯离子是由氯化氢分子解离产生的,所以此处氯离子的浓度[Cl−]是指由盐酸解离产生的浓度。
5.2 根据酸碱缓冲溶液体系进行处理
我们可以将体系看做由氢氧化锡与盐酸反应的产物,相应地将这两者选为质子参考水准,可得以下质子平衡条件式:

与5.1小节不同的是,此处的氯离子浓度[Cl−]是指平衡时溶液中的氯离子浓度之和。
5.3 根据溶液物料平衡和电荷平衡关系进行处理
首先写出该体系中的物料平衡关系式如下:

公式(14)中游离的氯离子[Cl−]是由SnCl4解离产生的。
由电荷守恒得到电荷平衡关系式:
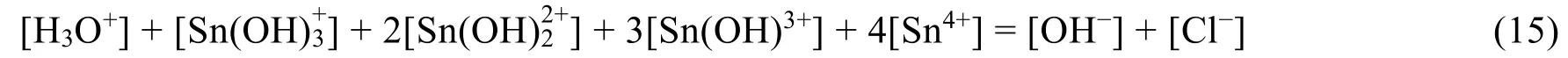
式(15)–式(14)得到:

综合比较上述按照三种不同方法推导的SnCl4溶液的质子平衡条件式,可以发现三种处理方法同样依旧成立,尤其是第二种处理方法的简便性更加突出。
6 结语
本文以FeCl3溶液为例,探讨了针对复杂体系质子平衡条件式的三种处理方法和推导结果。前两种方法的主要区别在于质子参考水准的选取,方法一参考了强酸弱碱盐的方法,方法二则将处理共轭酸碱对的方法拓展到了复杂体系的处理中,方法三则直接通过溶液中另外两个重要的平衡——物料平衡与电荷平衡进行了推导。这三种方法分别从不同的角度对该问题进行了探讨,当处理不同体系时,可按照实际情况与难易程度,采取适当的方法进行取舍。
当前化学不断发展,对于复杂体系的处理也日渐增多,我们借此为例希望可以使广大学生拓展思维、拓宽思路,在简单的问题上可以深入思考、总结归纳,以此巩固基础、提高兴趣,也为更多的化学爱好者从原理上更深入地学习掌握酸碱平衡与酸碱滴定提供了新的途径。这种逻辑处理方式同样可以拓展到配位解离平衡、沉淀溶解平衡的体系中,不仅有助于教师在教学中多角度、全方面地开拓学生思维,还有利于提高学生通过平衡的重要思想来处理解决化学问题的能力。
