高锰酸钾法测定白云石中钙的影响机制探究
2021-11-05向思佳廖光旭姚奇志金谷李玲玲
向思佳,廖光旭,姚奇志,2,*,金谷,李玲玲,2
1中国科学技术大学化学与材料科学学院,合肥 230026
2化学国家级实验教学示范中心(中国科学技术大学),合肥 230026
高锰酸钾是一种强氧化剂,利用高锰酸钾的强氧化能力发展形成的高锰酸钾滴定法,不仅可在不同pH下测定多种无机物和有机物的含量,而且MnO−4本身具有特殊的紫红色,可避免滴定过程中指示剂的添加;同时,其氧化还原反应往往是自催化的。因此,高锰酸钾滴定法是氧化还原滴定中最经典的滴定分析之一。其缺点是高锰酸钾溶液不太稳定;Mn的多种价态决定了其氧化还原反应历程较复杂,易于发生不利于测定的副反应。但如果高锰酸钾溶液配制和保存方法得当,滴定时严格控制酸碱度、温度、滴定速度等实验条件,可大幅度减少副反应的影响[1],达到测定的精度和准确度要求。“白云石中钙含量测定”就是利用高锰酸钾滴定由白云石[CaMg(CO3)2]转化形成的草酸钙(CaC2O4),间接测定矿物白云石中钙含量。其主要过程为:首先用HCl溶液溶解白云石矿样,再用沉淀剂(NH4)2C2O4溶液将Ca2+完全沉淀为草酸钙,过滤洗涤得到草酸钙沉淀,将带有沉淀的滤纸贴在烧杯壁上,用热蒸馏水将滤纸上的大部分沉淀洗入烧杯中,再用H2SO4溶液溶解沉淀并控制酸度,趁热用高锰酸钾标准溶液滴定。高锰酸钾溶液浓度用草酸钠基准标定[2]。该实验要求滴定开始时温度控制在70–80 °C,滴定结束温度不低于60 °C;滴定起始酸碱度控制在[H+] = 1 moL·L−1;滴定速度为慢-快-慢,即滴定开始时,必须待前一滴粉红色完全褪去才能滴下一滴,滴定速度随褪色速度加快而加快,近终点时要求逐滴加入,溶液颜色突变为粉红色半分钟不褪去,达到终点。
该实验成功的关键是草酸钙沉淀的制备和滴定条件的严格控制。要求制备的草酸钙沉淀晶体颗粒大而且均匀,避免吸附过多杂质引起误差;滴定开始控制好酸碱度、温度和滴定速度,结果误差可以控制在3‰以内。然而,学生在实验过程中,经常会发现两种明显存在的实验现象:1) 在样品测定中,用高锰酸钾溶液滴定草酸钙溶液与标定过程中用高锰酸钾滴定草酸钠溶液对比时,发现前者在滴入第一滴高锰酸钾溶液后的褪色速率显著大于后者;2) 用草酸钠标定高锰酸钾时,第一滴高锰酸钾溶液颜色常常需要5–20 min才能褪色;但部分学生不小心直接加入了数滴乃至1 mL高锰酸钾溶液时,高锰酸钾的粉红色往往会在几十秒内褪色。
针对第一个现象,笔者对比分析了标定与滴定反应时的实验条件差异,提出了几点猜想:① 滴定过程与标定过程存在金属离子的差异:标定的基准物质是草酸钠,溶液中有Na+;滴定过程中,被滴定物是草酸钙,溶液中有Ca2+;由此推测溶液中Ca2+可能催化了反应的快速发生,使得第一滴高锰酸钾溶液的粉红色褪色加快。② 滴定过程与标定过程存在滤纸的差异:标定的基准物质是草酸钠,被滴定物只有草酸钠;滴定过程中,除了被测物质草酸钙,还有用于过滤分离草酸钙沉淀的滤纸存在;因此,推测滤纸可能催化了反应的进行。③ 滴定过程中的滤纸可能充当还原剂:过滤用的普通滤纸主要由棉花纤维制成,滤纸中可能存在少量的还原性物质,其还原能力可能比C2O42-更强,优先与高锰酸钾发生氧化还原反应生成Mn2+,Mn2+进一步催化草酸根与高锰酸根的反应。后两种假设虽然都与滤纸有关,但其机理不同,结果也不同。假设②中滤纸只作为催化剂,则对滴定终点无影响;而假设③滤纸中的成分发挥了还原剂的作用,会对滴定终点产生影响。鉴于此,我们分别设计不同条件实验进行实验探究,试图阐明上述实验现象背后蕴藏的化学反应过程和本质。
1 验证实验
1.1 实验试剂
草酸钠(AR),高锰酸钾(AR),硫酸(AR),碳酸钙(AR),所有试剂均购自国药集团。
1.2 溶液的配制
1) 0.05 mol·L−1草酸钠标准溶液:用分析天平称取3.3500 g分析纯的草酸钠,用蒸馏水定容至500 mL容量瓶中,得到0.05000 mol·L−1的草酸钠标准溶液。
2) 0.02 mol·L−1高锰酸钾溶液:量取60 mL 0.1 mol·L−1高锰酸钾溶液,在试剂瓶中稀释到300 mL,摇匀,备用。
1.3 高锰酸钾溶液浓度的标定
准确移取25.00 mL草酸钠标准溶液至250 mL烧杯中,加入120 mL热蒸馏水,加热至近沸,加入体积比为1 : 2的H2SO4溶液10 mL,立即用高锰酸钾溶液滴定至粉红色,且半分钟不褪色,记录消耗的高锰酸钾溶液体积。滴定开始需规范确保每一滴粉红色褪去再滴加下一滴,滴定过程需用玻璃棒搅动溶液。
1.4 高锰酸钾溶液快滴的探究
与高锰酸钾溶液浓度标定相同,但最初不是逐滴加入,分别直接快速滴加1 mL和5 mL高锰酸钾溶液。
1.5 对金属离子差异的探究
与高锰酸钾溶液浓度标定相同,但在滴定前加入0.12 g碳酸钙。
1.6 滤纸存在差异的探究
用草酸钠标定高锰酸钾溶液浓度过程没有滤纸,而用高锰酸钾溶液滴定草酸钙的过程存在着过滤用的滤纸,与高锰酸钾溶液浓度标定相同,但在滴定前贴壁分别加入一张、半张与过滤用同批次滤纸。
1.7 温度条件实验
该实验要求滴定时,溶液温度控制在70–80 °C,滴定结束时温度不能低于60 °C。在实验过程中,几乎相同的操作,高锰酸钾褪色速度也会存在差异,推测是因为滴定开始温度差异的影响,为了探究温度对实验的影响,添加了室温下直接滴定实验组,观察实验现象并记录第一滴溶液褪色所需时间。
1.8 实验数据记录
以上实验得到的数据分别记录在表1和表2中。

表1 不同滴定条件下高锰酸钾溶液的褪色时间
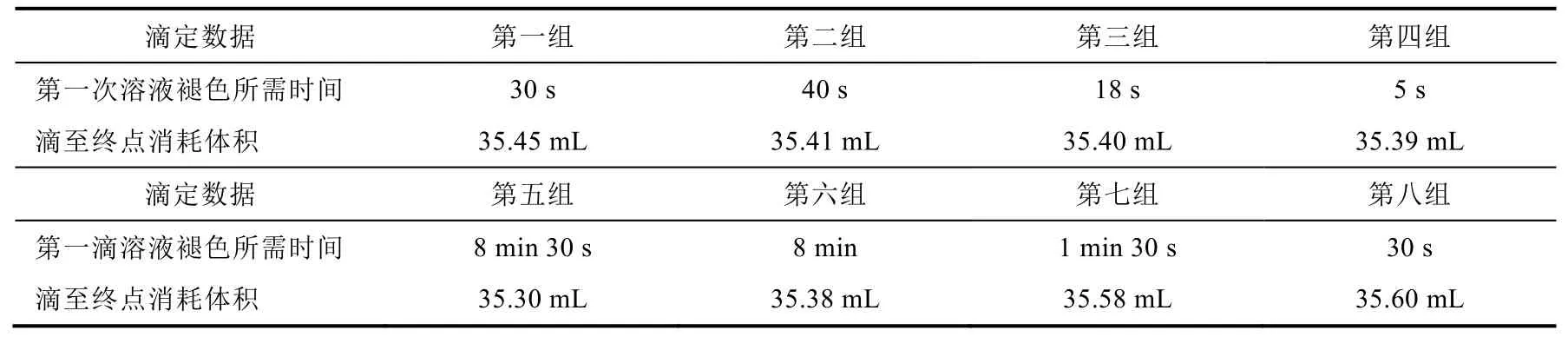
表2 不同滴定条件下高锰酸钾溶液褪色时间和消耗体积
2 结果与讨论
我们发现严格按照教材规范操作进行标定实验,滴定开始溶液温度为80 °C时,第一滴高锰酸钾粉红色完全褪去需要7 min 30 s,滴定终点消耗高锰酸钾溶液体积为35.30 mL (表1)。若实验开始时迅速加入1 mL和5 mL高锰酸钾溶液进行快滴,我们发现此时高锰酸钾能迅速与草酸反应,在几秒到几十秒内就褪色。并且在快速加入5 mL高锰酸钾的实验组中,还观察到大量棕褐色沉淀产生,推测是未来得及与草酸反应的高锰酸钾自分解生成的二氧化锰。快滴组终点消耗高锰酸钾溶液平均体积分别为35.43 mL和35.40 mL (表2),比标定实验组的35.30 mL多消耗高锰酸钾溶液体积约0.1 mL,在其他条件均相同的情况下,利用假设检验法,最终计算得到统计量的观察值t= 8.555 >t0.05(3) = 2.353[3],指示在95%的置信度下,快滴组平均消耗高锰酸钾溶液显著高于标定组。这说明,尽管慢滴的反应时间更长,但快滴时更高的高锰酸钾浓度会导致更多的高锰酸钾自分解。这是因为高锰酸钾在强酸性条件下发生自分解反应而放出氧气,其反应方程式如下:
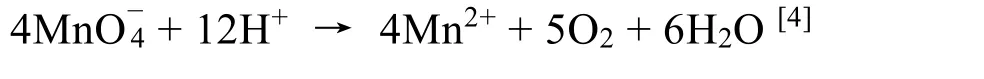
而这多消耗的约0.1 mL高锰酸钾溶液,导致近3‰的误差,在定量分析中这是不允许的。这也就是为什么高锰酸钾法要求滴定速度慢-快-慢,即开始逐滴加入,等粉红色褪去才能加入下一滴的原因。
对比表2第一至第四组的数据发现,快滴5 mL比快滴1 mL褪色更快,因为快滴5 mL产生更多的Mn2+起到了催化剂作用,导致反应速度更快。此外,在直接快速放入5 mL高锰酸钾的快滴实验中,起初产生了大量棕褐色沉淀,随着滴定继续进行,棕色沉淀在几十秒内逐渐消失,而且终点消耗的高锰酸钾溶液体积没有同等增多,推测产生的棕色沉淀二氧化锰与草酸钠发生进一步反应,最终生成二价锰离子,该推测在马文清等[5]“草酸钠-高锰酸钾返滴定法快速测定软锰矿中的MnO2”得到佐证,即滴定中途产生的二氧化锰最终与草酸钠反应生成二价锰,导致消耗的高锰酸钾溶液体积没有同步增大。
金属离子差异的影响:标定的基准物质是草酸钠,溶液中有Na+;但滴定过程中被滴定物是草酸钙,溶液中存在Ca2+;由此推测溶液中Ca2+可能催化了反应的快速发生,使得第一滴高锰酸钾溶液的粉红色褪色加快。而Ca2+是非变价的碱土金属离子,其作为氧化还原催化剂的可能性几乎没有,所以从化学原理上说该推测不成立。实验结果也进一步给出证实。根据加钙组的数据与标定数据对比可知,单独加入钙离子对反应速率的影响并不大,终点消耗高锰酸钾溶液体积没有明显差别(表2),因此,钙离子对滴定开始的反应速度和终点消耗体积没有影响,这与理论分析完全吻合。
滤纸存在的影响:对加入滤纸组与标定对照组数据(表1、2)进行分析,发现正是滤纸的加入加速了反应速度。同时,滤纸组比标定组的终点高锰酸钾消耗量多出0.30 mL左右,说明滤纸上的确有还原性物质与高锰酸钾反应。因此实验操作中要求“将滤纸贴壁,等褪色后再将滤纸全部推入溶液”是必要的。若最初就将滤纸浸入,其中的还原性物质会充分和高锰酸钾溶液反应,造成更大误差;为此我们设置了加入一整张滤纸和半张滤纸的对比实验(表1),实验表明第一滴溶液褪色时间和加入滤纸的量有关,这进一步证明滤纸上的还原性物质加速了初始反应速度,导致高锰酸钾粉红色褪色加快。
滴定起始温度影响:在实验过程中,发现温度差异对高锰酸钾与草酸钠的反应有明显影响,为此,开展不同温度的滴定实验。表1列出了室温下高锰酸钾溶液滴定草酸钠的实验结果,发现第一滴高锰酸钾溶液的粉红色褪色用了近20 min,而且实验过程中还观察到溶液颜色呈现一系列改变,即经历了由紫红→桃红→橙红→黄色,最后到无色的复杂过程,实验最终消耗的高锰酸钾体积误差也很大。因此,温度对高锰酸钾滴定法影响较大,控制滴定初始温度为80 °C左右,滴定结束温度不低于60 °C是很必要的。
3 结语
探究实验结果表明,快滴会使高锰酸钾溶液发生自分解从而带来一定的负误差;钙离子对滴定速度没有影响;滤纸中的还原性物质可以快速与高锰酸钾反应生成锰离子,这些锰离子又作为催化剂催化反应进行,从而使高锰酸钾粉红色褪色加快。但滤纸的浸入也会带来一定的误差,不同批次的滤纸含有的还原性物质量不等,实验统计显示存在0.05–0.30 mL左右的负误差,因此,对于白云石中钙含量测定的实验,实验步骤中强调先慢后快再慢是有必要的,同时也建议添加同批次滤纸空白实验,以提高实验的准确度。
