瘤胃和牛奶中奇链支链脂肪酸含量与瘤胃微生物蛋白产量的相关性研究
2021-11-05徐宏建张淑枝管佳琦辛杭书
刘 鑫 姜 鑫 徐宏建 张淑枝 管佳琦 辛杭书*
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.扶余禾丰饲料有限公司,扶余 131200;3.沈阳禾丰反刍动物饲料有限公司,沈阳 110164;4.沈阳农业大学动物科学与医学学院,沈阳 110161)
现阶段测定瘤胃微生物蛋白(MCP)方法很多,但多数会对动物造成不同程度的伤害,且成本较高,因此,不管是从学术角度出发,还是从应用实践方面考虑,都有必要研究出一种简单易行并对试验动物无损害的方法来估测反刍动物瘤胃中MCP含量。1962年,美国马里兰大学的学者Keeney等[1]首次提出,奇链支链脂肪酸(odd- and branched-chain fatty acids,OBCFA)主要来自于瘤胃微生物的合成,而非动物自身合成。OBCFA包括奇数直链脂肪酸(OCFA)和支链脂肪酸(BCFA),支链脂肪酸主要是具有甲基支链的饱和脂肪酸,根据甲基位置不同,分为异构(iso)脂肪酸和反异构(anteiso)脂肪酸[2]。OBCFA主要包括:十四烷酸的异构体(iso-tetradecanoicaicd,iso-C14∶0)、十五烷酸(pentadecanoic acid,C15∶0)、13-甲基十四烷酸(13-methyltetradecanoic acid,iso-C15∶0)、12-甲基十四烷酸(12-methyltetradecanoic acid,anteiso-C15∶0)、棕榈酸的异构体(iso-hexadecanoic acid,iso-C16∶0)、十七烷酸(heptadecanoic acid,C17∶0)、15-甲基棕榈酸(15-methylhexadecanoic acid,iso-C17∶0)、14-甲基棕榈酸(14-methylhexadecanoic acid,anteiso-C17∶0)。这些脂肪酸满足瘤胃微生物内部标记的大多数要求,因为它们是稳定的化合物,通过非侵入性的手段在牛奶中容易获得,不影响动物福利,且易于测定。OBCFA可随微生物物种变化而改变[3],且在液相(LAB)和固相(SAB)细菌之间也存在差异[4]。与嘌呤/氮(PB/N)不同,LAB和SAB之间的OBCFA/蛋白质没有差异,这是将OBCFA作为瘤胃微生物内部标记的一个优势[5]。因此,OBCFA很可能具备作为瘤胃微生物标记物的潜能。
2000年,英国学者Dewhurst等[6]提出,可以通过动物产品中的OBCFA含量,对从瘤胃流出的微生物进行定量估测。随后Vlaeminck等[7]将10种常见的奶牛饲粮分为4种类型,分别以其为底物经过体外发酵21 h后发现,随着饲粮中淀粉含量的增加,发酵液中奇直链脂肪酸(C15∶0和C17∶0)在总OBCFA的比例也随之增加,而中性洗涤纤维(NDF)的含量与发酵液中的anteiso-C15∶0含量呈显著的正相关关系,并且OBCFA含量与发酵液中的乙酸、丙酸和丁酸的摩尔比例也高度相关,其R2值分别达到79.6%、86.6%和84.9%;而后,研究者又进一步提出,基于多元线性回归发现瘤胃内的pH及氨态氮(NH3-N)含量和挥发酸(VFA)的摩尔比例与OBCFA含量密切相关,通过OBCFA含量能够反映瘤胃环境状况[8],且与饲粮组分比较,瘤胃中的OBCFA含量更能准确预测出瘤胃的发酵模式[9-10]。Vlaemick等[7]建立了在牛奶和十二指肠中排泄的嘌呤碱(PB)和二氨基丙酸(DAPA)数量与OBCFA含量之间的关系,这些关系通过Cabrita等[11-12]描述的独立试验数据进行验证,发现基于乳OBCFA含量的预测比基于饲粮的模型能更好地描述十二指肠MCP流量的变化[13]。而Castro-Montoya等[14]在荷斯坦奶牛的试验中,得出鸟嘌呤衍生物含量与牛奶OBCFA含量并不存在相关关系的结论。引起不同试验结果的原因尚不明确,所以,有学者提出,对于OBCFA从瘤胃转运到牛奶的途径,仍需要大量的研究工作[15]。
根据Song等[16]的研究发现,瘤胃灌注不同浓度的氨素能够显著影响瘤胃发酵模式以及MCP产量,也改变了进入十二指肠的微生物流入量,而OBCFA主要来自于瘤胃微生物[1],因此,氨素的摄入量也可以改变瘤胃及牛奶中OBCFA的产量。体外试验结果表明,OBCFA含量与瘤胃微生物存在相关关系[17],为进一步验证OBCFA含量与瘤胃MCP含量的相关性,需要进行体内试验。因此,本试验对奶牛瘤胃灌注不同剂量碳酸氢铵(NH4HCO3),旨在更加充分地评价OBCFA含量和瘤胃MCP含量的相关性,以期为OBCFA作为奶牛MCP标记物提供数据参考。
1 材料与方法
1.1 试验设计和样品采集

奶牛分别在每天07:00和14:00饲喂等量的全混合日粮,其组成及营养水平见表1,自由饮水。于每日07:00、14:00和21:00进行3次挤奶,每头牛每次取3个重复。根据早、中、晚3次的产奶量,将牛奶按照比例进行混合,共27个样本,于-20 ℃保存,用于测定牛奶中OBCFA含量。
于采样期晨饲后2、4、6、8、10和12 h进行瘤胃液和瘤胃内容物采集,共54个样本。将瘤胃液经4层纱布过滤后,取10 mL进行pH测定,然后平均分装在2个10 mL离心管中,分别向每个离心管中加入1 mL 25%的偏磷酸,于-20 ℃保存,用于测定VFA和NH3-N含量。然后,将200 mL瘤胃内容物进行冻干处理,用于MCP和OBCFA含量的测定。
1.2 瘤胃和牛奶中OBCFA含量的测定
1)试剂和配制方法。10%盐酸甲醇:将10 mL乙酰氯逐滴加入到100 mL甲醇中。6% K2CO3溶液:6 g K2CO3溶解于100 mL纯水中。气相色谱内标溶液:0.2 g十九烷酸溶于100 mL苯中,冷藏保存。
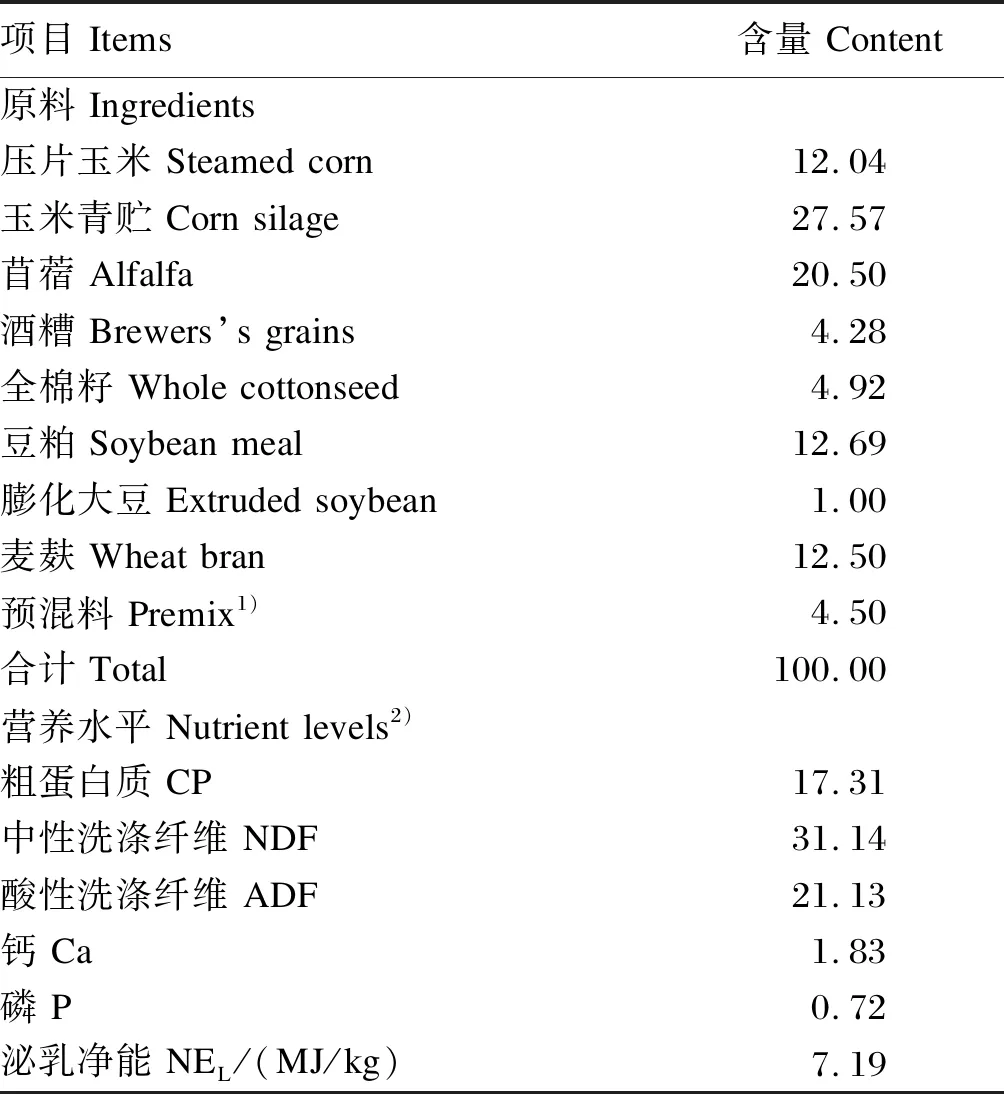
表1 饲粮组成及营养水平(风干基础)
2)分析方法。脂肪酸的提取和甲基化基于Sukhija等[18]描述的方法并加以改进。准确称量冻干样品200 mg置于15 mL离心管中。加入1 mL含有内标的苯,1 mL苯和3 mL 5%盐酸甲醇。缓慢旋涡1 min,使样品离管底2~3 cm。70 ℃水浴2 h后,冷却至室温,并加入5 mL 6% K2CO3和2 mL苯。中速漩涡30 s后于1 500 r/min离心5 min,并将上部有机相转移至5 mL EP管中。向培养管中的苯提取物中加入1 g无水硫酸钠,再次涡旋30 s并静置1 h。培养管于1 500 r/min离心5 min,并将含有甲酯的上层转移到新的培养管中,用N2吹至近干,重新溶于1 mL苯中,所得溶液利用气相色谱仪(岛津GC-2010)测定OBCFA含量。
3)气相色谱测定条件。使用EquityTM-1气相色谱柱(15 m×0.1 mm×0.1 μm);分析条件为:分流比为200∶1,进样口和检测器保持在280 ℃。升温程序从175 ℃开始,以15 ℃/min增加至275 ℃,保持1 min来分离脂肪酸甲酯。气流:载气氮气,45 cm/s;氢气,40 mL/min;空气,400 mL/min。通过将它们的保留时间与外标的保留时间进行比较来鉴定脂肪酸甲酯。
1.3 瘤胃发酵参数的测定
1.3.1 pH的测定
取出瘤胃液后,立即用Statious-10 pH计测定pH。
1.3.2 NH3-N含量的测定
采用靛酚蓝法测定瘤胃液中NH3-N的含量[19],测定仪器为紫外分光光度计(UV1901;波长:550 nm)。
1.3.3 VFA含量的测定
参照Stewart等[20]描述的方法,采用气相色谱仪(岛津GC-2010)测定瘤胃液中乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸的含量。
1.3.4 MCP含量的测定
瘤胃液中MCP含量根据Zinn等[21]报道的分光光度法进行测定,测定仪器为紫外分光光度计(UV1901;波长:260 nm)。
1.4 数据处理与分析
所有数据均采用SAS 9.2进行统计分析。使用MIXED模型对瘤胃发酵指标及MCP、OBCFA含量进行差异统计分析。P<0.05代表差异显著,结果用平均值和标准误的形式表示。使用PROC CORR过程分析OBCFA含量与pH及NH3-N、MCP和VFA含量之间的关系,分析结果通过Pearson方法进行检验,P<0.10表示趋于相关,P<0.05表示显著相关。OBCFA含量作为自变量数据集,MCP含量和发酵参数数据作为变量数据集。多元回归分析利用REG过程的STEPWISE方法,得到的方程使用最小二乘法估计显著性(P<0.05)。
2 结果与分析
2.1 瘤胃灌注不同剂量的NH4HCO3对瘤胃和牛奶中OBCFA含量的影响
由表2可知,瘤胃灌注NH4HCO3显著改变瘤胃内异构十四烷酸(iso-C14∶0)、异构十七烷酸(iso-C17∶0)和总异构脂肪酸(total iso-fatty acids,TIFA)的含量(P<0.05),其中,iso-C14∶0和TIFA的含量随着NH4HCO3灌注剂量的升高呈现先降低后增加的变化,而iso-C17∶0的含量逐渐增加。其他脂肪酸含量并没有显著变化(P>0.05)。
由表3可知,牛奶中只有反异构十五烷酸(anteiso-C15∶0)的含量随着NH4HCO3灌注剂量的升高有逐渐升高的趋势(P=0.07),而其他脂肪酸含量并无显著变化(P>0.05)。

表2 瘤胃灌注不同剂量的NH4HCO3对瘤胃OBCFA含量的影响
以上指标,表3同。Above indexes, the same as Table 3.

表3 瘤胃灌注不同剂量的NH4HCO3对牛奶中OBCFA含量的影响
2.2 瘤胃灌注不同剂量的NH4HCO3对瘤胃发酵参数和MCP含量的影响
由表4可知,随着瘤胃灌注NH4HCO3剂量的增加,MCP的含量有逐渐增加的趋势(P=0.06)。而其他发酵参数均未见显著变化(P>0.05)。
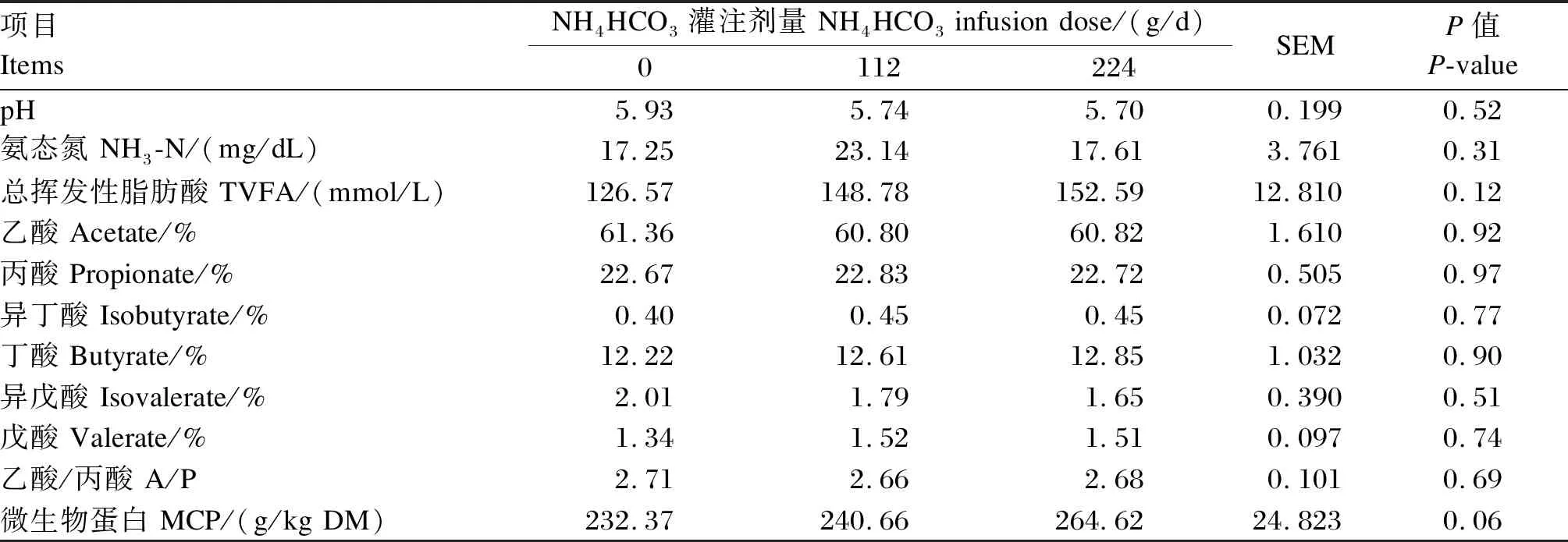
表4 瘤胃灌注不同剂量的NH4HCO3对瘤胃发酵参数和MCP含量的影响
2.3 瘤胃和牛奶中OBCFA含量与瘤胃发酵参数及瘤胃MCP含量的相关关系
由表5可知,瘤胃中OBCFA含量与瘤胃发酵参数及MCP含量存在显著的相关关系(r=0.26~0.84;P<0.05)。且较强相关关系存在于乙酸与C15∶0(r=0.60)、iso-C17∶0(r=0.52)及TOFA含量(r=-0.52);丙酸与C15∶0(r=0.51)、iso-C16∶0(r=-0.60)、iso-C17∶0(r=-0.52)、TIFA(r=-0.64)和OBCFA含量(r=-0.52);丁酸与C15∶0(r=-0.53)和C17∶0含量(r=-0.58);异戊酸与anteiso-C17∶0含量(r=0.53);乙酸/丙酸与C15∶0(r=0.57)、iso-C16∶0(r=-0.52)、iso-C17∶0(r=0.54)、TIFA(r=0.64)、TOFA(r=0.55)及OBCFA含量(r=0.52);MCP与anteiso-C15∶0(r=0.79)、anteiso-C17∶0(r=0.76)和TAFA含量(r=0.84)。
由表6可知,牛奶中OBCFA含量与瘤胃发酵参数及MCP含量存在显著的相关关系(r=0.11~0.89;P<0.05)。且较强相关关系存在于pH与anteiso-C17∶0(r=-0.76)和TAFA含量(r=-0.73);NH3-N与iso-C17∶0(r=0.71)、C17∶0(r=0.84)和TBFA(r=0.84)和TOBCFA含量(r=0.84);乙酸与anteiso-C15∶0(r=-0.89)、TAFA(r=-0.81)和TBFA含量(r=-0.76);丁酸与anteiso-C15∶0(r=0.76)、anteiso-C17∶0(r=0.71)、TAFA(r=-0.76)、TBFA(r=0.81)和TOBCFA含量(r=0.71);戊酸与anteiso-C15∶0(r=0.72)和TAFA含量(r=-0.75);乙酸/丙酸与anteiso-C15∶0含量(r=-0.76);MCP与anteiso-C15∶0含量(r=0.78)。
利用瘤胃和牛奶中OBCFA含量建立瘤胃发酵参数和MCP含量的预测方程如表7所示。预测方程经最小二乘法估计发现均在显著水平(P<0.05),除异丁酸和戊酸含量外,其他各种VFA含量预测方程的R2值相近。利用瘤胃中OBCFA含量预测乙酸、丙酸和丁酸含量的R2分别为0.56、0.47和0.42,而利用牛奶中OBCFA含量预测乙酸和丁酸含量的R2分别为0.79和0.58。利用瘤胃和牛奶中OBCFA含量预测MCP含量,回归方程的R2分别为0.96和0.60。
3 讨 论
本试验中随着NH4HCO3剂量的增加,瘤胃中iso-C17∶0的含量有逐渐增加的趋势,但牛奶中的含量并没有显著变化,这与脂肪酸在乳腺中的重新合成有关。而Cabrita等[11]研究显示,随尿素替代比例增为1%,饲粮中真蛋白的含量降低,牛奶中iso-C17∶0的含量减少,与本试验结果存在差异的原因可能是饲粮结构导致的。OBCFA主要存在于微生物的细胞膜上[2],因此,OBCFA含量的变化可以在一定程度上反映出瘤胃微生物的变化。本研究发现,向瘤胃中灌注高剂量的NH4HCO3时,显著改变了牛奶中TIFA的含量,尤其是iso-C14∶0和iso-C17∶0的含量,这说明氮素供给的增加,可能与瘤胃中携带异构脂肪酸的微生物的增长有某种关联,但具体机制尚不清楚,需要进一步的深入研究。

表5 瘤胃中OBCFA含量与发酵参数和MCP含量的相关关系

表6 牛奶中OBCFA含量与发酵参数和MCP含量的相关关系

表7 利用瘤胃和牛奶中OBCFA含量建立瘤胃发酵参数和MCP含量的预测方程
研究发现,瘤胃微生物对NH3-N含量耐受范围为6~30 mg/mL[1],若NH3-N含量过低,瘤胃发酵的“解偶联”会导致MCP合成效率下降[22]。本试验中,随NH4HCO3灌注剂量的增加,奶牛瘤胃NH3-N含量升高并均处于正常范围内,说明NH4HCO3的灌注能够在不影响瘤胃功能的前提下,为瘤胃微生物提供更多的氮源。此外,尽管本研究中各个VFA的含量未因NH4HCO3的灌注剂量不同而发生明显变化,但随NH4HCO3灌注剂量升高,TVFA含量呈上升趋势。这可能是由于NH4HCO3的灌注促进了瘤胃微生物的活动,进而促进碳水化合物降解,最终导致更高的VFA含量。更高的VFA含量能够为微生物活动提供更多的能量[23]。因此,NH4HCO3的灌注为瘤胃微生物合成MCP提供了充足的能量和氮源,这也是本试验中瘤胃MCP含量随NH4HCO3灌注剂量增加而增加的原因。
本研究中,瘤胃内的异构脂肪酸含量与pH之间存在正相关,这是可以预料的,因为纤维分解菌中富含异构脂肪酸[24],pH偏低时会对纤维分解菌产生负面影响[25],因此pH降低会减少瘤胃内的异构脂肪酸含量。Zhang等[26]研究发现,OBCFA和乙酸含量之间存在正相关,但与丙酸和丁酸含量之间存在负相关,可能与游离形式存在的VFA在瘤胃壁的吸收率不同(丙酸>乙酸)所致[27],本研究也发现了类似的现象。同样,Vlaeminck等[8]建立的预测方程经过有效性检验,认为牛奶乳脂中的OBCFA含量可以估测瘤胃中VFA的含量。
MCP是奶牛代谢蛋白供应的主要成分,而OBCFA是瘤胃微生物细胞膜的独有成分[28]。本试验数据表明,MCP含量与anteiso-C15∶0和anteiso-C17∶0的含量均存在较强的正相关关系,可能与瘤胃内发酵糖和肽类物质的细菌(如普雷沃氏菌、多毛毛螺菌和溶糊精琥珀酸弧菌)多含反异构脂肪酸有关,例如,普雷沃氏菌中的anteiso-C15∶0含量可达到3.67 g/kg脂肪酸[24]。此外,线性回归分析显示利用anteiso-C15∶0和anteiso-C17∶0含量来预测MCP含量的R2较高,这一结果表明,用此2种脂肪酸可预测瘤胃MCP含量。同时,也有研究表明,OBCFA含量预测MCP含量的变化具有稳健性,且固相和液相相关细菌中的OBCFA∶N比例相对恒定[4],这也意味着瘤胃中OBCFA作为预测微生物产量的标记物具有很大的潜力。
然而,关于是否可以利用牛奶中OBCFA的含量来预测MCP含量,学术界存在不同看法。Vlaeminck等[13]认为,用牛奶中的OBCFA含量之所以可作为MCP的潜在生物标志物,是由于牛奶中OBCFA和十二指肠微生物中的二氨基庚二酸以及嘌呤碱基含量之间存在正相关关系。然而,Dewhurst等[22]发现奶中OBCFA和十二指肠微生物中的嘌呤碱基含量之间没有任何关系。随后Castro-Montoya等[29]为探索OBCFA作为瘤胃MCP潜在生物标志物的可行性,研究了尿液中嘌呤和氮浓度与牛奶中OBCFA比例和含量之间的相关关系,结果显示,牛奶中OBCFA的比例和含量与通常用作瘤胃MCP含量指标的尿液参数之间没有密切关系。难以确定牛奶中OBCFA含量与瘤胃MCP含量之间的定量关系可能是由于[30-31]:1)各种OBCFA肠道吸收效率的差异;2)OBCFA运输到血液中的“模式”不同;3)某些OBCFA会在乳腺或其他组织中重新合成;4)脂肪组织中会储存一些OBCFA,并且其会在脂肪动员期间得到释放;5)从瘤胃流向十二指肠时,OBCFA转移到牛奶中的比例降低。Westreicher-Kristen等[32]提出通过牛奶中单个或全部OBCFA含量只能适度地预测MCP的合成,很可能是OBCFA在流入牛奶的过程中发生了转移或者微生物群落组成发生变化所致。本研究利用OBCFA在多元线性回归的基础上预测MCP含量,从当前结果来看,并非所有的OBCFA都是MCP含量的可靠或准确的预测指标,可能是单个脂肪酸的反应比一组脂肪酸更为敏感,在一个组内会发生某些拮抗作用,这意味着一个特定脂肪酸含量的增加可能与其他具有相似结构的脂肪酸含量的减少有关,从而抵消了某些OBCFA的预测能力。根据本试验结果所展现的anteiso-C15∶0与MCP含量之间的相关关系,我们可以认为,作为非侵入性预测MCP含量的方法,利用牛奶中OBCFA含量仍是一种有潜力的途径,但要提高预测的准确性,未来仍然需要大量的深入研究,以阐明瘤胃中OBCFA含量与牛奶中OBCFA含量的准确关系。
4 结 论
瘤胃灌注高剂量NH4HCO3能够显著增加瘤胃内iso-C14∶0和iso-C17∶0和总异构脂肪酸的含量,同时瘤胃MCP的含量也随之趋于提高。此外,瘤胃中的anteiso-C15∶0和anteiso-C17∶0以及牛奶中的anteiso-C15∶0与MCP含量呈显著正相关,因而它们具有作为标记物预测瘤胃MCP含量的潜力。
