乳腺囊内乳头状癌临床病理及预后分析
2021-11-05罗华何俊玲杨欧欧蓝天苏昆仑杨慧芬詹晨妮何佳炜徐海滨胡祖健
罗华 何俊玲 杨欧欧 蓝天 苏昆仑 杨慧芬 詹晨妮 何佳炜 徐海滨 胡祖健*
乳腺囊内乳头状癌(IPC)也称包被性乳头状癌(EPC),表现为囊性扩张导管内形成纤维血管轴心的乳头状结构,肿瘤周围有厚的纤维囊壁包被,界限清楚[1]。与普通乳头状癌不同,IPC 具有独特的临床特征,好发于老年女性,也偶有老年男性发病,以乳房肿块或乳头溢血为主要临床表现,是一种低级别恶性肿瘤[2]。本文回顾性分析15 例IPC 患者的临床资料及随访结果,并随机选取同期手术并经病理确诊的45 例浸润性导管癌(IDC),比较其临床病理特征及预后,以提高对本病的诊治水平。
1 资料与方法
1.1 临床资料 回顾性分析2007 年1 月至2017 年12月本院手术治疗的乳腺囊内乳头状癌(IPC组)15 例,按1∶3比例随机选取同期手术治疗的乳腺浸润性导管癌(IDC组)45 例,均经手术病理确诊。排除新辅助治疗和初诊IV 期患者。收集患者年龄,性别,超声表现,乳腺X 线表现,手术方式,病灶大小,腋窝淋巴结转移,分子分型,无复发生存率等资料。
1.2 方法 所有患者术前均行乳腺B 超和乳腺X 线摄影检查,其中1 例IPC 患者行超声造影检查;3 例IPC行乳腺磁共振检查。所有标本石蜡包埋,连续切片(4 μm 厚),HE 染色,免疫组织化学染色采用EnVision法。雌激素受体(ER)及孕激素受体(PR)判断标准参照CSAP 指南[3],以1%为阳性界值;≥1%的肿瘤细胞核染色判断为阳性;在有阳性内参对照的情况下,<1%的肿瘤细胞核染色为阴性;免疫组化人表皮生长因子受体(Her-2)(0 或+)为Her-2 阴性,Her-2+++为Her-2 阳性;Her-2++为不确定,进一步FISH 检测,如有扩增判断为Her-2 阳性;Ki-67 以>14%作为Ki-67高表达界值[4]。
1.3 治疗方法 乳房手术方式包括单纯乳房切除或保乳手术,腋窝手术方式包括前哨淋巴结活检或腋窝淋巴结清扫;保乳患者常规行放射治疗;15 例IPC 患者均未行化疗,IDC组患者根据NCCN 诊治指南,结合患者年龄、TNM 分期和分子分型制定辅助治疗方案;如ER和/或PR 阳性,则行内分泌治疗,药物包括他莫昔芬和芳香化酶抑制剂。
1.4 随访 采用门诊复查、电话随访相结合的方式。术后2 年内随访1 次/3 个月,3~5 年内随访1 次/6 个月,5 年后随访1 次/年。包括B 超(乳房、腋窝、锁骨上淋巴结、肝脏),每年复查胸部CT 和对侧乳腺X 线摄影检查。
1.5 统计学方法 应用R 4.0.3 软件。计数资料比较采用卡方检验及Fisher 精确检验,Kaplan-Meier 法绘制生存曲线、对数秩(Log-rank)检验进行生存分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床病理特征比较 见表1。

表1 囊内乳头状癌与浸润性导管癌临床病理特征比较
2.2 两组患者的超声特征比较 所有患者均行超声检查,15 例IPC 常规超声均显示占位性病变,40%为囊实混合性病变(见图1A);60%为低回声改变(见图1B);93.3%IPC 超声均显示边界清楚肿块,66.7%表现为形态规则,多为椭圆形,33.3%形态不规则;US-BIRADS 评分为3 类2 例,4a 类11 例,4b 类2 例。其中1例男性IPC 病例行超声造影检查,超声造影显示(见图1C):经静脉注射微泡声学造影剂SonoVue 3.6 mL,目测第12S 进入,第21S 达峰值,第30S 开始廓清,呈快进、慢出、弥漫性、不均匀性高增强(液性区域呈充盈缺损,实性区域呈高增强,界限清晰),增强范围与二维灰阶面积相仿,形态规则,边缘尚光整,周围可见3~4支首先增强的滋养血流。本例常规超声US-BI-RADS评分为4A,造影后评分为US-BI-RADS 4C。而IDC组患者均表现为低回声占位,形态多不规则,无囊实混合回声表现;26.7%IPC 超声均显示边界清楚肿块,73.3%显示病灶边界不清。

图1 超声影像图
2.3 两组患者乳腺X 线特征比较 所有患者均行乳腺钼靶检查,15 例IPC 患者中,除1 例钼靶未见异常改变,93.3%表现为边界清楚的类圆形或卵圆形高密度影(见图2),20%伴钙化;BI-RADS 评分为2 类1 例,4A 类7 例,4B 类4 例,4C 类2 例。IDC组患者多表现为边界模糊的高密度影,其中28.9%伴钙化。
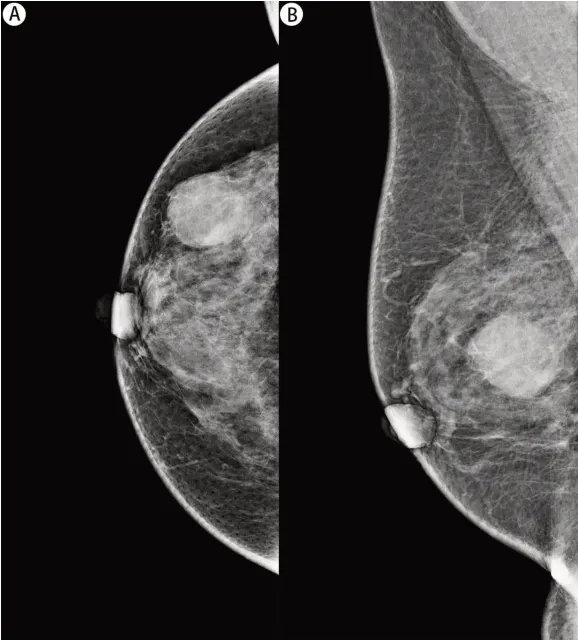
图2 钼靶头足位(A)和内外斜位(B)示右乳类圆形肿块,边界清
2.4 IPC组患者磁共振表现 3 例IPC 行乳腺磁共振检查,1 例表现为类圆形肿块影伴毛刺,T1WI 呈稍高信号,T2WI 呈高信号,其内见乳头状低信号(见图3);增强后病灶明显强化,时间强度曲线呈流出型改变,BI-RADS 评分4B;1 例表现为乳晕后方卵圆形肿块影,T1WI 呈等低信号,T2WI 呈高信号;增强后病灶早期明显强化,时间强度曲线呈平台型改变,BI-RADS 4B;1 例表现为T1WI 高信号,T2WI 高信号,病灶边缘、分隔及内部结节明显强化,时间强度曲线呈流出型改变,BI-RADS 4C。
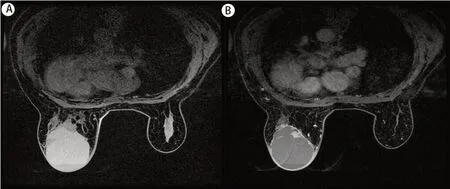
图3 MRI示左乳类圆形肿块影伴毛刺,T1WI呈稍高信号(A),T2WI呈高信号(B),其内见乳头状低信号,增强后病灶明显强化
2.5 病理学检查 15 例IPC 中,8 例为单纯性IPC(见图4A-C),1 例IPC 伴导管内癌(见图4D-F),6 例IPC伴浸润性癌(见图4G-I)。IPC组肿块平均直径20.5 mm,IDC 肿块平均直径20.2 mm。15 例IPC 中,仅1 例IPC伴浸润癌腋窝淋巴结有转移,IPC组腋窝淋巴结转移(6.7%)明显低于IDC组(40%)(P=0.023)。免疫组化:13 例IPC 肿瘤细胞ER 阳性表达,12 例IPC 肿瘤细胞PR 阳性表达,2 例ER、PR 均阴性;Her-2 均为阴性;66.7%Ki-67 低表达。IPC组和IDC组患者luminal 型、三阴型、Her-2 过表达型分别为86.7%、13.3%、0.0%和57.8%、24.4%、17.8%。
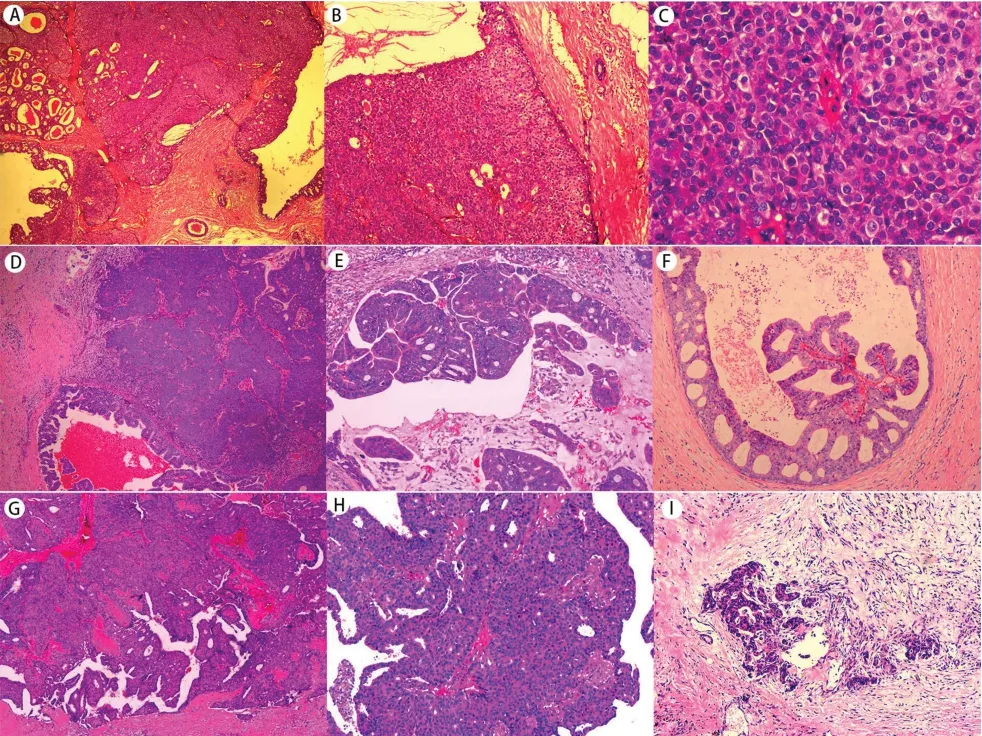
图4 A~C.单纯IPC,A.HE×4,B.HE×10,C.HE×40;D~F.IPC伴导管内癌,D.IPC成分,HE×4,E.IPC成分,HE×10,F.导管内癌成分;HE×10;G-I.IPC伴浸润性癌,G.IPC成分,HE×4,H.IPC成分,HE×10,I.浸润性癌成分,HE×10
2.6 治疗 15 例IPC 患者均先行肿块切除活检,术中冷冻切片病理提示:6 例为乳头状癌,9 例为导管内乳头状肿瘤或乳头状肿瘤。IPC组和IDC组患者行乳房切除和保乳手术比例分别为80%、20%和91.1%、8.9%;IPC组13 例雌激素受体阳性患者,除1 例男性患者因高龄未行内分泌治疗,其余12 例均术后他莫昔芬或芳香化酶抑制剂内分泌治疗5 年;所有IPC组患者未行化疗。
2.7 随访 所有患者均有完整随访结果,随访时间20~96 个月,中位随访63 个月,IPC组患者无复发生存率93.3%,IDC组无复发生存率82.2%,两组比较差异无统计学意义(P>0.05)(见图5)。
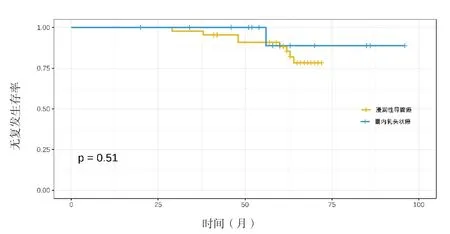
图5 囊内乳头状癌和浸润性导管癌患者的无复发生存曲线
3 讨论
乳腺IPC 发病占乳腺癌的1%~2%[1],好发于绝经后女性,GRABOWSKI 等[1]报道917 例IPC,女性占96.5%,平均发病年龄69.5 岁。IPC 临床多可触及逐渐增大的肿块,且肿块多位于乳头后方或乳晕旁,伴或不伴乳头溢液。本组IPC 患者平均发病年龄为64.5 岁,男性患者比女性患者发病年龄约大15 岁。本组IPC 发病占同期新发乳腺癌的1.2%,11 例为女性,占同期女性乳腺癌0.8%,4 例男性占同期男性乳腺癌的30.7%,男性占所有IPC 患者的26.7%,高于国外文献报道的3%~25%[1]。本组中,13 例临床可触及边界清楚肿块,12 例病灶位于乳晕后方或距离乳头<2 cm。
IPC 钼靶表现无特异性,常表现为边界清晰的类圆形或分叶状高密度影[5]。超声表现多为边界较清楚的囊实混合或低回声病灶,伴或不伴钙化,典型超声表现为囊壁上伴乳头状附壁突起结节的囊实混合回声,伴后方回声增强[6]。本组6 例为囊实混合性病变,其余9 例为低回声结节,边界清楚,本组86.7%的患者 US-BIRADS 分类为3 类或4A 类,提示此类疾病影像学检查易误诊为乳腺纤维腺瘤或导管内乳头状瘤等良性病变。以上临床特征提示对位于乳晕周围的可触及边界清楚肿块的老年患者,结合囊实混合或低回声超声表现,需考虑囊内乳头状癌可能。
乳腺癌主要超声造影增强特征表现为快进、高增强为主、增强后肿块边界不清、范围扩大及内部充盈缺损等特征[7-8]。国内外文献无IPC 超声造影的病例报道,作者曾首次报道1 例男性IPC 超声造影表现[9],表现为快进、慢出、弥漫性、不均匀性高增强,增强范围与二维灰阶面积相仿,形态规则,边缘尚光整,周围可见滋养血流。因此作者认为不均匀性快进高增强、增强后病灶边界清晰、增强范围不扩大及肿块周围粗大滋养血管可作为IPC 特征性的超声造影特征与浸润性导管癌鉴别,从而可提高术前诊断准确率。
IPC 磁共振典型表现为T1WI 呈等信号,T2WI 呈高信号,增强后呈环边强化且囊内可见分隔及乳头状强化结节影[10]。祁永红等[11]报道9 例乳腺IPC 中,8 例为囊实性肿块,DWI 实性部分均呈明显高信号,囊壁均环状强化。本组3 例行乳腺磁共振检查,1 例表现为T1WI 等低信号,T2WI 高信号;另外2 例均表现为T1WI高信号,T2WI 高信号;3 例增强后病灶均明显强化,时间强度曲线呈流出型或平台型改变。
IPC 大体表现为病灶边界清楚,切面多呈囊实性,质地脆,囊腔内有时可见较多血性液体。镜下特点是中央的纤维血管核心被覆肿瘤细胞上皮,病灶中乳头状结构的周围缺乏肌上皮细胞,周围包绕形成厚的纤维囊腔[12]。根据镜下细胞特征,IPC 分为实性型、筛状或腺管样型、乳头型3 种类型[13]。根据有无合并其他类型乳腺癌分为:单纯型IPC、IPC 合并导管内癌、IPC 合并浸润性癌3 种类型[14]。GRABOWSKI 等[1]对917 例IPC 回顾性分析,约53%的IPC 伴浸润性癌。IPC组织学分级通常为中低级别,合并浸润性癌者常为高级别核分级[12];>90%的IPC 阳性表达ER[15-16]。细针穿刺细胞学检查多为阴性结果,超声引导空芯针穿刺活检囊内实性病灶准确率优于细针穿刺,但由于浸润灶常位于病灶周边,无法鉴别是否合并浸润癌。最终需行切除活检才能确诊[17]。本组病例全部行切除活检,术中均行冰冻切片检查,但仅有6 例能诊断为乳头状癌,最终确诊依赖石蜡病理和免疫组化检查。
IPC 主要治疗方法是手术切除,是否需要行前哨淋巴结活检或腋窝淋巴结清扫存在争议。GRABOWSKI等[1]报道53%的IPC 合并浸润性癌,腋窝淋巴结转移比例为4.2%,0.4%的患者有远处转移;SEER 数据库2649例IPC,其中2629 评估腋窝淋巴结,5.5%的病例有腋窝淋巴结转移,1%的患者有远处转移[2]。GRABOWSKI等建议对IPC 行前哨淋巴结活检以评估腋窝淋巴结状态。由于IPC 激素受体阳性高表达,以他莫昔芬为代表的内分泌治疗是其最主要的全身治疗手段[18]。IPC预后好,GRABOWSKI 等报道5 年和10 年生存率分别为82%和61.2%[1]。MOGAL 等[2]报道SEER 数据库2649 例IPC,平均随访4.8 年,4 年和8 年生存率分别为89%和76.3%。
综上所述,IPC 发病少见,多发生于老年女性,也可发生于老年男性。临床表现常表现为乳晕区可触及肿块;超声常表现为边界清楚的囊实混合或低回声病灶,易误诊为乳腺导管内乳头状瘤及纤维腺瘤等良性病变,超声造影特征性表现对诊断IPC 有一定帮助;术中冰冻往往难以确诊,确诊常依赖于切除活检行石蜡病理检查;免疫组化以激素受体高表达、缺乏肌上皮标志物为特征。因近50%的IPC 伴有浸润性癌,推荐行前哨淋巴结活检评估腋窝淋巴结状态;IPC 具有惰性生物学行为,预后好。
