亚硝酸异丁酯遗传毒性效应的研究*
2021-11-04赵少浩章跃龙蒋清清刘燕妮陈雪君
赵少浩 章跃龙 蒋清清 谭 曜 刘燕妮 陈雪君
(宁波海关技术中心,宁波 315800)
亚硝酸异丁酯属于亚硝酸类化合物,亚硝酸酯类化合物的主要作用是使血管扩张,引起血压下降及心动加速,而亚硝酸异丁酯作为有机原料,常被用作溶剂广泛应用于有机合成工业。在化妆品的生产制作过程中,由于原料问题极可能将亚硝酸异丁酯和亚硝酸戊酯带入化妆品,接触后其可对眼睛、皮肤等有刺激性,可发展为皮肤过敏并有致癌的危险。我国《化妆品卫生规范》中规定,亚硝酸异丁酯和亚硝酸戊酯为化妆品中的禁用组分[1]。当前对于亚硝酸异丁酯的毒理学研究罕见报道。近年来,因遗传修饰动物技术快速发展,人类的疾病基因研究正从遗传病基因识别向多基因遗传易感性疾病发展,但是对于多基因疾病的研究却存在困难。由于一部分多基因疾病为遗传易感性疾病,是否存在主效基因及多效基因未知,遗传易感性研究通常关注的是与人类疾病相关的基因组变异[2]。正因为某些疾病是由于长期基因变异的累积导致的,变异原因可能是环境因素、自发突变、双亲遗传等,所以了解掌握致突变物质的信息至关重要。基于数据库及文献报道,亚硝酸异丁酯的毒理学数据仅有大鼠经口LD50:410 mg /kg,小鼠经口LD50:205 mg/kg[3],未能检索到其含有导致细菌回复突变的毒性数据。针对亚硝酸异丁酯的遗传毒性,本研究应用经典的鼠伤寒沙门氏杆菌回复突变实验(Ames实验)和小鼠骨髓嗜多染红细胞微核实验,针对碱基突变及亚硝酸异丁酯的遗传毒性进行风险评估,以期对亚硝酸异丁酯的遗传毒性评价提供参考。
1 材料和方法
1.1 实验动物和菌株
ICR小鼠由浙江省医学院提供,实验动物生产许可证号:SCXK(浙)2019-0002,实验动物使用许可证号:SYXK(浙)2018-0003,体质量25~30 g,共50只,雌雄各半。本实验已通过福利伦理审查,审查编号:2019002。Ames标准实验菌株(TA97a、TA98、TA100和TA102)由MOLTOX引进,产品质量保证证书批号分别为5454D、5444D、5439D、5457D及5437D,经过菌株鉴定及阳性对照物测定,菌株情况良好。
1.2 受试物和主要试剂
2-氨基芴,批号:G1429031、环磷酰胺(CP),批号:K1701078和亚硝酸异丁酯,批号:C1911179,购自阿拉丁试剂(上海)有限公司提供;磷酸盐缓冲溶液(pH6.8)、吉姆萨染液和敌克松,购自Dr. Enrenstorfer GmBH;1,8-二羟基蒽醌,购自上海麦克林生化科技有限公司,批号:C10429233;叠氮钠,购自上海埃彼化学试剂有限公司,批号:20120615;大鼠肝S9,购自CHI Scientific. Inc,批号20FS070C。
1.3 致突变实验方法[4]
1.3.1鼠伤寒沙门氏菌营养缺陷型回复突变实验(Ames实验),根据预实验及受试物的毒性和溶解度的最高剂量设计原则,预实验表明是否加入S9,受试物最低抑菌浓度均为3.0 mg/皿。故首次实验根据化学品标准中剂量设置原则将亚硝酸异丁酯设为3.0、1.5、0.75、0.38和0.19 mg/皿5个剂量组。另设自发回变对照组、阴性对照组(DMSO)、阴性对照组(玉米油)和阳性对照组。验证实验将亚硝酸异丁酯设为3.0、0.95、0.30、0.09和0.03 mg/皿5个剂量组,同时另设自发回变对照组、阴性对照组和阳性对照组,剂量均与首次实验相同。用Ames实验标准菌株TA97a、TA98、TA100和TA102在是否加入S9混合液的条件下,分别对受试物做平板掺入法实验,37 ℃培养48 h观察结果。阳性对照组、阴性对照组和自发回变对照组也依此方法操作。各菌株每剂量做三个平行皿,每皿加入菌和受试物各0.1 mL,代谢活化组加S9 0.5 mL,记录各皿回变菌落数。如果受试物的回变菌落数是自发回变菌落数的两倍以上,并且有剂量—反应关系则定为阳性。
1.3.2小鼠嗜多染红细胞(PCE)微核实验,健康、体质量为20~30 g之间的ICR小鼠,50只,编号及称体质量,随机分为5组:阴性对照组(玉米油)、低剂量组(11 mg/kg)、中剂量组(41 mg/kg)、高剂量组(103 mg/kg),阳性对照组(环磷酰胺,CP 60 mg/kg),每组10只。阴性对照组和染毒组(低、中及高剂量组),剂量为0.1 mL/g经口灌胃给药,连续4 d,第5天颈椎脱位法处死动物。按常规方法解剖小鼠,每只动物涂两张骨髓涂片,采用双盲法阅片,每只小鼠观察2 000个PCE,记录含有微核的PCE数,规定PCE中出现多个微核的按一个计算,计算微核率(‰)。
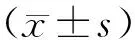
2 结果
2.1 Ames实验
亚硝酸异丁酯的各剂量组各菌株回变菌落数均未超过自然回变菌落数的两倍,而阳性对照组超过自然回变菌落数的两倍以上,并且无剂量—效应关系,见表1和表2所示。

表1 Ames实验结果(n=3)(首次实验)Table 1 Results of Ames experiment (n=3)(The first test)

表2 Ames实验结果(n=3)(验证实验)Table 2 Results of Ames experiment (n=3)(Validation test)
2.2 小鼠骨髓细胞PCE微核实验
各剂量染毒组与阴性对照组相比。其中,高剂量组小鼠骨髓细胞微核率差异显著(P<0.05),而阳性对照组微核发生率与阴性对照组比较差异显著(P<0.01)。实验结果表明,在本实验条件下,亚硝酸异丁酯在实验剂量范围内,随着浓度增加小鼠骨髓细胞的为微核率依次增加,见表3所列。

表3 小鼠骨髓细胞微核实验结果Table 3 Results of mouse bone marrow micronucleus test
3 讨论
微核(micronucleus,MN)的形成主要有两种机制,一种是染色体的断裂,另外一种是有丝分裂过程的紊乱。当正常的个体暴露于污染的环境,放射或服用致畸药物、有毒化学物等条件下,均可促进MN的形成。在细胞之中,胞质中核小体的出现并不一定是微核细胞,它应该与凋亡细胞和坏死细胞的细胞核溶解造成的MN相区别。微核细胞的特征包括:核小体的位置靠近主核,一般为细胞膜和细胞核中间的细胞质内。大小约为主核的1/16~1/3;染色与主核相一致或比主核染色更深;形态为圆形或椭圆形;MN的数量一般少于3个。另外,MN细胞的细胞膜完整,主核清晰。凋亡细胞的细胞膜完整,无明显的主核,核小体数量3个以上[6]。在本实验中,由于亚硝酸异丁酯微溶于水,所以选用玉米油当做溶剂。本品常用于有机合成且有一定的毒性,所以在微核实验中根据LD50计算剂量。本微核实验中,小鼠PCE数量充足,微核易看清,阴性对照组微核自发率低,实验结果显示在剂量组范围内,随着浓度的增加,微核形成率逐渐升高,且小鼠并未出现死亡,与阴性对照组比较差异显著(P<0.05),表明在所选剂量下,亚硝酸异丁酯对小鼠有致突变作用,其具体机制还有待进一步研究。
鼠伤寒沙门氏菌(Salmonellatyphimurium)的组氨酸营养缺陷型(his-)菌株,在含微量组氨酸的培养基中,除极少数自发回复突变的细胞外,一般只分裂几次,形成在显微镜下才能见到的微菌落。受诱变剂作用后,大量细胞发生回复突变,自行合成组氨酸,发育成肉眼可见的菌落。根据杨桂榕等[7]报道,某些化学物质需经代谢活化才有致变作用,因此,在测试系统中加入哺乳动物微粒体酶,以弥补体外实验缺乏代谢活化系统。Verschaeve[8]报道,Ames实验是体外致突变实验,鉴于化学物质的致突变与基因组突变之间密切相关,所以Ames是检测基因突变的首选方法。需要注意的是由于该受试物微溶于水,且有挥发性,所以在Ames实验中选用二甲基亚砜(DMSO)当做溶剂。另外,本品常用于有机合成,且有一定的毒性,根据以上选择剂量的原则,受试物用溶剂稀释后在Ames实验中最高剂量定为3 mg/皿,下设剂量为1.5 mg/皿、0.95 mg/皿、0.75 mg/皿、0.38 mg/皿、0.30 mg/皿、0.19 mg/皿、0.09 mg/皿和0.03 mg/皿,另设自发回变对照组、阴性对照组(DMSO)和阴性对照组(玉米油),剂量为0.1 mL/皿。Ames实验所反映的遗传学终点是DNA碱基序列的改变。本次亚硝酸异丁酯细菌回复突变实验,在活化与非活化条件下各菌株对应各剂量组细菌回复突变数均小于阴性对照组细菌回复突变数的两倍,而阳性对照组引起测试菌株的回复突变菌落数成倍增长,实验表明在所选择的剂量水平下,亚硝酸异丁酯不会引起DNA碱基序列的改变,在致突变性方面未见显著毒性。
