基于微透析与微流控的新型肝素实时监测方法
2021-11-04周星贝丁涛王树水
周星贝,丁涛,王树水
1.华南理工大学医学院,广东广州510006;2.广东省人民医院(广东省医学科学院)广东省心血管病研究所心儿科,广东广州510080
前言
肝素是使用最广泛的临床抗凝药物之一,肝素的治疗窗较窄,对不同人群的抗凝效果存在3~6倍的差异,半衰期存在4 倍差异[1],因此在使用过程中需要格外关注药物浓度变化。在需要拮抗肝素时,如心脏外科手术术后,常应用鱼精蛋白对肝素进行中和[2]。鱼精蛋白可与肝素形成稳定的复合物,从而拮抗肝素的抗凝效果。但过量的鱼精蛋白同样会造成抗凝,因此鱼精蛋白的精准用药也需要关注[3]。抗Xa 因子是肝素测量的金标准,直接测量血液中的肝素,结果不受采血量与采血管中抗凝药物的比例、患者自身凝血因子水平等因素的影响[4]。由于血液中的红细胞、血小板等成分会影响测量结果[5],大部分实验室常用的处理方法是在获取血液后,对血样进行抗凝、离心,分离出血液中的固体成分,只保留血浆,再对血浆进行抗Xa 因子检验[6-7]。分离血浆这一步骤耗时耗力,加上全血样品运输至实验室的时间,通常在采血后需要经过数小时的时间才能获得结果。而很多临床场景下,要求临床医生实时关注患者的凝血状态。因此,缩短血样的处理时间是保证肝素监测结果时效性的关键[8]。
微透析是一种新型的动态采样技术,它利用高分子膜的半透性,可以将肝素等小分子物质从血液中分离,而将血细胞、血小板等大分子物质留在血管内,以此避免对血液进行离心操作,节省检测时间[9-10]。微流控是一种仅需要微量体积的样品就可以完成对多种生化组分进行准确、快速和大信息量检测的新型分析手段,通过连续注射样品及试剂,可实现实时、快速的生化分析[11-13]。微流控芯片通常长宽仅数厘米,芯片的设计可以根据实际需求任意改变[14]。试剂可在芯片流道中完成样品预处理、试剂反应和结果检测等步骤,大大缩短了检测过程中的时间,节省了人力。微透析探针的采样速率通常为1~100 μL/min;微流控芯片可对微升级的样品进行实时测量,正好与微透析取样的速率配合[15]。因此,本研究将这两项技术结合应用,用于实时监测肝素的浓度变化及鱼精蛋白中和肝素的效果。
1 材料与方法
1.1 试剂与仪器
所有化学品的纯度规格均为分析纯级。肝素钠注射液(常州千红)、凝血因子Xa(法国, Hyphen Biomed),使用超纯水配置浓度为15 μg/mL 的溶液,Xa 因子特异性荧光底物(瑞士,Pentapharm),使用超纯水稀释至0.5 mmol/L,冻干人血浆(法国, Hyphen BioMed),每次使用前依说明书向每分装瓶中加入3 mL超纯水,振荡溶解,静置30 min 后使用。上述所有溶液均贮存在4 ℃冰箱。PBS 缓冲液(10×)(美国,Sigma-Aldrich),用超纯水按水:储存液体积比=9:1的比例稀释成浓度为1×的PBS 溶液、超纯水(18.2 mΩ∙cm)由Direct-Q系统(法国,Millipore)净化并使用0.22 μm过滤器过滤(法国,Millipore)后得到。
3000kDa 微透析探针(瑞典,Microbiotech)、微量注射泵(Pump 11 Elite, 美国, Harvard Apparatus)、蠕动泵(美国, Instech)、酶标仪(Cytation 5, 美国,Biotek)、荧光显微镜(Image.M2,德国,Zeiss)、荧光图像处理软件Zen(德国,Zeiss)。
1.2 实验方法
1.2.1 微透析探针的回收率测量在烧杯中注入浓度为1 IU/mL 的肝素溶液,底部垫加热板,使用磁珠搅拌,使肝素溶液始终保持在37 ℃。烧杯开口用封口膜覆盖避免水分蒸发影响肝素在溶液中的浓度。将微透析探针的半透膜完全浸没于肝素溶液中。探针进液口接注射泵,持续输入透析液(即1×PBS),流速分别为0.5、1.0、2.0、4.0、8.0 μL/min。探针出液口接蠕动泵,持续向外抽吸透析样品,抽吸速度与透析液注入流速一致。每次开始收集样品前,微透析系统先平衡30 min,每次采样持续1 h。分别采集微透析探针在不同透析液流速下得到的透析样品。用传统的抗Xa因子法,即使用酶标仪,定量分析透析样品中的肝素浓度,计算微透析探针在不同透析液流速条件下对肝素的回收率。实验分别使用相同规格的3组探针进行重复实验。
1.2.2 微流控芯片的校准本实验使用微流控芯片对血浆肝素浓度的标准溶液(浓度分别为0、1.0、2.0、3.0、4.0、5.0 IU/mL)进行测量。微流控芯片的示意图见图1。芯片左侧有3个流道入口,入口1:肝素标准液;入口2:Xa因子溶液;入口3:荧光底物。以1.0 μL/min的流速向芯片中注入肝素标准溶液,以0.5 μL/min 的流速向芯片中注入Xa因子溶液与荧光底物。使用荧光检测仪对观测点位置进行测量,激发光波长350 nm、发射光波长450 nm。每隔30 s 读数一次,单次检测持续5 min。检测完成后,所有液体从芯片右侧的出口排出。记录荧光强度值-肝素浓度的曲线,并计算拟合直线方程,作为后续实验依据荧光强度值计算肝素浓度的标准曲线。重复实验3次,同时记录从更换不同浓度肝素的血浆到观测发现荧光强度值改变所消耗的时间,即系统的反应时间。

图1 微流控芯片示意图Fig.1 Schematic diagram of microfluidics chip
1.2.3 微透析-微流控系统的性能评价实验装置如图2所示。本实验将微透析探针浸没于5 mL 人血浆中,启动注射泵,以1.0 μL/min 的流速向探针注入透析液。同时启动蠕动泵以相同的速率在探针出口端抽吸样品。微透析探针的出口直接与微流控芯片的进样品口连接。以0.5 μL/min 的流速向芯片中注入Xa 因子溶液与荧光底物。启动荧光检测仪,对芯片观测点位置的荧光进行观测,每30 s 读数一次,并记录测量到的荧光强度值,按回收率及标准曲线换算出对应的肝素浓度。稳定运转系统30 min 后,在10 min 内缓慢添加肝素,直至被测血浆中的浓度升高至4 IU/min。5 min 后,向血浆中每隔5 min 注入一次0.05 mg 鱼精蛋白,中和肝素直至血浆中的肝素浓度降低为0 IU/mL。在应用微透析-微流控系统进行监测的同时,每隔5 min 从血浆中取样,使用传统的酶标仪法对肝素浓度进行测量。

图2 微透析-微流控装置示意图Fig.2 Schematic diagram of microdialysis-microfluidics system
1.3 统计学方法
多组重复实验后计算各结果的算术平均数及标准误。在计算荧光强度-肝素浓度的标准曲线时,首先使用皮尔逊相关系数判断二者是否线性相关。若两者线性相关性显著,则使用SPSS 软件进行线性回归,得到拟合直线方程即标准直线方程;若线性相关不显著,则根据具体的曲线关系,建立对应的非线性回归方程。在分析微透析-微流控系统与传统的酶标仪结果的一致性时,使用SPSS 计算两组结果的组内相关系数。如果组内相关系数值<0.4,认为两种方法获得的结果一致性较差;如果组内相关系数值>0.75,认为两种方法获得的结果一致性高。
2 结果
2.1 微透析探针回收率测量
不同透析液流速下的微透析探针回收率见图3。结果显示,探针在透析液流速分别为0.5、1.0、2.0、4.0、8.0 μL/min 时,平均回收率分别为47.0%、38.9%、26.8%、13.2%、4.8%,透析液流速越慢,探针的回收率也越高。但随着流速的降低,样品流过探针管道的时间增加,系统的延迟时间也随之增加,使得透析的延迟时间变长,时效性降低。为了在保证微透析时效性的基础上最大限度地获得更高的回收率,后续实验选用1.0 μL/min 作为透析液的流速进行微透析。此时微透析探针的回收率为(38.9±2.8)%。
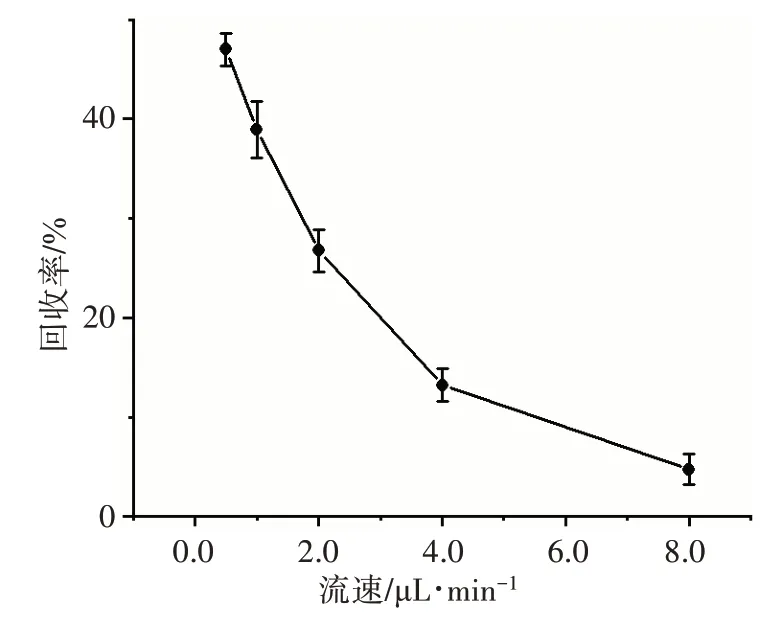
图3 不同透析液流速下的微透析探针回收率Fig.3 Rate of recovery of microdialysis probe at different dialysate flow rates
2.2 微流控芯片的校准
使用微流控芯片对肝素标准溶液进行测量的结果见图4。随着肝素浓度的升高,芯片观测点位置的荧光强度值逐渐降低。当肝素浓度分别为0、1.0、2.0、3.0、4.0、5.0 IU/mL时,荧光强度均值分别为15 111.3、13 338.3、11 635.2、10 090.5、8 296.0、6 550.3。计算荧光强度均值与肝素浓度的皮尔逊相关系数为-0.999 8(P<0.05),表明两者线性相关性显著。使用SPSS软件进行线性回归,得到拟合直线方程为:y=-1 699.3x+15 085R²=0.999 6。本实验还记录了从更换被测溶液到系统监测到荧光强度变化所用的时长为16 min,即系统的响应时间为16 min。

图4 使用微流控芯片测量肝素标准溶液获得的肝素-荧光标准曲线Fig.4 Heparin-fluorescence standard curves generated by measuring heparin standard solution using microfluidics chip
2.3 微透析-微流控系统的性能评价
使用微透析-微流控系统及酶标仪对5 mL 人血浆中的肝素浓度进行实时监测,结果见图5。在注入肝素后,通过微透析-微流控系统可以观察到肝素的浓度逐渐上升,在第13分钟时达到最高值,即4.0 IU/mL。首次加入0.05 mg 鱼精蛋白后,肝素浓度降低至2.9 IU/mL。补加鱼精蛋白后,肝素浓度降低至1.9 IU/mL。第4 次加入鱼精蛋白后,肝素被完全中和,浓度降低至0 IU/mL。此时共注射鱼精蛋白0.2 mg,与血浆中肝素含量的比值为1 mg 鱼精蛋白:100 IU 肝素。采用组内相关系数法分析微透析-微流控系统与传统酶标仪法测量结果的一致性,得到组内相关系数为0.995(P<0.05),可认为两种测量方法得到的结果一致性高。
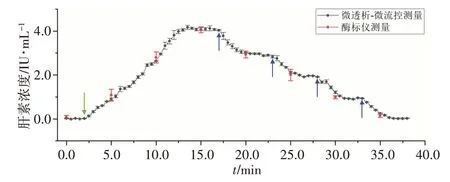
图5 使用微透析-微流控系统对人血浆中的肝素浓度进行实时监测Fig.5 Real-time monitoring of heparin concentration in human plasma using microdialysis-microfluidics system
3 讨论
为了实现肝素的实时监测,本研究研制了基于微透析和微流控的实时检验装置。微透析半透膜的孔径大小通常由分子横截量来描述,半透膜横截量越大,对物质的回收率越高[16]。但微孔的尺寸大,可能导致透析液外漏,获得的样品体积减少。有研究采用增加透析液胶体渗透压的方法,一定程度上减少了透析液损失,使采样量达到透析液注入量的76%[17]。针对这一问题,本研究在探针的出口端外接了一个蠕动泵,使用与透析液注射速率相同的速度对探针内的液体进行抽吸,平衡因注入透析液造成的半透膜内外压差,避免透析液外渗[17],采样量可达透析液注入量的100%。
微流控芯片的设计是实现肝素检测功能的重要环节。肝素会抑制Xa因子的活性,进而抑制Xa因子对荧光底物的作用,实现肝素浓度转化光学信号的过程[18]。芯片设计将肝素样品先与Xa 因子混合,然后再向该混合物中引入荧光底物。样品与试剂的混合顺序可直接影响芯片测量的准确性。用于分析其他药物的微流控芯片通常将多种试剂同时与被测样品混合反应[19],但在本实验中,如果将3 种液体同时混合,Xa 因子会同时分别与肝素和荧光底物反应。此时本应该被肝素抑制、但尚未与肝素接触的Xa 因子提前与荧光底物接触,而荧光底物激活的反应过程不可逆。这种情况下,芯片中观测到的荧光会高于实际的强度值,为测量带来误差。因此,本实验选用先将肝素、Xa因子充分反应混合后,再引入荧光试剂的设计,保证肝素测量的准确性。此外,微流道的设计中还加入了S型的流道,保证流道中液体的有效接触、完全反应。
通过向血浆中加入肝素,模拟患者注射肝素后血药浓度上升的过程,再加入鱼精蛋白中和肝素,使用微透析-微流控系统对整个过程进行监测。鱼精蛋白能与肝素结合形成稳定的复合物,阻止肝素与Xa因子反应,从而拮抗肝素的抗凝作用[20]。目前临床常用计算鱼精蛋白用量的方法为鱼精蛋白滴定法,需要将患者的全血样品分别与不同浓度的鱼精蛋白混合。若鱼精蛋白浓度不足,残留的肝素会抑制凝血,而过量的鱼精蛋白同样有抗凝效果[3]。因此可根据最早出现凝血的实验组鱼精蛋白的浓度估算最佳的鱼精蛋白用药量[21]。鱼精蛋白滴定法测量肝素的精度取决于实验组间的鱼精蛋白梯度差。临床通常采用6 个鱼精蛋白浓度,梯度为0.7 IU/mL。测量结果较真实水平有0.1~0.3 IU/mL 的波动,按照体外循环的肝素浓度为3~4 IU/mL 计算,最大可能会有10%的误差,无法保证用药的安全性[3]。
本研究阐述的微透析-微流控系统可对肝素浓度进行实时监测,使用者可直观地观察肝素浓度的变化,及时调整肝素与鱼精蛋白的给药方案,减少临床不良事件的发生。该系统测得的肝素浓度与传统酶标仪方法测得的结果一致性高,组内相关系数为0.995(P<0.05),证明了该系统的准确性。
4 结论
本研究将微透析与微流控技术联合应用,为血液中肝素浓度的在线、实时监测提供可行的方案。实验结果表明,微透析探针可对血浆中的肝素有效采样;微流控芯片配合荧光试剂,能够可持续地精确测量出样品中的肝素变化,并得到清晰的药物浓度曲线。该微透析-微流控系统能显著提高肝素检测的时效性,将以往需要数小时的检测时长缩短至16 min,可精确测量0~4 IU/mL 的肝素浓度。同时,该系统还具有良好的准确性,实现一种新型的肝素快速分析和鱼精蛋白效果评价的方法,为临床用药提供更清晰的视野。