IL-6、TNF-α、GR-α、GR-β mRNA与常见眼眶疾病患者对糖皮质激素敏感性的关系
2021-11-04马建民刘向祎
赵 珂 马建民 肖 飞 刘向祎*
(1. 首都医科大学附属北京同仁医院检验科, 北京 100730; 2. 首都医科大学附属北京同仁医院 北京同仁眼科中心, 北京市眼科学与视觉科学重点实验室, 北京 100730; 3. 卫生部老年医学重点实验室, 北京 100730; 4. 北京医院国家老年医学中心,北京 100730)
眼眶病种类繁多,包括炎症、肿瘤和外伤等。甲状腺相关性眼病(thyroid associated ophthalmopathy,TAO)及特发性眼眶炎性假瘤(idiopathic orbital pseudotumor, IOIP)的发病率分别居于常见眶内病变的第一位和第三位[1]。TAO是一种自身免疫性、器官特异性的慢性炎症,在眶内疾病中发病率约20%[2]。常见的临床体征有眼球突出、眼睑回缩、上睑迟落、复视、眼球活动受限及眼肌受累等。IOIP是一种特发性、良性、发病外观类似肿瘤的非特异性眼眶炎症。其发病率约占眶内疾病的7.1%~12.3%,通常为单眼发病,也有8%~20%的患者双侧同时或者依次发病[1]。疼痛、眼球突出、眼睑肿胀及眼压升高是其主要临床表现。
TAO及IOIP两种疾病的一线用药为糖皮质激素(glucocorticoid,GC)。长期或者大量应用GC会引起众多的不良反应,如高血糖、高血压及骨质疏松等[3]。研究[4]表明,长期使用相当于5 mg/d强的松剂量的不良反应风险较低,但使用剂量>10 mg/d时,风险就会明显增加,这极大影响了患者服药的依从性。同时,糖皮质激素抵抗(glucocorticoid resistance,GCR)的现象也引起了人们更多的关注。GCR多为后天获得,且在不同疾病中发生率和发病机制不同[5]。GCR的产生可能与糖皮质激素受体(glucocorticoid receptor,GR)亲和力降低、数量减少、炎症因子的调控及GC作用通路上其他的转录因子水平和功能变化等有关。目前,这些研究多集中于哮喘、过敏性鼻炎及系统性红斑狼疮等疾病,而关于TAO及IOIP患者对GC敏感性的研究却很少。白细胞介素-6(interleukin-6,IL-6)及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是典型的促炎因子,均具有免疫调节活性[6-7]。研究[8]表明,在活动期TAO患者的眼眶组织中,观测到IL-6及TNF-α的浓度明显升高。但是关于IL-6及TNF-α浓度和患者对GC敏感性是否一致尚未有定论。本研究旨在探讨IL-6、TNF-α、GR-α及GR-β mRNA与常见眼眶疾病如TAO和IOIP患者糖皮质激素敏感性的关系。
1 对象与方法
1.1 研究对象
2019年12月5日至2020年12月22日在首都医科大学附属北京同仁医院眼肿瘤门诊就诊的TAO患者62例(其中对GC敏感组45例,抵抗组17例)和IOIP患者36例(对GC敏感组有25例,抵抗组11例)为研究对象。本研究经首都医科大学附属北京同仁医院伦理委员会审核批准(伦理编号:TRECKY2019-112)。
1.1.1 TAO患者的纳入和分组标准
TAO患者纳入标准参照Bartley的诊断标准[9]。若有眼睑退缩者,只要合并以下体征或检查证据任意其中一项,即可确诊TAO:(1)甲状腺功能亢进;(2)眼球突出或双眼球突度相差大于2 mm;(3)眼外肌受累,眼球活动受限,电子计算机断层扫描(computed tomography,CT)或磁共振(magnetic resonance imaging,MRI)发现眼外肌增大;(4)视神经功能障碍,如视力下降、瞳孔反射、色觉、视野异常,无法用其他病变解释。若无眼睑退缩者,须具备甲状腺功能异常,还应有以下体征之一,如眼球突出、眼外肌受累或视神经功能障碍,并排除引起类似体征的其他眼病;(5)至少口服过两周的GC。
根据研究对象对GC的反应,将其分为敏感组和抵抗组,判定方法如下:(1)效果明显:患者眼部自觉症状完全消失,眼突度回缩>2 mm,临床活动度评分(clinical activity score,CAS)下降>2分;(2)有改善:患者眼部自觉症状显著改善,眼突度回缩1~2 mm,CAS评分下降1~2分;无效:患者眼部自觉症状无明显变化,甚至加重,CAS评分升高。效果明显和有改善判定为对GC敏感,无效判定为对GC抵抗。TAO患者的CAS评分中评估症状包括:(1)自发性球后疼痛;(2)眼球运动时疼痛;(3)眼睑发红、充血;(4)结膜弥漫性充血、发红;(5)眼睑水肿;(6)球结膜水肿;(7)泪阜水肿。出现每项症状便记1分。
1.1.2 IOIP患者的纳入和分组标准
IOIP患者纳入标准为:(基于临床表现、超声、CT/MRI)考虑为眼眶炎性假瘤的患者,已经除外眼眶其他占位性病变,例如眼眶淋巴瘤、良性淋巴上皮病变、眼眶感染性疾病及肉样瘤病等以及全身检查除外其他全身相关性眼病;接受过至少两周口服GC的治疗。
IOIP患者对GC反应性的判定方法如下:(1)效果明显:临床症状及体征消失且影像学检查发现病变明显消散,停药半年没有复发;(2)有改善:临床症状及体征基本消失或者影像学检查发现病变大部分消散;(3)无明显改善:临床症状及体征改善不显著或反复发作且影像学检查病变消散不明显[10]。效果明显和有改善判定为对GC敏感,无效判定为对GC抵抗。
1.2 试剂与仪器
红细胞裂解液(自制)、TRNzol Universal 总 RNA 提取试剂[天根生化科技(北京)有限公司,货号DP424]、反转录试剂盒(M-MLV Reverse Transcriptase,试剂号 28025-013,Invitrogen公司,美国)、 AceQ Universal SYBR qPCR Master Mix试剂盒(诺唯赞科技有限公司,货号Q511-02)、ABI 7500实时荧光定量PCR仪(quantitative real-time PCR, q-PCR)(Thermo Fisher 公司,美国)、台式低温高速离心机(Thermo Scientifific SorvallTMLegendTMMicro 21 微量离心机,美国)。
1.3 实验方法
1)红细胞裂解液配制:称量41.16 g NH4Cl,0.5 g KHCO3, 0.02 g EDTA·2Na,溶于100 mL ddH2O,调pH至7.2,加ddH2O定容至500 mL。4 ℃保存,使用时先恢复至室温。
2)地塞米松体外刺激:收集患者EDTA-K2新鲜外周抗凝血1 mL,分为对照组和处理组各0.5 mL。处理组加入终浓度为100 nmol/L 地塞米松,对照组加入等体积的二甲基亚砜,摇床上充分混匀30 min后,室温静置7 h。
3)外周血白细胞mRNA提取:①裂解红细胞:每支离心管中加入1 mL的红细胞裂解液,用枪吹打混匀,冰上静置10 min,然后300 g,4 ℃,离心5 min,弃上清。重复上述步骤。② 在离心管中加入1 mL TRNzol裂解液,用加样枪反复吹打使细胞充分裂解,冰上孵育5 min。③ 加入0.2 mL氯仿,剧烈震荡,冰上孵育5 min,14 865g,4 ℃离心15 min后,混合物分为3层。④ 将含有RNA的上层清液转移至新的1.5 mL的离心管中,加入等体积的异丙醇,上下颠倒混匀后,冰上孵育20 min 后, 14 865g, 4 ℃离心15 min,弃上清。⑤加入1 mL 75% (体积分数)乙醇(DEPC处理过的离子水配制),将沉淀从管底弹起,洗涤沉淀。5 806 g,4 ℃离心5 min,弃上清。⑥ 待乙醇挥发完,加入13 μL DEPC水溶解RNA,反复吹打混匀。检测RNA溶液的浓度、纯度和RNA的完整性。
4)反转录反应:按照赛默飞世尔科技公司的反转录试剂盒说明书进行操作。
5)实时荧光定量PCR(q-PCR):在美国国家生物技术信息中心(National Colalition Building Institute,NCBI)网站上查找人IL-6、TNF-α、GR-α及β标准序列,设计相关引物(见表1)。其中,甘油醛-3-磷酸脱氢酶基因(GAPDH)为内参基因。

表1 IL-6、TNF-α、GR-α、GR-β及GAPDH引物核酸序列
按照诺唯赞科技有限公司试剂盒说明书配制体系,在ABI 7500实时荧光定量PCR仪上进行扩增检测。预变性条件为95 ℃ 5min;循环反应的条件为95 ℃ 10 s、60 ℃ 34 s,共40个循环反应。熔解曲线采集程序为ABI 7500默认设置。每份样本测试3个PCR复孔。以空白样本作为阴性对照。使用相对表达量方法来统计GR-α、GR-β、IL-6及TNF-α的表达水平,即将GR-α、GR-β、IL-6及TNF-α的表达水平标准化为GAPDH水平,使用如下计算公式得到GR-α、GR-β、IL-6及TNF-α表达的相对定量:
改变的倍数(Fold Change)=2-ΔΔCT
其中ΔΔCT=(CT靶基因-CT内参)处理组-(CT靶基因-CT内参)未处理组
当相对表达量>1,说明该基因的表达呈现上调状态;当相对表达量<1,说明该基因的表达呈现下调状态。
1.4 统计学方法
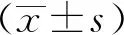
2 结果
2.1 研究对象的基本信息
62例TAO患者中男性27例,平均年龄(51.44±10.46)岁,女性35例,平均年龄(42.43±12.30)岁;36例IOIP患者中男性12例,平均年龄(46.73±12.78)岁,女性24例,平均年龄(46.66±9.45)岁。
2.2 q-PCR结果
扩增曲线为典型的S型曲线,熔解曲线显示每种引物的峰单一且特异,说明本次实验结果准确可信。所有数据均为非正态分布。
TAO敏感组和抵抗组相比,GR-α、GR-β、IL-6和TNF-α浓度差异无统计学意义(P>0.05);敏感组GR-α/β浓度高于抵抗组,差异有统计学意义(P<0.05),详见表2。
IOIP患者敏感组与抵抗组相比,GR-α、IL-6及TNF-α浓度差异无统计学意义(P>0.05);敏感组GR-β浓度低于抵抗组, GR-α/β浓度高于抵抗组,组间差异有统计学意义(P<0.05),详见表3。
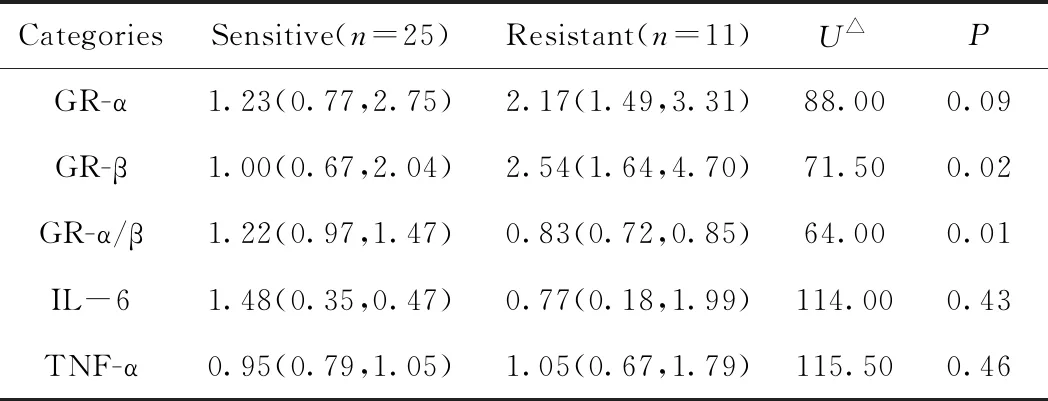
表3 IOIP患者IL-6、TNF-α、GR-α、GR-β检测结果
2.3 GR-α/β与TAO、IOIP患者对GC敏感性的ROC曲线分析
TAO GR-α/β的曲线下面积(area under the ROC curve, AUC)为0.70(95%CI: 0.54~0.87),临界值为1.255,此时灵敏度和特异度分别为85%和53%; IOIP GR-α/β的AUC为0.77(95%CI: 0.58~0.95),临界值为1.005,此时灵敏度和特异度分别为90%和72%(图1)。表明GR-α/β与TAO、IOIP患者对GC的敏感性有区分能力,二者之间存在一定联系。
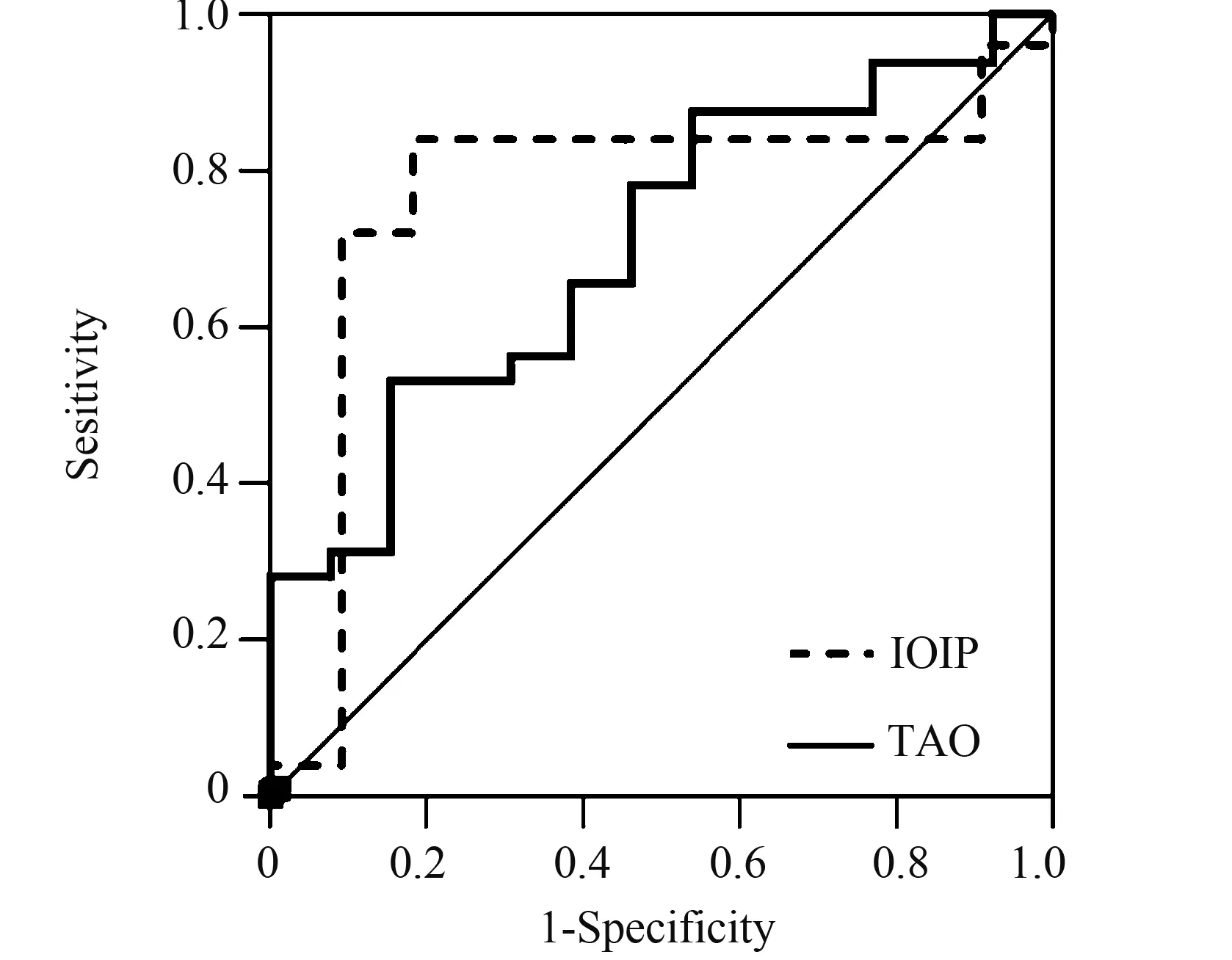
图1 TAO及IOIP患者GR-α/β的ROC曲线Fig.1 The receiver operating characteristic (ROC) curve of GR-α/β in the TAO and IOIP patientsTAO: thyroid-associated ophthalmopathy; IOIP: idiopathic orbital inflammatory pseudotumor; GR: glucocorticoid receptor; ROC: receiver operating characteristic.
3 讨论
TAO和IOIP发病率高,患者常出现眼睑肿胀、眼压高、畏光、视力下降等,严重影响患者生活质量。TAO女性发病率高于男性,目前病因不明,多认为是眼眶成纤维细胞异常增殖和活化,炎性细胞分泌炎性因子增加以及糖胺聚糖在眼外肌的沉积共同导致了眼眶脂肪增生、眼外肌的水肿和纤维化[11]。此外,TAO患者发病的最小年龄为12岁。这提示虽然TAO一般多发于成年人,但是目前发病年龄逐渐年轻化。青少年及女性患者激素变化复杂,所以使用GC时应更加慎重。临床上需要一个简单可靠的指标来预测GC敏感性,为临床下一步决策提供方向和依据。IOIP发病没有性别和种族倾向性,男女患病率基本相等。在任何年龄均可发病,平均发病年龄为40~50岁。这个阶段也是许多自身免疫性疾病的高发期。两组患者对GC敏感和抵抗的比例为2~3∶1,这个数据也与之前的文献[12-13]报道吻合。
GC为亲脂性的甾体类激素,通过被动扩散透过细胞膜,进而与胞质内的GR结合。GR是一种配体依赖性的转录因子。GC与GR结合形成激素-受体复合物发挥作用,调控靶基因的转录。因此,GR与GCR密切相关。GR的亲和力、数量、亚型的种类和比例、基因多态性及基因突变等都会影响患者对GC的反应性。人体内几乎所有细胞均表达GR,因此GR基因相对保守,突变率低。检测GR的数量、种类则是预测患者对GC敏感性的一个方便快捷的方法。GR主要有GR-α、β、γ及P等亚型,人体内含量较多的是GR-α及β亚型,GR-α亚型有配体结合区,能够与GC结合,而GR-β亚型缺乏配体结合区,因此无法与GC结合。许多文献[14-15]显示,GR-β能拮抗GR-α亚型,β亚型有负调节的作用。正常状态下,GR-α与GR-β同时存在,当其比例发生改变时,患者对GC的反应性也会不同[16-17]。据报道[18-20],GR-β浓度的升高与多种炎性疾病包括哮喘、类风湿关节炎和急性淋巴细胞白血病的GCR有关。2010年,Lewis-Tuffin等[21]指出,采用GR-α/β来预测激素的疗效其意义明显优于单独的GR-α或GR-β,有助于全面和准确地评价激素的敏感性。这个指标的研究[22-23]多集中于原发性肾病综合征、突发性耳聋、系统性红斑狼疮等疾病,在TAO患者和IOIP患者中鲜有研究。罗清礼等[24]的研究比较了TAO患者和健康对照组的GR-α/β,但是并未比较TAO患者中对GC敏感和抵抗组GR-α/β的差异。本研究的GCR患者GR-α/β明显降低,且敏感组和抵抗组的差异有统计学意义(P<0.05),说明GR-α/β能很好地反映患者对GC的敏感性。单独的GR-α差异无统计学意义(P>0.05)。GR-α的表达水平及不同患者GR-α的表达差异与病程的长短、炎症的活跃程度等有关。由于外周血取样方便,检测外周血白细胞的GR将是十分便捷、可靠的方法,对临床诊断十分有意义。
人体内众多的炎性细胞因子由于其多效性、协同性及拮抗性等特点,形成一个十分复杂的调节网络,参与人体多种生理功能,在不同疾病的不同时期发挥特殊的作用,也影响着疾病的发展方向[25]。IL-6是一种促炎细胞因子,在免疫应答中起重要作用。IL-6在活动性TAO患者眼眶组织中过表达,可促进B细胞增殖分化并激活Th1细胞,随后释放多种细胞因子,导致眼眶内糖胺聚糖和脂肪的生成增加。TNF-α也与TAO的发病密切相关,其可激活多种炎症细胞,具有调节免疫应答及抗肿瘤作用,是TAO发病的主要前炎性因子。因此检测其眼眶组织或者体液,例如血液、泪液等中TNF-α的浓度对于监测患者疾病的发生发展程度具有十分重要的意义[26]。GC通过抑制促炎因子的合成及促进抗炎因子合成发挥抗炎作用。IL-6及TNF-α是典型的促炎因子,因此GC会抑制IL-6及TNF-α的合成。TAO患者的IL-6及TNF-α虽然在两组之间差异无统计学意义,但是敏感组与抵抗组均显示下调状态,这与GC发挥的功能表现一致。IOIP患者炎性因子均呈上调的状态。这可能与IOIP的病情发展特点有关,该病极容易复发[1],纳入的患者也大多处在疾病活动期,因此炎性因子呈现高表达状态。本研究为横断面研究,留取样本时,部分患者已经处于疾病的静止期,此时的炎症反应已经处于低水平,这也是实验的一个混杂因素。在以后的研究里,可以划定基线,将疾病分期、炎症活跃水平及用药的疗效综合考虑,监测各个时期的炎性因子表达。
TAO患者及IOIP患者GR-α/β的AUC分别为0.70(95%CI: 0.54~0.87)和0.77(95%CI: 0.58~0.95)。两组指标的AUC均在0.6~0.8之间,属于实验准确性较高的指标。在兼顾灵敏度和特异度情况下,TAO患者临界值取1.255,即GR-α/β<1.255时,可认为患者对GC不敏感,此时灵敏度和特异度分别为85%和53%;IOIP患者临界值取1.005即GR-α/β<1.005时,可认为患者对GC不敏感,此时灵敏度和特异度分别为90%和72%。
本研究通过对外周血加药刺激,体外实验模拟患者机体对GC反应情况,检测GR的mRNA,反映机体GR和炎性因子的表达潜力,能从转录水平预测患者对GC的敏感性。后续还可进行GR蛋白水平的验证。研究还需再扩大样本量,统计患者治疗前后指标的差异,尤其是炎性因子,纵向比较,可能才会更好的说明问题。目前,对GC的反应有效性的评价大多仍是基于临床医生的主观判断及患者的主观感受。因此,规范疾病疗效性的评价,完善疾病的诊治方案是更好地应用这些实验室指标的基础和前提。
