血清神经元特异性烯醇化酶与外伤性脑损伤患者及临床特征的关系
2021-11-04张国军
王 莉 张国军
(首都医科大学附属北京天坛医院实验诊断中心, 北京 100070)
在世界范围内,创伤性脑损伤(traumatic brain injuries,TBI)是导致死亡和残疾的重要原因[1],2014年Mondello等[2]报告,仅美国每年有近170万人遭受创伤性脑损伤。目前对于TBI患者的病情判断及预后评估,采用电子计算机断层扫描(computed tomography,CT)、磁共振(magnetic resonance imaging,MRI)等影像学检查[3]及临床相应的评分系统如格拉斯哥昏迷评分(Glasgow Coma Score,GCS)、格拉斯哥预后评分(Glasgow Outcome Score,GOS)等具有重要意义[4],但影像学检查受场地的限制、量表评分系统受医生的主观因素及患者的状态的影响较大,因此对客观的可量化的实验室检查指标的需求在TBI的临床研究中越来越大。
神经元特异性烯醇化酶(neuron-specific enolase,NSE)作为神经元细胞中含量丰富的酶[5],被认为是神经元损伤的敏感标志物。在TBI发生后,神经元细胞受损,NSE大量释放入血,因此血清NSE在临床上用于诊断、评估神经元损伤的严重程度方面具有一定的作用。本研究通过对TBI患者血清NSE浓度的动态监测,探究血清NSE浓度的变化同TBI严重程度的关系及在预后评估中的应用价值,为其在临床推广提供一定的理论依据。
1 对象与方法
1.1 研究对象
本研究选取北京市延庆区医院神经外科和重症监护室(Intensive Care Unit,ICU)在2019年1月至2019年12月间收治的TBI患者106例为病例组,其中男性66例,平均年龄(55.5±1.77)岁,女性40例,平均年龄(52±2.87)岁。患者CT影像学表现:弥漫性轴索损伤12例,脑挫裂伤40例,蛛网膜下腔出血、硬膜下血肿、硬膜外血肿(简称血肿出血组)共43例,未见明显异常的11例。另外选择同时期该院健康体检人员100例作为对照组,其中男性50例,年龄23~65岁,女性50例,年龄25~62岁。对照组的性别及年龄与病例组比较差异均无统计学意义(P>0.05)。
(1)入选条件:所有患者均有明确的损伤原因,于损伤发生后12 h内入院,平均时间为(4.1±0.9) h,入院时均行头颅CT检查证实颅脑外伤,符合创伤性脑损伤的诊断标准[2]。
(2)排除标准:所患疾病可能影响其血清NSE浓度的,如伴有严重心、脑、肾等器官实质性病变或恶性肿瘤病史,或近期伴有肺部感染性疾病的患者;不能采集到完整的研究数据的,如住院治疗天数不足5 d的,或中途转院、自动放弃治疗自行出院的,或后期在做电话回访时临床数据缺失的患者。
1.2 检测方法
1)损伤评级:研究对象均在颅脑损伤后12 h之内就诊,并第一时间进行GCS评分,并依据GCS评分将研究对象分为轻、中、重3组,轻度组(GCS: 13~15分)65例、中度组(GCS: 9~12分)14例、重度组(GCS:8分以下)27例。
2)预后评估:于伤后3个月对研究对象(死亡除外)通过电话进行回访,进行GOS评分再将其分为两组:预后良好组(GOS:4~5分)66例和预后不良组(GOS: 1~3分)40例。
3)血清NSE浓度检测:所有入组患者均采集入院第1、3、5天的静脉血,检测血清NSE浓度,其中第1天的采集时间均在伤后12 h内,第3天和第5天均在当天清晨空腹抽取;对照组于当日清晨空腹抽取静脉血。所有标本在1 600 g离心力下离心10 min,分离血清,去除溶血、脂血等不合格标本,将血清置于-80 ℃ 冰箱冰冻保存直至分析。
1.3 仪器和试剂
血清NSE浓度检测采用瑞士罗氏公司的Cobase601全自动电化学发光分析仪及其配套检测试剂,检测时采用同一批号试剂,试剂盒变异系数为2.4%。
1.4 统计学方法
2 结果
2.1 TBI病例组和健康对照组血清NSE浓度的比较
TBI病例组血清NSE浓度[20.3(13.0,40.1)]ng/mL]显著高于对照组血清NSE浓度[10.3(9.4,11.5)ng/mL],差异有统计学意义(Z=-10.052,P=0.000)。
2.2 病例组不同颅脑损伤程度间血清NSE浓度比较
第1、3、5天轻、中、重各颅脑损伤程度组患者血清NSE浓度比较显示,随颅脑损伤程度加重,患者血清 NSE浓度逐渐升高,组间差异有统计学意义(P<0.05),详见表1。且随时间推移呈下降趋势,但重度组呈现先上升再下降的趋势(图1)。

表1 不同颅脑损伤程度患者血清NSE浓度比较
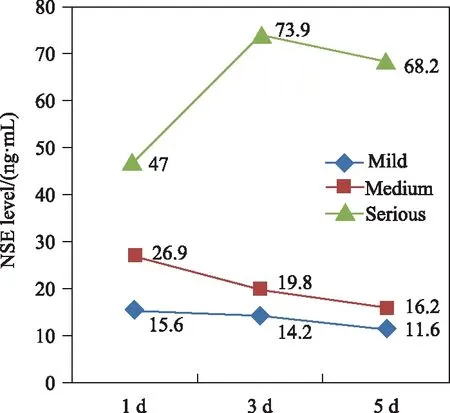
图1 颅脑损伤患者的严重程度与血清NSE浓度的动态变化Fig.1 Dynamic changes of severity and the serum NSE levels in the patients with craniocerebral injuryNSE: neuron-specific enolase.
2.3 病例组不同损伤类型患者血清NSE浓度比较
弥漫性轴索损伤组患者第1、3、5天血清 NSE浓度均明显高于其他类型脑损伤患者,组间差异有统计学意义(P<0.05),详见表2。
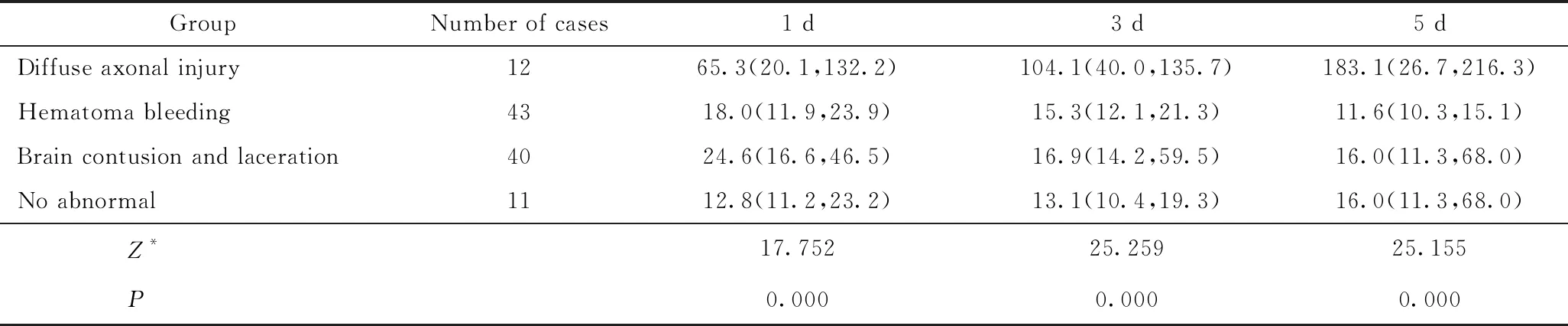
表2 不同颅脑损伤类型分组患者血清NSE浓度比较
2.4 病例组不同预后情况患者血清NSE浓度比较
预后良好组患者第1、3、5天血清NSE浓度显著低于预后不良组患者各时间点的血清NSE浓度,组间差异有统计学意义(P<0.05);同时预后不良组患者血清NSE浓度第1、3、5天呈上升趋势,预后良好组呈下降趋势,详见表3。

表3 不同预后情况组患者血清NSE浓度的比较
2.5 血清NSE浓度与GCS评分、GOS评分相关性分析
通过Spearman秩相关分析发现:入院时血清NSE浓度与TBI患者GCS评分呈负相关(r=-0.696,P=0.000),与伤后3个月时GOS预后评分呈负相关(r=-0.496,P=0.000)。
2.6 通过ROC曲线评价血清NSE浓度对TBI患者预后的预测价值
通过ROC曲线分析,使用约登指数判断不同时间点患者血清NSE浓度对预后判断的临界值:第1天患者血清NSE浓度最佳临界值为30.25 ng/mL,曲线下面积为0.766;第3天患者血清NSE浓度最佳临界值为26.0 ng/mL,曲线下面积为0.842;第5天患者血清NSE浓度的最佳临界值为17.45 ng/mL,曲线下面积为0.839,三者均具有统计学意义,预测效果以第3天最佳(图2)。
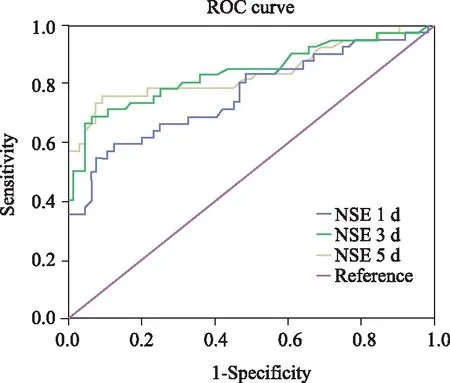
图2 TBI患者在第1、3、5天的血清NSE浓度鉴别预后的ROC曲线Fig.2 ROC curve for differentiating prognosis of the TBI patients at the serum NSE level on day 1, 3, and 5 TBI: traumatic brain injuries; NSE: neuron-specific enolase; ROC: receiver operating characteristic.
选择TBI患者第3天血清NSE浓度26.0 ng/mL为判断患者预后不良的临界值,其预测结果见表4。结果显示,预测的特异度较高,但灵敏度不理想,临床漏诊率较高(30%),预测结果与实际结果具有中高度一致性(Kappa=0.65),表明第3天血清NSE浓度具有一定临床应用价值。
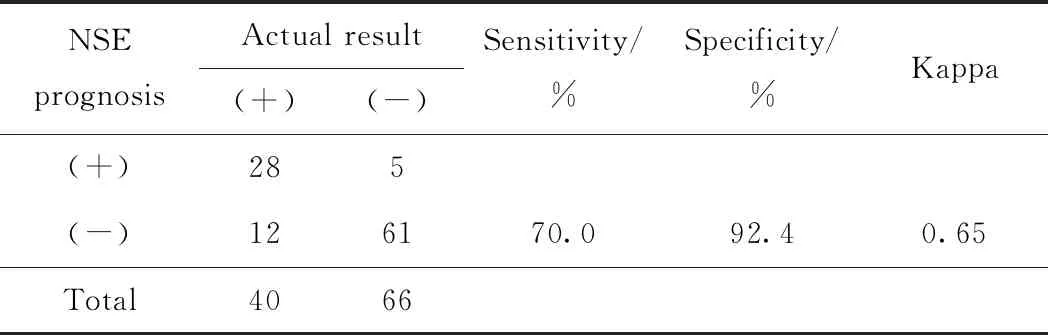
表4 第3天血清NSE浓度对TBI患者预后的预测结果
3 讨论
随着人类社会经济的发展,汽车等高速交通工具的普及造成了各种意外事故的发生率升高;同时暴力伤害和各种自然灾害的不断发生,都导致了TBI的发生率的节节攀升。根据世界卫生组织(World Health Organization,WHO)的预测,TBI将超过许多疾病,成为所有年龄段的重要死亡和致残原因,给全社会带来极大的医疗压力和经济负担,也使创伤性脑损伤成为一个紧迫的公共卫生和医疗问题[2]。以往TBI早期诊断主要以CT等影像学表现为主,某些脑挫裂伤和弥漫性轴索损伤的患者因缺乏特异性的CT 表现往往容易误诊、漏诊,甚至贻误病情,这为临床诊治带来困惑[6]。而对于患者病情严重程度的评估,主要依赖于GCS评分系统,但其主要反映患者昏迷程度,其准确性受到医生主观因素、经验以及患者自身因素的影响[7]。因此选取特异的生物标志物来作为TBI的评价指标,一直受到神经外科医生们的普遍关注。
研究[8]显示,随着神经元、神经胶质细胞的坏死、神经髓鞘的崩解以及血-脑脊液屏障的破坏,许多存在于细胞内的蛋白酶分子释放进入血液和脑脊液中,通过这些蛋白酶分子在血液和脑脊液中含量的变化,了解脑损伤的严重程度和病情发展趋势,为TBI的诊断和预后评估提供了更为客观的方法。NSE大量存在于神经元和神经内分泌细胞中,是神经细胞能量代谢的关键酶,通常被作为神经组织损伤的生化标志物之一[9]。当TBI发生时,NSE从受损的神经元细胞内释放出来,通过受损的血-脑脊液屏障进入外周血中,使得血清NSE浓度升高[10],其血清浓度高低可直接反映脑组织受损程度,可作为中枢神经系统损伤的定量指标[7,11-12]。
本研究显示,TBI各组患者血清NSE浓度在各个时间点均显著高于健康对照组(P<0.01),初步印证了血清NSE可以作为判断颅脑损伤的生物学标志物;TBI患者损伤后12 h内的血清NSE浓度与其GCS评分呈负相关(rs=-0.696,P=0.000);对通过GCS评分分组的患者血清NSE浓度进行动态观测时发现:轻、中度组患者血清NSE平均浓度随着时间的延长逐渐降低,而重度组患者血清NSE平均浓度在损伤后第3天出现波峰,通过与临床专家讨论分析认为,可能是部分患者出现了继发性的脑损伤,由此印证了动态监测TBI患者血清NSE浓度可以从一定程度上了解其病情进展[13]。
比较CT诊断分组的各组TBI患者血清NSE浓度后发现,除未见异常组同血肿出血组比较差异无统计学意义外,其他各组间数据差异均有统计学意义。与影像学专家讨论后分析其原因可能是由于部分TBI患者的轻度损伤出现早期损伤灶显像延时,这提示未来可以在应用血清NSE浓度检测对某些CT阴性的TBI患者进行辅助诊断的作用方面继续进行研究[14],特别是对于某些无法进行影像学检查的特殊患者,血清NSE浓度检测可能会起到重要作用[15]。
通过对TBI患者伤后3个月时的预后情况进行回顾性分析发现,入院时血清NSE浓度与TBI患者伤后3个月时GOS预后评分呈负相关(rs=- 0.496,P=0.000)。预后不良组患者血清NSE浓度在各时间节点均高于预后良好组并逐渐升高,预后良好组患者血清NSE浓度逐渐降低,并接近健康对照组,进一步预示监测TBI患者血清NSE浓度对预后评估有一定帮助。
本研究利用ROC曲线计算得出了判断TBI患者3个月内预后不良的第1、3、5天的血清NSE浓度最佳临界值及曲线下面积、灵敏度和特异度。经过与临床医生的沟通后笔者认为:利用患者第3天血清NSE浓度为26.0 ng/mL为最佳临界值判断预后不良时其特异度、灵敏度明显高于第1天,且与第5天相当;但第5天患者血清NSE临界值为17.45 ng/mL时,与其参考范围上限16.3 ng/mL过于接近;同时,尽早采取积极的干预措施有助于患者未来的康复,因此选择患者第3天血清NSE浓度26.0 ng/mL为判断TBI患者3个月内预后不良的最佳临界值,其Kappa值为0.65,表明利用第3天TBI患者血清NSE浓度作为判断预后的最佳临界值时,计算结果与实际情况具有较高的一致性。
综上所述,笔者认为血清NSE浓度对判断TBI患者颅脑损伤的严重程度、病情的动态变化以及患者的预后恢复情况都有一定的价值。证实了先前学者的观点[16],认为NSE是众多反映神经损伤的生化指标中较为敏感且对颅脑损伤评价有较好临床应用价值。但是本研究也有一定的局限性,一方面是患者纳入数量相对偏少,另一方面是患者颅脑损伤严重程度和CT诊断类型分布不均、样本采集时间不统一,未来有待于均衡上述因素,进行大样本、多中心的研究。
