表油菜素内酯对夏黑葡萄幼苗生长的影响
2021-11-03练华山李欣欣林立金廖明安
练华山,李欣欣,林立金,廖明安
(1.成都农业科技职业学院 农业园艺学院,四川 成都 611130; 2.四川师范大学附属第一实验中学,四川 成都 611130; 3.四川农业大学 果蔬研究所,四川 成都 611130; 4.园艺学院,四川 成都 611130)
1970年,Mitchell等[1]在油菜(BrassicanapusL.)花粉的提取物中发现了一种能促进大豆幼苗生长的物质,被命名为“brassins”。1979年,科学家们从227 kg油菜花粉中分离并提纯了brassins,发现这是一种甾类内酯[2],这类多羟基化且具有相似结构和活性的甾醇类物质都被归为油菜素内酯类似物(brassinosteroids,BRs)[3]。它们在极低浓度下即可调节和改善植物的生长和发育,被认为是继生长素、赤霉素、细胞分裂素、脱落酸、乙烯之后的第六大植物生长调节剂[4]。在作物上应用的BRs,主要有油菜素内酯(BR)、表油菜素内酯(EBR)、高油菜素内酯(HBR)、丙酰芸苔素内酯和14-羟基芸苔素甾醇。其中,EBR是一种人工合成的高活性油菜素内酯类似物,具有促进植物生长发育和提高光合作用的能力[5]。研究表明,外源EBR能够提高植物的生物量[6],并且能够提高植物叶片中的光合色素含量(叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量)和叶片的光化学效率[7]。在植物正常生长发育过程中,植物固有的抗氧化防御系统可以调节和清除少量的活性氧,减少渗透调节物质的产生。近年来,利用外源BRs防御植物的氧化猝灭已引起广泛关注[8-9]。叶面喷施EBR可以提高植物的抗逆性,包括降低电解质渗透率和丙二醛(MDA)含量[10-11],增加叶片的相对含水量和游离脯氨酸(Pro)含量,提高抗氧化酶活性等[12-13]。总体上,外源施用EBR对植株的生长特性具有显著影响。
葡萄(VitisviniferaL.)是世界性果树,我国葡萄栽培面积位居世界第二[14],在我国果树产业中占重要地位。夏黑葡萄是由巨峰×无核白杂交育成的,该品种早熟优质、抗病、丰产、耐贮运性良好[15]。近年来,EBR在提高葡萄产量[16]、促进果实品质形成[17]、缓解非生物胁迫[18]等方面都有较多的研究,但是有关EBR促进葡萄幼苗生长和提高抗氧化系统的研究较少。本研究以夏黑葡萄为材料,研究了叶面喷施不同浓度EBR对葡萄幼苗生长的影响,旨在为提高幼苗抗逆性和培育健壮的夏黑葡萄幼苗提供理论基础。
1 材料与方法
1.1 材料
试验材料为夏黑葡萄一年生扦插苗,来源于四川省崇州市四川农业大学现代农业研发基地夏黑葡萄园。2018年冬季修剪时收集生长健壮且长势一致、无病虫害的一年生葡萄枝条,进行沙藏保存。
供试土壤为潮土,其基本理化性质如下:pH值7.71,有机质15.29 mg·g-1,全氮0.85 mg·g-1,碱解氮87.99 mg·kg-1,全磷11.88 mg·g-1,速效磷55.78 mg·kg-1,速效钾41.96 mg·kg-1,全钾15.38 mg·g-1。
1.2 试验设计
试验于2019年2—8月在四川农业大学成都校区进行。2019年2月上旬将无污染的潮土风干、压碎,过5 mm筛,取3.0 kg装入盆(高15 cm,直径18 cm)中,保持湿润,静置3周备用。
2019年2月中旬,将沙藏保存的夏黑葡萄插条取出,对其进行修剪(带一个健壮的饱满芽,长约7 cm)后扦插于装有珍珠岩的穴盘(50孔)中,育苗所用珍珠岩为含水量为2%~6%的浮石状灰白色珍珠岩,置于昼夜为21~23 ℃的人工气候室中。
2019年3月中旬选取健壮、长势一致的扦插幼苗(株高约15 cm)移栽到装有供试土壤的盆中,置于人工气候室进行培养,白天(24±0.5)℃,夜晚(15±0.5)℃,光周期为12 h/12 h(L/D),光合有效辐射为200 μmol·m-2·s-1。
幼苗移栽15 d后,分别喷施不同浓度(0.5、1.0、1.5、2.0 mg·L-1)的EBR水溶液,对照组喷施等量清水。喷施时间为每天09:00,喷施时以叶面湿润滴液为度。每个处理每次喷施60 mL,单独喷施,避免不同浓度交互影响,每隔7 d喷1次,连续喷施3次。每个处理3盆,每盆3株,重复3次。随机摆放于光照培养室内,盆间距10 cm,每3 d交换位置以减弱边际效应的影响。
1.3 指标测定
最后一次喷施后第8天,采收样品,测定相关指标。
1.3.1 生物量
收获整株夏黑葡萄幼苗,用自来水洗净,再用去离子水冲洗3次,分为根、茎、叶,于110 ℃杀青15 min,75 ℃烘干至质量不变,用电子天平称取各部位生物量,并计算根冠比。
1.3.2 气体交换参数
选取生长点以下第二片完全展开的叶片,用LI-6400便携式光合仪(Li-CorInc.,USA)进行测定。测定叶片的净光合速率(photosynthetic rate,Pn)、气孔导度(conductance stomatal,Gs)、蒸腾速率(transpiration rate,Tr)、胞间CO2浓度(intercellular CO2concentration,Ci)和叶温下蒸气压亏缺值(vapor pressure deficit value at leaf temperature, VpdL)。
1.3.3 光合色素含量
称取0.2 g幼苗叶片,采用浸泡法测定(乙醇∶丙酮体积比1∶1),并分别计算叶绿素a、叶绿素b、类胡萝卜素和总叶绿素的含量(叶绿素a含量+叶绿素b含量)[19]。
1.3.4 抗氧化酶活性
超氧化物歧化酶(superoxide dismutase,SOD)活性用氮蓝四唑(mitrobluetetrazolium,NBT)光化还原法测定;过氧化物酶(peroxidase,POD)活性用愈创木酚法测定,以每min内D470变化0.1为1个酶活性单位(U·g-1·min-1);过氧化氢酶(catalase,CAT)活性用高锰酸钾滴定法测定,以每g鲜重样品1 min内分解H2O2的毫克数表示(mg·g-1·min-1)[19]。
1.3.5 渗透调节物质
可溶性蛋白质含量用考马斯亮蓝-G250比色法测定;丙二醛(malonaldehyde,MDA)含量用硫代巴比妥酸法测定;游离脯氨酸含量(proline,Pro)用酸性茚三酮比色法测定;可溶性糖含量用蒽酮比色法测定[19];相对电导率用电导率仪测定。
1.4 数据处理
用Excel 2010对试验数据进行记录和整理;SPSS 20.0进行方差分析和相关性分析;采用Duncan新复极差法进行多重比较(P<0.05)。
2 结果与分析
2.1 EBR对夏黑葡萄幼苗生物量的影响
由表1可知,喷施EBR后,葡萄幼苗各部分生物量和总生物量均高于对照组。当EBR为1.0 mg·L-1时,幼苗根的生物量达到最高,比对照组高55.68%(P<0.05)。茎、叶、地上部分和整株生物量的变化具有相同的趋势,各处理生物量大小排序为:1.5 mg·L-1EBR>1.0 mg·L-1EBR>2.0 mg·L-1EBR>0.5 mg·L-1EBR>对照组,茎、叶、地上部分和整株生物量均在1.5 mg·L-1EBR处理时达到最高,较对照组分别提高114.39%、29.27%、38.47%和42.49%。幼苗的根冠比在0.5 mg·L-1EBR处理时最大,随后下降,但均高于对照组。综上,叶面喷施EBR能提高幼苗的生物量。

表1 EBR对夏黑葡萄幼苗生物量的影响
2.2 EBR对夏黑葡萄幼苗光合色素含量的影响
由表2可知,喷施EBR提高了葡萄幼苗的光合色素含量。当叶面喷施EBR为1.0 mg·L-1时,葡萄幼苗的叶绿素a和叶绿素b含量达到最高,分别较对照组提高了33.06%和40.68%。类胡萝卜素含量在EBR为1.5 mg·L-1时达到最高,较对照组增加了16.56%。总叶绿素含量在EBR为2.0 mg·L-1时达到最高。叶绿素a/b均表现出低于对照组,并且随EBR浓度的增加呈现下降趋势。叶绿素含量的变化规律和生物量的变化基本一致,推测喷施EBR促进了葡萄幼苗的光合作用,从而增加了葡萄幼苗的生物量。
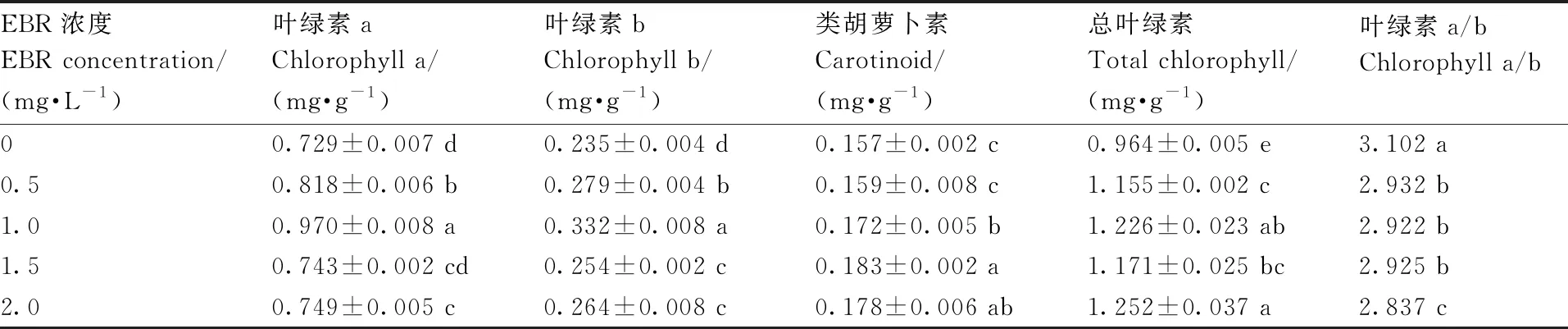
表2 EBR对夏黑葡萄幼苗光合色素含量的影响
2.3 EBR对夏黑葡萄幼苗光合参数的影响
喷施EBR显著提高了葡萄幼苗叶片Tr、Pn、Ci和Gs,而VpdL较对照组显著降低(表3)。当EBR为0.5 mg·L-1时,葡萄幼苗叶片的Tr达到最大,较对照组提高了27.89%(P<0.05);EBR为1.5 mg·L-1时次之,较对照组提高了26.01%(P<0.05)。当EBR为1.5 mg·L-1时,Pn、Ci和Gs的值均达到最大,分别较对照组提高158.05%(P<0.05)、39.77%(P<0.05)和50.00%(P<0.05);EBR为0.5 mg·L-1时次之,且较对照组提高了105.49%(P<0.05)、27.02%(P<0.05)和43.75%(P<0.05)。叶面喷施不同浓度EBR显著降低了葡萄幼苗叶片的VpdL,1.5 mg·L-1EBR处理的VpdL降低幅度最小,较对照组减少了8.61%(P<0.05)。

表3 EBR对夏黑葡萄幼苗光合参数的影响
2.4 EBR对夏黑葡萄幼苗抗氧化酶活性的影响
叶面喷施EBR提高了葡萄幼苗的抗氧化酶(POD、SOD和CAT)活性,且随EBR浓度的升高呈先上升后下降的趋势(表4)。当EBR为1.0 mg·L-1,葡萄幼苗的SOD、POD与CAT的活性达到最高,分别较对照组提高了70.74%(P<0.05)、52.73%(P<0.05)和123.26%(P<0.05),在1.5 mg·L-1EBR处理时次之。
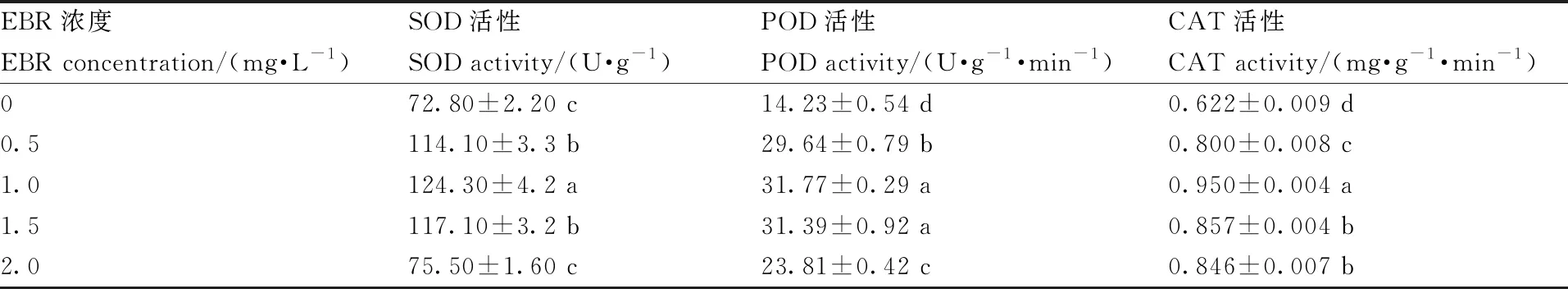
表4 EBR对夏黑葡萄幼苗抗氧化酶活性的影响
2.5 EBR对夏黑葡萄幼苗渗透调节物质含量的影响
由表5可知,叶面喷施不同浓度EBR,葡萄幼苗叶片中MDA含量均低于对照组,且在1.0 mg·L-1EBR处理时达到最低,较对照组降低了43.75%(P<0.05)。叶面喷施EBR后,葡萄幼苗叶片中脯氨酸和可溶性蛋白质含量均高于对照组,EBR浓度为1.0 mg·L-1时达到最高,较对照组分别增加了50.90%(P<0.05)和50.28%(P<0.05)。当EBR浓度为0.5 mg·L-1和2.0 mg·L-1时,叶片中的相对电导率均显著高于对照组,较对照组分别增加了6.25%(P<0.05)和3.22%(P<0.05),其余浓度处理则显著低于对照组。

表5 EBR对夏黑葡萄幼苗渗透调节物质含量的影响
2.6 EBR对夏黑葡萄幼苗可溶性糖含量的影响
由表6可知,叶面喷施EBR后葡萄幼苗叶片各部位的可溶性糖含量变化趋势不同。除了0.5 mg·L-1EBR处理,叶面喷施EBR后葡萄幼苗根的可溶性糖含量均高于对照组,其中,EBR为2.0 mg·L-1时达到最高,较对照组增加了59.57%(P<0.05)。0.5 mg·L-1和1.0 mg·L-1EBR处理的葡萄幼苗茎的可溶性糖含量低于对照组,其余处理均显著高于对照组;EBR为2.0 mg·L-1时达到最高,较对照组增加了14.03%(P<0.05)。1.5 mg·L-1和2.0 mg·L-1EBR处理的葡萄幼苗叶片可溶性糖含量低于对照组,其余处理均显著高于对照组, EBR为1.0 mg·L-1时达到最高,较对照组增加了38.19%(P<0.05)。
3 讨论
BRs能促进植物细胞的伸长和分裂,提高生物量[20]。叶面喷施不同浓度的EBR提高了夏黑葡萄幼苗的生物量和根冠比。适宜浓度EBR促进植物的幼茎伸长、提高幼苗生物量的主要原因如下:一是与植物激素的相互作用,EBR与生长素能够相互作用,加快细胞分裂;二是EBR会刺激质膜上的ATP酶活性,使质膜分泌产生的H+转移到细胞壁,从而使细胞伸长[21],提高植物幼苗的生物量。
叶绿素分子以色素—蛋白质复合物的形式存在于叶绿体中,不仅吸收和传递光能,还可将光能转化为电能,其含量的多少及其组成决定了植物对不同光的吸收和利用率。叶绿素a/b的值反映了类囊体膜的垛叠程度,且成正相关,其数值降低代表膜垛叠减少,导致植物对光量子的有效吸收、传递和利用降低,从而降低光能转化为生物化学能的效率[22]。有关EBR影响光合作用的研究中发现,EBR参与光形态建成和光信号传导[23]。对马铃薯幼苗叶面喷施不同浓度的EBR时,幼苗叶片中的光合色素含量显著下降,但是叶绿素a/b并未出现显著变化[24]。叶面喷施不同浓度EBR提高了葡萄幼苗的光合色素(叶绿素a、叶绿素b、类胡萝卜素)含量,降低了叶绿素a/b的值,其原因可能是幼苗叶面喷施EBR后叶绿素b含量增加,可以增加对光能的捕获,但是幼苗的光合作用能力有限,过多的光能会使活性氧产生,从而增加蛋白质的降解[25],进而影响核心光系统蛋白质含量与光合复合物蛋白质含量的比值,使得叶绿素a/b的值发生变化[23]。随着光合色素含量的增加,气体交换参数也发生了变化:喷施不同浓度EBR的葡萄幼苗叶片气体参数(Tr、Pn、Ci、Gs)都显著增加,VpdL显著降低。VpdL的降低增加了叶片的水分利用效率,能够促进光合作用[26]。研究表明,BRs可提高小麦叶片1, 5-二磷酸核酮糖羧化酶的活性,使叶片吸收CO2的速度加快,提高光合速率[27]。当外源施用有益物质时,可能会提高植物PSⅡ(photosynthetic systemⅡ)的光化学活性,使光合酶如PEP羧化酶、RuBP羧化酶活性上升,增强光合电子向电子受体(QA、QB)与质体醌(PQ)的传递,从而改变光系统的运转效率[28],影响光合参数。
植物在正常生长过程中会产生过量活性氧,但是植物体内的SOD、POD、CAT等抗氧化酶能够及时清除过多的活性氧,从而保护植物免受活性氧的伤害。Tadaiesky等[29]研究发现,外源EBR提高了植物SOD、CAT、POD、APX(ascorbate peroxidase)等抗氧化酶的活性,减轻了氧化损伤。Kohli等[30]的研究也表明,SOD、POD、CAT等抗氧化酶基因表达水平的升高可能是EBR处理后抗氧化防御系统活性增强的原因。叶面喷施EBR提高了夏黑葡萄幼苗叶片抗氧化酶活性。这与Tadaiesky等[29]在水稻上和Kohli等[30]在芥菜上的试验结果相似。推测外源EBR使这些酶活性升高的原因如下:一是EBR可能调节各种抗氧化酶基因的表达,因为这些基因介导酶的活性和从头合成[31];二是BRs能调控细胞内的信号传导,如BR信号激酶1(BSK 1),能够接受不利影响的信号,从而调节植物细胞内源性水杨酸的水平[32],影响抗氧化系统。
植物细胞膜对维持细胞的微环境和正常代谢起着重要的作用。在正常情况下,细胞膜对物质具有选择透性能力;如果细胞膜遭到破坏,膜透性增大,从而使细胞内电解质外渗,以致植物细胞的电导率增大。叶片喷施不同浓度EBR提高了葡萄幼苗叶片的脯氨酸和可溶性蛋白质的含量,降低了MDA含量;不同浓度EBR对葡萄幼苗根、茎和叶中的可溶性糖含量影响不同,0.5 mg·L-1和1.0 mg·L-1EBR处理提高了叶片的可溶性糖含量;当EBR浓度为1.0 mg·L-1和1.5 mg·L-1时,叶片的相对电导率降低。这些结果与Peng等[33]和Zhong等[11]的结果相似,即EBR可以使幼苗通过增加可溶性糖、可溶性蛋白质、脯氨酸等渗透调节物质的含量来提高幼苗的抗性,保护细胞结构和功能,但是不同浓度EBR对植株叶片的渗透调节作用不同。
本研究结果表明,叶面喷施不同浓度EBR促进了夏黑葡萄幼苗叶片的生长,其生物量、光合色素含量、光合参数、抗氧化酶活性、可溶性蛋白质和脯氨酸的含量都有所提高,且EBR浓度为1.0 mg·L-1和1.5 mg·L-1时效果最好;EBR浓度为1.0 mg·L-1时,葡萄幼苗叶片可溶性糖和相对电导率表现较好。综上所述,叶面喷施1.0 mg·L-1EBR最有利于夏黑葡萄幼苗生长。
