外源水杨酸对水稻苗期生长与防卫相关基因表达的影响
2021-11-03戴远兴吕明芳袁正杰严成其张恒木
刘 寒,戴远兴,吕明芳,袁正杰,李 静,严成其,张恒木,*
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004; 2.浙江省农业科学院 病毒学与生物技术研究所,浙江 杭州 310021)
自然界中植物常受到多种病原菌的侵害,在与病原菌的长期斗争过程中,植物进化出了独特的免疫系统。一方面,植物通过模式识别受体(pattern recognition receptors,PRRs)识别病原模式分子(pathogen-or micro-derived molecular patterns,PAMP或MAMP),激发PAMP免疫(PAMP-triggered immunity,PTI)反应,启动抗性相关基因表达,阻止病原菌侵染;另一方面,病原体通过释放效应子(effector)减弱植物PTI反应,植物R蛋白识别效应子,启动免疫反应(effector-triggered immunity,ETI)[1-2],激活防御信号,使信号从病原感染部位传导至未感染部位,产生系统获得性抗性(systemic acquired resistance,SAR)。水杨酸(salicylic acid,SA)是PTI和ETI过程中激活SAR的重要信号分子,大量研究发现,外源SA处理能提高植物抵抗生物和非生物逆境胁迫[3-4]。
植物体内SA存在2种生物合成途径:一是异分支酸(ICS)途径,为拟南芥合成SA的主要途径;二是苯丙氨酸(PAL)途径,为水稻合成SA的主要途径[5-6]。健康拟南芥和本氏烟中SA含量均较低,每g鲜重中通常含0.03~1.00 μg SA[7-13]。拟南芥和本氏烟对外源SA敏感,0.1~1.0 mmol·L-1外源SA即可稳定诱导其防卫基因的表达,增强其对真菌、细菌、病毒等病原菌的抗性[14-17]。单子叶模式植物水稻SA含量较高,每g鲜重通常含SA 8~37 μg[18-19],推测水稻对外源SA的敏感性可能与双子叶植物不同。不同学者曾采用0.01~400 mmol·L-1外源SA处理水稻[20-25],但由于浓度跨度大,测试的基因不一致,难以总结出SA对水稻的生物效应,给SA的生产应用造成困扰。水稻苗期是水稻生长发育过程中对许多病原体和非生物逆境胁迫的敏感期,在此发育阶段诱导抗性对水稻稳产具有重要意义。SA是诱导植物抗性的重要信号分子,然而,其处理水稻苗的最适浓度及其对水稻苗期生长、防卫相关基因表达的影响还不清楚。为了分析外源SA对水稻苗期生长和防卫相关基因表达的影响,本研究通过梯度浓度SA处理苗期水稻,并采用分光光度计、qRT-PCR等方法分析了水稻苗期生长、抗性相关基因表达水平与外源SA浓度的关系,为SA应用和深入研究功能机制奠定基础。
1 材料与方法
1.1 材料与试剂
本研究使用的水稻品种均为日本晴(Nipponbare),由本实验室繁种保存。水杨酸(SA,货号为69-72-7)、丙酮等生化试剂购自生工生物工程(上海)股份有限公司;Trizol购于上海Thermo Fisher Scientific公司;反转录与定量试剂盒购于上海翊圣生物科技有限公司。
1.2 水稻栽培与SA处理
将日本晴水稻种子经75%乙醇和2%次氯酸钠除菌后[26],置于浸润的滤纸上,37 ℃催芽48 h后用水稻全营养培养液[27]培养,于28 ℃、12 h/12 h(L/D)条件下培养;期间每2 d换1次新鲜的水稻营养液,培养2周,达2叶1心或3叶1心期(多种病原敏感期)后,利用带有刻度的喷壶分别加入梯度浓度为0.1、0.5、1.0、2.0、4.0、8.0、16.0 mmol·L-1SA,充分喷施水稻苗期植株(每株2.0 mL),对照为1.6%乙醇。由于SA处理能快速诱导植物防卫反应,因此本研究采集SA处理0、2、4、8、12、24、48 h样品,样品保存于-80 ℃备用。
1.3 总RNA提取和定量分析
采用Trizol试剂,参照项聪英等[28]的方法提取水稻样品总RNA;采用Hifair®Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR(上海翊圣生物科技有限公司)试剂合成cDNA,方法参照试剂盒说明书;采用Hieff®qPCR SYBR Green Master Mix (High Rox Plus)(上海翊圣生物科技有限公司)试剂在荧光定量PCR仪7900HT(Thermo Fisher)上进行定量分析,反应条件设置为95 ℃ 5 min;95 ℃ 15 s,56 ℃ 20 s,72 ℃ 30 s,40个循环。每组实验设置3个生物学重复和3个技术重复,定量基因引物信息见表1。
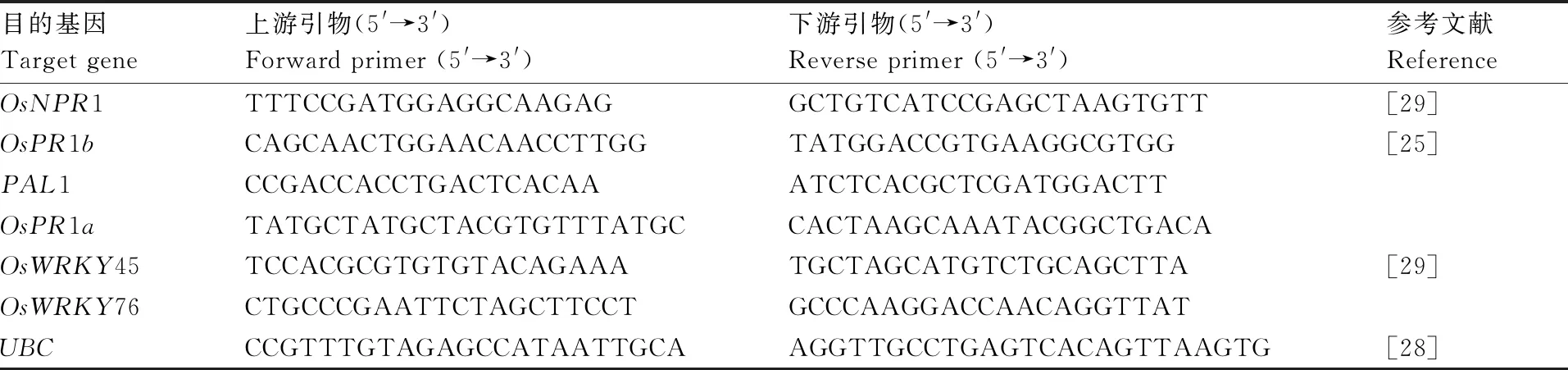
表1 qPCR采用的引物
1.4 水稻叶绿素含量分析
取新鲜水稻苗叶片0.5 g,加入2.0 mL抽提液(乙醇、丙酮、H2O体积比为4.5∶4.5∶1.0)进行抽提,每组实验设置3个生物学重复和3个技术重复。以抽提液为空白对照,使用多功能酶标仪Spect-raMax®M5(美国Molecular Devices公司)在波长645 nm和663 nm处测定叶绿素提取物吸光度,然后参照修正后的Arnon法公式计算叶绿素含量[30]。
2 结果与分析
2.1 外源SA处理对水稻苗期生长的影响
叶绿素含量是反映水稻苗生长状况的重要参数之一,采用分光光度计分析SA对水稻苗叶绿素含量的影响,结果如图1-A所示。低浓度SA(≤2.0 mmol·L-1)处理,不影响水稻叶绿素含量,其中,1.0~2.0 mmol·L-1SA处理的水稻苗叶绿素含量在一定时间内略微上升;中浓度SA(4.0 mmol·L-1)处理后,水稻苗叶绿素含量在24 h后开始下降,在48 h后下降显著(P<0.05);而高浓度SA(>4.0 mmol·L-1)处理24 h后水稻苗叶绿素显著(P<0.05)下降。进一步观察表型发现,高浓度SA(>4.0 mmol·L-1)处理对水稻生长影响较大,8.0、16.0 mmol·L-1SA处理24 h后水稻茎杆外周的叶鞘开始褪绿(图1-B);随着处理时间的延长,褪绿区域逐渐扩大(图1-C);处理72 h后,褪绿区域严重黄(白)化,叶片出现萎蔫(图1-D);处理72 h后,4.0 mmol·L-1SA处理的水稻苗茎杆外周叶鞘也出现褪绿。表明高浓度SA处理可能通过抑制苗期叶绿素积累影响水稻苗生长。
2.2 外源SA处理对SA自身合成的影响
植物体内SA存在ICS (isochorismate synthase)和PAL (phenylalanine ammonia lyase)合成途径,在水稻中PAL途径占主导地位[31-32]。为了探究外源SA处理对水稻中SA合成的影响,选取水稻PAL途径的关键基因OsPAL1进行定量分析。结果(图2)显示,低浓度SA(0.1~4.0 mmol·L-1)处理,OsPAL1基因在8 h内表达量显著下调(约50%),12 h后其表达量呈逐步恢复趋势,与对照相比,其表达量恢复至80%以上,表明低浓度SA处理对OsPAL1表达影响较小。高浓度SA(尤其是8.0~16.0 mmol·L-1)处理水稻后,OsPAL1基因表达显著下调(80%~90%)。上述结果表明,外源喷施SA可下调OsPAL1基因表达,其下调幅度与外源SA浓度呈正相关,推测高浓度外源SA可能抑制水稻内源SA的生物合成。
2.3 外源SA对水稻SA受体基因表达的影响
NPR类基因编码SA受体蛋白,其中,NPR1是关键基因[33-34]。因此,定量分析NPR1基因的表达量来研究外源SA对水稻SA受体基因表达的影响。结果(图3)显示,外源SA处理后水稻NPR1基因表达显著上调,在处理24 h时NPR1基因表达量达到最高,提升10~20倍,其中,2.0 mmol·L-1SA处理水稻苗24 h后,NPR1表达量最高。
2.4 外源SA对水稻WRKY基因表达的影响
WRKY类转录因子与SA诱导的抗性密切相关,SA显著诱导WRKY转录因子家族成员的表达,调控SA信号途径下游基因的表达[35-37]。本研究选取OsWRKY45、OsWRKY76来分析SA对水稻苗WRKY基因表达的影响,结果见图4。其中,OsWRKY45对SA处理的响应较慢,在处理早期(2 h)其表达量几乎不受影响;当SA浓度低于1.0 mmol·L-1时,在12 h内,OsWRKY45表达量变化的幅度较小;处理24~48 h时,OsWRKY45表达量显著上升,其中1.0~4.0 mmol·L-1SA处理的OsWRKY45表达量较高,与对照相比上调8倍以上。SA浓度超过1.0 mmol·L-1时,OsWRKY76的响应较快,与对照相比,在2 h之内上调2倍以上;随着处理时间的延长,OsWRKY76的表达量稳步上升,在24~48 h,OsWRKY76的表达量最高达4倍以上(图4-B)。
2.5 外源SA对病程相关蛋白基因的影响
病程相关蛋白基因(PR基因)是一类重要的防卫基因,且参与MAPK调节植物稳态的过程,大量的研究表明,SA可影响PR基因的表达[38-40]。由图5可知,0.1~16.0 mmol·L-1SA处理的水稻苗中OsPR1a表达量均上调,随着处理时间的延长,OsPR1a表达量也逐渐升高,处理24 h达到最高。其中,1.0~2.0 mmol·L-1SA对OsPR1a的诱导效应最大;OsPR1b变化趋势与OsPR1a不同,低浓度(尤其是0.1 mmol·L-1)SA使OsPR1b的表达上调,而较高浓度SA(>1.0 mmol·L-1)处理时则显著抑制OsPR1b的表达。
3 讨论
SA可通过调节植物基因表达水平参与植物生长发育、抵抗逆境胁迫[41]。本研究选取的6个基因均属于SA生物合成或其抗性信号传导途径的关键基因,结果均表明外源SA能影响这些基因的表达,影响效果与外源SA浓度密切相关,反映了外源SA浓度的重要性。在拟南芥和本氏烟等双子叶模式植物中通常采用的外源SA浓度为0.1~1.0 mmol·L-1[13-14];在水稻中,不同学者采用外源SA浓度差异较大[20-22,24-25,35,37],这给处理效果的比较与实验重复造成诸多不便。SA在水中的溶解度较低,难以用水溶液配制高于16.0 mmol·L-1的SA,若要配制更高浓度的SA需加有机溶剂(如乙醇),而过多的有机溶剂会给植物造成新的逆境胁迫[42];因此,本研究未采用16~400 mmol·L-1SA处理,采用0.1~16.0 mmol·L-1SA。2.0 mmol·L-1SA不仅能显著诱导防卫反应信号通路(NPR1、WRKY45、WRKY76、PR1a)基因的表达,且对叶绿素含量、SA合成产生的影响较小,这为后续外源SA处理提供了实验依据。8.0 mmol·L-1以上SA能够显著诱导防卫反应信号通路基因(NPR1、WRKY45、WRKY76、PR1a)的表达,但明显抑制水稻苗期叶绿素的积累,处理24 h后甚至可观察到叶片褪绿、黄化、萎蔫等症状;但Xie等[25]采用400 mmol·L-1处理水稻,却未见其报道如此高浓度的SA对水稻生长产生不利影响,其原因尚有待进一步探究。有研究显示,高浓度SA降低小麦、拟南芥叶绿素含量,低浓度SA促进叶绿素积累[6]。与此相似,本研究中1.0~2.0 mmol·L-1SA处理48 h,水稻苗叶绿素含量升高,高浓度SA(>4.0 mmol·L-1)处理,会抑制叶绿素的合成。综合分析显示,2.0 mmol·L-1外源SA处理苗期水稻较为合适,在实际使用时可根据其内源SA含量适当调整外源SA浓度,避免盲目使用造成人力物力浪费。
