合成致死理论下常见肿瘤靶点及药物总结*
2021-11-03张昱航许鹏
张昱航,许鹏
712000 陕西 咸阳,陕西中医药大学 研究生院(张昱航);710003 西安,陕西省中医药研究院/陕西省中医医院 肿瘤科(许鹏)
肿瘤是机体DNA损伤产生的远期后果。抑制肿瘤细胞DNA损伤修复对其发生发展具有致命打击。合成致死理论由来已久,其基本原理是两个非致死基因同时失活将导致细胞死亡的现象。当代肿瘤治疗逐渐从干扰DNA理化合成往基因水平精准化打击方向发展。随着临床上基因测序在肿瘤患者中的广泛应用,合成致死相关基因靶向药可以更有效地阻断肿瘤的增殖,为肿瘤治疗带来新的思路。本文从肿瘤基因合成致死理论出发,总结了启动相关肿瘤发生的配对基因在该理论下抑制肿瘤的原理及常见实体瘤的靶向药物特点。
1 合成致死
研究者们在很久以前就发现,同时携带有两个特定基因突变的细胞无法存活,而携带其中任何一个基因单独突变的细胞却不会受到影响,此即为“合成致死(synthetic lethality)”理论[1]。而大多数肿瘤本身就携带有多种基因突变,并且存在“癌基因成瘾”现象,即与正常细胞相比,癌细胞由于携带有多种失活的基因,故而生长和存活更依赖于特定的癌基因,适应性更差[2]。对于依赖特定癌基因的癌细胞,针对其“成瘾”的基因予以药物打击,或许就可以达到精准化杀伤的目的,如酪氨酸激酶、细胞周期依赖蛋白激酶、聚糖聚合酶、解旋体蛋白酶等[3-4]。在合成致死的基本原理下,如果发现某种肿瘤细胞中存在特定基因A失活,用特定药物抑制其合成致死搭档基因B,此时正常细胞因为携带有正常的基因A而能行使其功能,不会受到药物的伤害,而肿瘤细胞的基因A和基因B均失活,就会在该药物作用下死亡[5-6](图1、2)。例如,研究者们已发现,对于携带BRCA基因突变的肿瘤,利用药物对其合成致死搭档基因PARP进行打击可以达到很好的肿瘤抑制效果[7-8]。这也促使研究者们从寻找合成致死的“基因—药物”的模式向“基因—基因”模式发展[9]。

图1 合成致死理论中的正常细胞

图2 合成致死理论中的肿瘤细胞
2 常见实体瘤基因合成致死
2.1 肺癌
肺癌认识全球最为常见的肿瘤。由于肺癌与驱动基因的相关性得到越来越多的证实,靶向药物在肺癌精准治疗“基因—药物”模式中的应用近年来已取得了重大进展,目前以合成致死策略抑制肺癌的相关组合如下(相关配对靶向药总结详见表1):
2.1.1 EGFR-KRAS 表皮生长因子(epithelial growth factor,EGF)通过EGF受体(EGF receptor,EGFR)酪氨酸激酶结合配体并激活多个信号级将细胞外信号转化为适当的细胞应答[10]。EGFR基因编码的跨膜糖蛋白与EGF结合后会诱导受体二聚化和酪氨酸自磷酸化,其GTPase活性活化,从而激活多个重要的下游信号级联反应,包括RAS-RAF-MEK-ERK、PI3K-AKT、NF-κB信号级联[11],并将EGFR信号转导至G蛋白偶联的受体信号转导[12-13],可能介导细胞的增殖和迁移[14]。该基因的异常已被证明是多种肿瘤的驱动因素,如非小细胞肺癌、胶质母细胞瘤和基底样乳腺癌。KRAS基因属于RAS家族,其编码的蛋白质是GTPase 超家族的成员,其中RAS蛋白结合GDP/GTP并具有固有的GTPase活性[15]。KRAS相关的途径包括常见的细胞因子受体γ链家族信号传导途径和MAPK途径的负调控[16],在细胞增殖的调节中起重要作用。目前发现,KRAS蛋白的功能与多种恶性肿瘤有关,包括肺腺癌、粘液腺瘤、胰腺导管癌和结肠直肠癌。例如,有研究者发现,在肺癌细胞中,异常KRAS能以ZNF304依赖性的方式抑制肿瘤抑制基因转录,从而在致癌事件中发挥作用[17]。另外,在携带EGFR突变的肺癌细胞系中强制表达突变的KRAS基因时会明显抑制肺癌细胞,最突出的特征是细胞空泡化、形态改变和胞饮作用增加[18]。另外,临床上也发现,同时携带EGFR突变和KRAS突变的肺癌患者预后较差,且在单用EGFR-TKI治疗效果欠佳[19]。故而EGFR和KRAS可能是一对合成致死搭档基因。目前已有研究者正在开展联合KRAS抑制剂AMG510和EGFR-TKI抑制剂用于肺癌的临床研究(图3A)。
2.1.2 CDK4-RAS 细胞周期蛋白依赖性激酶4(cyclin-dependent kinases,CDK4)参与细胞周期和分化的控制,与多种癌症类型有关,是肿瘤治疗研究和开发的重点。 在细胞周期中,CDK4相关复合物可同时磷酸化pRB/RB1和NPM1,促进细胞向G1/S相过渡,控制细胞周期循环启动并阻止细胞负向调节分化[20]。在肿瘤细胞中,表达异常的CDK4会导致肿瘤细胞持续增殖。RAS家族包括KRAS、NRAS、HRAS等,可通过染色质重塑(DNA-核小体拓扑结构的改变)参与特定基因的转录激活和抑制。野生型RAS蛋白在肿瘤发生、维持和转移中具有重要作用,其中KRAS作用尤为重要。Zhou等[21]在小鼠模型中发现,因为敲除KRAS的小鼠在胚胎发生过程中即死亡,而HRAS无法完全取代KRAS功能,同时NRAS对小鼠的胚胎发育并无影响。因此,KRAS是胚胎发育过程中最重要的RAS亚型。在RAS突变肿瘤中,以KRAS为主的RAS蛋白发挥肿瘤促进作用。Puyol等[22]通过小鼠肺癌模型发现,在携带KRAS突变的肺癌细胞中,抑制CDK4表达会导致细胞发生凋亡,而抑制CDK2/6则不会如此。因此,CDK4和KRAS可能也是一对合成致死搭档基因。有研究者已发现,在抑制KRAS的基础上增加CDK4细胞周期抑制剂能有效抑制癌细胞的生长[21](图3B)。
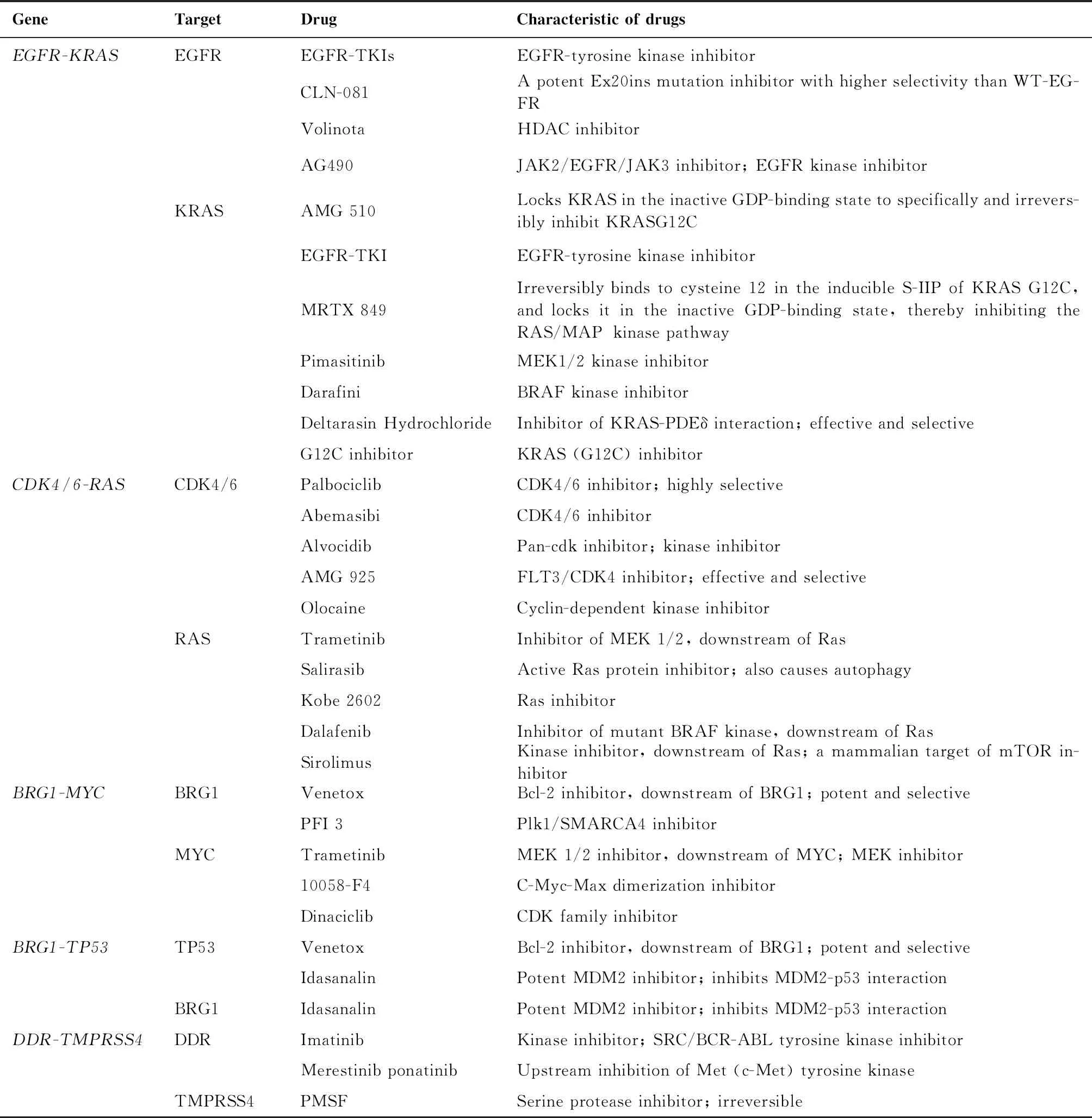
表1 肺癌相关合成致死基因或蛋白及相关靶向药特点
2.1.3 BRG1-MYC BRG1属SWI/SNF复合体的成员,其相关途径包括Wnt介导的β-连环蛋白信号传导的调控和靶基因的转录[23]。与BRG1相关的CREST-BRG1复合物可协调钙依赖型阻遏物复合物的释放和激活物调节启动子的激活,而抑制BRG1蛋白则可抑制转录启动;其亚结构溴结构域可作为表观遗传的“阅读器”,选择性识别组蛋白尾部的乙酰化赖氨酸残基,精准调控细胞基因转录。BRG1在肺癌细胞中表达上调,可能在肺癌的发生发展中发挥了重要作用,或可作为靶向治疗的靶点[24]。MYC基因与抑制细胞分化、肿瘤转化密切相关。该基因编码的蛋白质能与转录因子MAX形成异源二聚体,并与E box DNA共有序列结合而调节特定靶基因的转录和表达,参与体细胞重编程调节,并控制干细胞的自我更新[25]。有研究发现,大多数肺癌都携带有BRG1突变,而在肺癌细胞中表达野生型的BRG1可显著下调MYC活性,并抑制肺癌细胞的侵袭和迁移能力[26]。这种效应可能是通过BRG1与MYC以及MYC靶向的增强子相结合来实现的[27]。因此,BRG1和KRAS可能存在着一定的拮抗作用,或许在功能上也是一对合成致死搭档基因(图3C)。
2.1.4 TMPRSS4-DDR1 TMPRSS4是一种跨膜丝氨酸蛋白酶,在肺癌、胰腺癌中存在过度表达,可能与其他类型的 RNA 相互作用而发挥,促进致癌作用,并且可能是预测不良预后的重要独立因素[28]。DDR1属于酪氨酸激酶受体的亚家族,调节细胞对细胞外基质的附着,细胞外基质的重塑,以及细胞迁移、分化和增殖,在肿瘤细胞侵袭中扮演重要角色。TMPRSS4和DDR1之间有着一致的共表达[29]。与TMPRSS4相似,在非小细胞肺癌中,DDR1启动子被低水平甲基化,而低水平甲基化是无病生存的独立预后因素[30]。有研究发现,用胞嘧啶5-氮胞苷处理肺癌细胞后可增加DDR1的表观遗传调控水平,而缺乏TMPRSS4的细胞对DDR1抑制剂dasatinib的细胞毒性作用高度敏感[31]。Villalba等[32]的研究发现,TMPRSS4与DDR1有可能是一对合成致死搭档基因,或可作为合成致死的靶点(图3D)。

图3 合成致死搭档基因的信号模式
2.2 乳腺癌、卵巢癌
乳腺癌近年逐步成为全球发病率最高的恶性肿瘤,可遗传的基因突变仍是肿瘤发生的重要因素。随着患病人群增多及患者生存期延长,基因遗传给子代并累积的可能性越来越大。目前研究者们已发现了一些可能的合成致死搭档基因,其中针对BRCA-PARP这一对合成致死搭档基因的治疗策略已在临床上取得了成功(相关配对靶向药总结详见表2)。

表2 乳腺癌卵巢癌相关合成致死基因或蛋白及相关靶向药特点
BRCA基因编码的蛋白质可与其他肿瘤抑制因子、DNA损伤传感器和信号传感器结合形成BRCA相关基因组监视复合体,通过多机制参与DNA双链断裂的修复和同源重组[33]。BRCA相关的肿瘤包括乳腺癌、卵巢癌、输卵管癌、前列腺癌等,其中约40%~80%的乳腺癌和卵巢癌病例均涉及到BRCA突变。BRCA主要包括BRCA1、BRCA2,而BRCA1/2突变引起的癌症风险以显性方式遗传,突变携带者患乳腺癌和卵巢癌的累积终生风险大幅度升高。近期研究表明,BRCA突变状态与乳腺癌和卵巢癌病理类型、治疗方式、铂类药物治疗反应、生存预后相关。PARP基因家族成员包括PARP1、PARP2、PRAP3等[34],主要编码DNA损伤修复相关蛋白以及其他肿瘤抑制因子,可与DNA损伤传感器和信号转导子结合形成一个大型的多亚基蛋白质复合物,参与调节多种重要的细胞行为(如分化、增殖和肿瘤转化)和DNA 损伤修复[35]。PARP依赖的PARP9-DTX3L介导的泛素化可促进BRCA被迅速且特异性募集到DNA损伤位点行使功能[36]。在BRCA突变影响下,PARP抑制剂将减少相关修复蛋白的形成,并阻碍BRCA1/BARD1复合物被快速招募至DNA损伤位点,从而阻碍DNA修复并导致细胞死亡[37-39]。目前,对于携带BRCA突变的晚期乳腺癌和卵巢癌患者,PARP抑制剂治疗成为标准治疗手段(图4)。
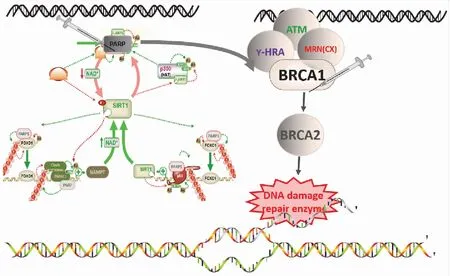
图4 BRCA-PARP的合成致死搭档基因信号模式图
2.3 结肠癌
近年来,结肠癌发病呈现年轻化的趋势,这可能与其基因不稳定的持续修复缺陷有关。正常的错配修复在机体细胞中扮演极为重要的角色,而这一功能的丧失会导致细胞的其他信号活动发生复杂改变,而抑制结肠癌肿瘤细胞则需要通过多种途径(相关配对靶向药总结详见表3)。

表3 结肠癌相关合成致死基因或蛋白及相关靶向药特点
2.3.1 PLK1-RASPLK1基因编码Polo样激酶,为一种Ser/Thr蛋白激酶,属于CDC5/Polo亚家族,在有丝分裂过程中高度表达,且在细胞周期的整个M期中均发挥着重要功能[40],包括调节中心体成熟和纺锤体组装、从染色体臂去除粘连蛋白以及调节胞质分裂。Polo样激酶通过结合已被 Polo盒域识别的特定基序并使其磷酸化而发挥功能。在有丝分裂后期和DNA损伤后,Polo样激酶会被泛素化,导致其被蛋白酶体降解,对于维持有效的G2 DNA损伤检查点至关重要[41]。结肠癌KRAS突变状态对治疗、预后具有重要意义。研究发现,RAS 通过独立于 MEK/ERK 的机制激活 PLK1[42],而RAS的下游靶标CRAF也会与PLK1 相互作用并将其激活,导致细胞分裂和肿瘤进展。PLK1抑制剂用于KRAS突变结肠癌的相关临床实验已通过有效性和安全性验证[43],这或许能为KRAS突变型结肠癌的耐药机制及后治疗策略提供参考(图5A)。
2.3.2 PLK1-TP53 PLK1与细胞周期进程、有丝分裂、DNA损伤等密切相关,在有丝分裂过程中高度表达,在细胞分裂前期过程中介导APC/C复合物负调节剂的磷酸化,导致其泛素化并被蛋白酶体降解。充当TP53家族成员的负调节剂。TP53(肿瘤蛋白53)在许多肿瘤类型中充当抑制因子,根据生理环境和细胞类型诱导生长停滞或细胞凋亡。作为反式激活剂参与细胞周期调节,通过控制该过程所需的一组基因来负向调节细胞分裂。与TP53 突变细胞相比,表达野生型TP53 的癌细胞对 PLK1 抑制的敏感性降低[44]。TP53 介导的一种补偿机制可以挽救癌细胞免受 PLK1 抑制引起的有丝分裂停滞和随后的细胞凋亡。若TP53与PLK1同时受到抑制可导致细胞死亡。同时具有TP53缺陷和高PLK1表达的肿瘤可能对PLK1抑制剂敏感[45]。虽然在此存在实验数据上的争议,但应用PLK1抑制剂抑制肿瘤发生的实验仍需深入[46](图5B)。
2.4前列腺癌
前列腺癌在男性新发肿瘤中地位重要,其相关研究进展越来越深入。目前以合成致死策略抑制前列腺癌的相关组合如下(相关配对靶向药总结详见表4)。
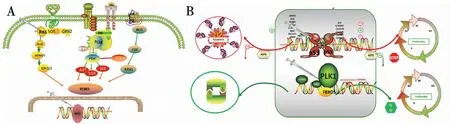
图5 PLK1-TP53的合成致死搭档基因信号模式图
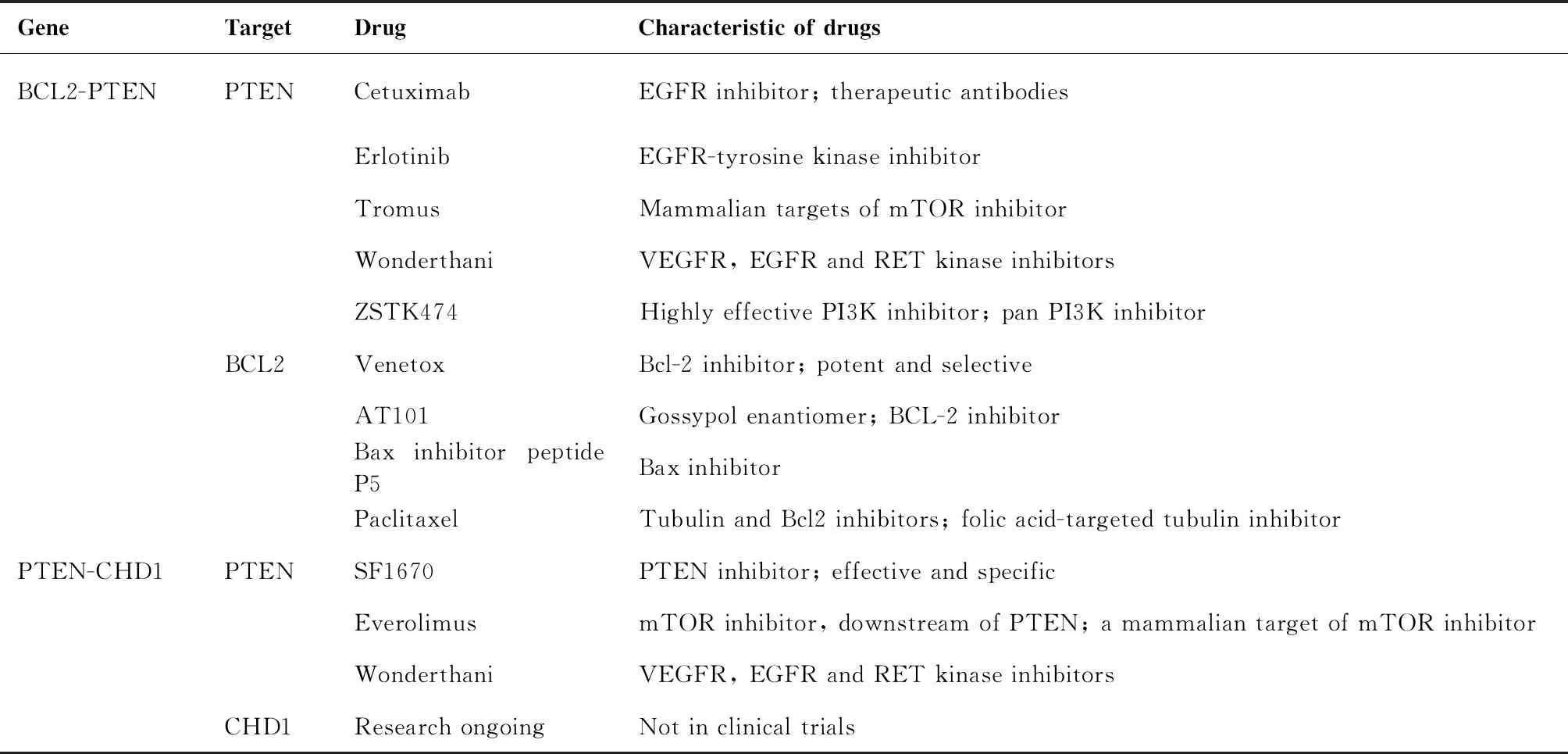
表4 前列腺癌相关合成致死基因或蛋白及相关靶向药特点
2.4.1 BCL2-PTENBCL2基因编码的蛋白通过控制线粒体膜通透性来调节细胞死亡[47],其相关途径包括T细胞中的细胞凋亡调节和Nur77信号传导。研究者们已发现,在雄激素非依赖性前列腺癌中,BCL2与促雄激素相关的信号传导有关,并已被证实是预后相关因子[48],而BCL2上调、PTEN损失、PI3K/AKT磷酸化和受体酪氨酸激酶激活均与雄激素非依赖性前列腺癌有关。PTEN是一种多功能的肿瘤抑制因子,在前列腺癌、胶质母细胞瘤、子宫内膜癌、肺癌和乳腺癌中均有不同程度的表达,其中高达70%的前列腺癌患者携带有缺陷的PTEN[49]。PTEN是PI3K/AKT/mTOR通路的一部分,参与DNA无错误同源重组,可调节细胞周期进程和细胞存活,并且mTOR抑制剂对PTEN缺陷的前列腺癌患者相对无效[50]。Guccini等[51]研究发现,在小鼠前列腺癌模型中,PTEN缺失或通过药物抑制PTEN可防止前列腺癌的进展。另外,PTEN的核泛素化构型具有更强大的诱导凋亡潜力,而胞质非泛素化构型诱导的凋亡的能力则较弱[52](图6A)。
2.4.2 CHD1-PTEN CHD1的缺失是前列腺癌中最常见的基因改变。CHD蛋白家族的存在于染色质结构域和SNF2相关解旋酶/ ATPase结构域[53],可能通过修饰染色质结构来改变基因表达,从而对DNA复制产生负向调节。Augello等[54]发现,在前列腺癌细胞中,缺失CHD1会通过影响雄激素受体的功能来促成前列腺癌的发生发展,并且缺失CHD1的前列腺肿瘤似乎对阿比特龙治疗高度敏感[55],因此CHD1缺失可能是导致去势抵抗型前列腺癌的重要因素。有研究发现,CHD1缺失会使前列腺癌细胞对DNA损伤更为敏感[56]。这可能是因为,CHD1参与无错误同源重组修复,而CHD1缺失会导致无错误同源重组修复减少,使得细胞中发生的复制错误不断累积,导致细胞死亡。研究发现,在前列腺癌中CHD1与PTEN或许为一对合成致死搭档基因,为潜在的治疗靶点[57](图6B)。

图6 BCL2-PTEN和CHD1-PTEN的合成致死搭档基因信号模式图
3 总结与展望
肿瘤合成致死在现代肿瘤精准治疗中的地位越来越重要,应用多个靶点的共同抑制作用杀伤肿瘤为今后治疗肿瘤带来新方向。合成致死的概念在抗癌药物研发中具有重要指导意义,该理论在肿瘤治疗中或将扮演重要角色。以PARP抑制剂为代表的合成致死实践在多个癌种中取得了优异的成绩,而即将上市的KRAS抑制剂AMG510也有着非常良好的前景。在高通量测序技术和CRISPR基因编辑技术的助力下,越来越多的基因药物应运而生,关于合成致死搭档基因及其抑制作用的研究越来越多,例如:乳腺癌和卵巢癌中的miRNA-206-MYC;肺癌中的MK2-TP53;肠癌中的DR5-MYC、LncNEAT1-TP53;前列腺癌中的MAP-4-TP53;脑胶质瘤中的PIA-TP53;血液恶性肿瘤中的4EBP1-MYC。此外,利用合成致死理论的新一代靶向药物也已进入临床试验,如PRMT5-MTAP和ME2-ME3。在不远的将来,合成致死策略或将成为肿瘤患者的福音。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
doi:10.3390/biom11020129.
doi:10.3892/ijmm.2021.4897
doi:10.1002/ddr.21796
