聚球藻对酚酸类化感物质的生长和生理响应
2021-11-02刘吉祥刘芳宇孙林鹤徐迎春常雅军姚东瑞
刘吉祥, 刘芳宇, 孙林鹤, 崔 键, 徐迎春, 常雅军,①, 姚东瑞,①
〔1. 江苏省中国科学院植物研究所(南京中山植物园): a. 江苏省水生植物资源与水环境修复工程研究中心,b. 江苏省植物资源研究与利用重点实验室, 江苏 南京 210014; 2. 南京农业大学园艺学院, 江苏 南京 210095〕
化感物质是次生代谢产物,分子量较小,结构相对简单,在自然环境中易降解,生态安全性较好[1]。植物化感物质对藻类具有生长抑制效应[2],植物化感抑藻技术是生态安全、环境友好的控藻技术[3-5]。近年来,化感作用是农业、环境科学和生态领域的研究热点之一[6]。目前已发现植物化感物质20余种,其中酚酸类化感物质的化感作用较强[7-8]。穗状狐尾藻(MyriophyllumspicatumLinn.)中的儿茶酚、五倍子酸、鞣花酸和邻苯三酚等可同时抑制铜绿微囊藻(MicrocystisaeruginosaKützing)和斜生栅藻〔Scenedesmusobliquus(Turpin) Kützing〕生长[9-11];苦草(VallisneriaspiralisLinn.)中的苯甲酸、阿魏酸和咖啡酸等可显著抑制铜绿微囊藻生长[2,12-13];0.6 mmol·L-1羟基苯甲酸和1.0 mmol·L-1阿魏酸可显著抑制水华鱼腥藻〔Anabaenaflosflos-aquae(Lyngb.) de Breb.〕和蛋白核小球藻(ChlorellapyrenoidosaChick)生长[14];水杨酸对铜绿微囊藻和蛋白核小球藻的混合体系有生长抑制效应,半致死浓度为64.90 mg·L-1[15];0.6 mmol·L-1水杨酸对水华鱼腥藻的生长抑制效应最佳[16]。
酚酸类化感物质对蓝藻的生长抑制作用及蓝藻的生理生化响应与酚酸类化感物质和蓝藻的种类相关。酚酸类化感物质对蓝藻的化感抑制机制主要包括:1)对蓝藻细胞膜的影响与破坏,如对羟基苯甲酸会造成铜绿微囊藻细胞膜的破裂和溶解[17];2)对蓝藻细胞光系统的影响与损坏,如邻苯二酚会对铜绿微囊藻的PSⅡ活性造成持续的、不可恢复的破坏[18];3)影响蓝藻细胞抗氧化酶活性,如在酚酸类化感物质胁迫下,藻类的抗氧化酶活性随活性氧浓度的增加呈现先升高后降低的趋势[14,19];4)调控蓝藻生长发育相关基因的表达[20]。聚球藻作为海洋和淡水蓝藻中最主要的代表性类群之一[21],其结构简单,遗传多样性和生态型丰富,是微型生物生态学研究的模式种,且聚球藻基因组信息公布较早,具有成熟的遗传转化体系,在生理生化和分子生物学方面的背景信息较为清楚,是蓝藻模式种中的优势种[22-23],可作为化感物质抑藻分子机制研究的良好材料。
本研究选取常见的酚酸类化感物质苯甲酸、水杨酸和阿魏酸为抑制剂,研究这3种酚酸类化感物质对聚球藻的抑制效应,分析聚球藻在细胞形态、光系统及抗氧化酶活性等方面的响应机制,以期明确酚酸类化感物质抑制聚球藻生长的生理生化机制,为酚酸类化感物质抑藻的分子机制研究提供理论依据。
1 材料和方法
1.1 材料
聚球藻Synechococcussp. PCC7942购自中国科学院淡水藻种库,编号为FACHB-805。供试藻种采用pH (7.0±0.1)的BG-11培养基[21]培养,培养条件为温度(25±1) ℃、光照度4 000 lx、光照时间12 h·d-1;每天摇动培养瓶1~2次,每7~10 d转接1次。
苯甲酸、水杨酸和阿魏酸均为分析纯,购自阿拉丁试剂(上海)有限公司。
1.2 方法
1.2.1 实验设计 将苯甲酸、水杨酸和阿魏酸分别用BG-11培养基配置成500 mg·L-1母液,于121 ℃高压灭菌30 min,现配现用。取处于对数生长期的聚球藻藻液10 mL,分别加入上述3种化感物质的母液至500 mL,聚球藻细胞浓度为1×104~1×105mL-1,苯甲酸和水杨酸的浓度分别为25、30、35和40 mg·L-1,阿魏酸的浓度分别为30、40、50和60 mg·L-1。对照为500 mL 不添加酚酸类化感物质的BG-11培养基。每组3个重复,置于光照培养箱,培养条件同“1.1”,培养周期9 d,定时测定相关指标。
1.2.2 指标测定
1.2.2.1 细胞密度测定 每天9:00将聚球藻培养液摇匀后,各处理取5 mL,使用UV-1600紫外分光光度计(上海美谱达仪器有限公司)于波长680 nm处测定其吸光值(A),即为细胞密度,以BG-11培养基作空白对照。
1.2.2.2 细胞形态观测 实验结束当天(处理9 d),各取一定量的聚球藻培养液于室温、4 000 r·min-1离心10 min,去除上清液,收集浓缩藻细胞,然后加入磷酸缓冲液(pH 7.0)配置的体积分数2.5%戊二醛溶液固定藻细胞[24],置于4 ℃冰箱,每7 d更换1次固定液。采用K850临界点干燥仪(英国Quorum公司)干燥后,在Quanta 200环境扫描电子显微镜(美国FEI公司)下观测聚球藻的细胞形态。
1.2.2.3 叶绿素a含量测定 分别于处理0、3、6和9 d取各处理摇匀的聚球藻培养液10 mL,于室温、4 000 r·min-1离心10 min,去除上清液,沉淀用液氮速冻后研磨破碎,加入等体积无水乙醇[25],混合均匀,静置至叶绿素萃取充分,然后于室温、4 000 r·min-1离心10 min。使用分光光度计分别于波长665和649 nm处测定上清液的吸光值,以无水乙醇为空白对照,根据公式“叶绿素a含量=13.90A665-5.76A649”计算叶绿素a含量。
1.2.2.4 部分叶绿素荧光参数测定 分别于处理0、3、6和9 d取各处理摇匀的聚球藻培养液20 mL,暗适应20 min后,利用FluorPen手持式叶绿素荧光仪(北京易科泰生态技术有限公司)测定聚球藻初始荧光(Fo)和PSⅡ最大光化学效率(Fv/Fm)。
1.2.2.5 抗氧化酶活性测定 参照文献[26],于实验结束当天(处理9 d),取数份50 mL聚球藻培养液,于室温、4 000 r·min-1离心10 min,去除上清液,收集沉淀。用1 mL 0.05 mol·L-1磷酸缓冲液(pH 7.0)在冰浴中研磨为匀浆,使用D3024R高速冷冻离心机(美国Scilogex公司)于4 ℃、4 000 r·min-1离心10 min,获得聚球藻粗酶提取液。聚球藻的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性分别按照SOD试剂盒A001-1-2、POD试剂盒A084-3-1和CAT可见光试剂盒A007-1-1(南京建成生物工程研究所)的方法测定。
1.3 数据统计分析
采用WPS Office 2019软件和Origin 2018软件进行数据处理和图表绘制,采用SPSS 26.0软件进行单因素方差分析及显著性分析(P<0.05)。
聚球藻生长抑制率(IR)计算公式为IR=(1-N/N0)×100%。式中,N为处理组聚球藻细胞密度(以A680表示),N0为同一处理时间对照组的聚球藻细胞密度[27]。
2 结果和分析
2.1 不同浓度酚酸类化感物质处理下聚球藻的生长及细胞形态响应
2.1.1 对生长的影响 不同浓度酚酸类化感物质处理下聚球藻的生长响应见图1,对聚球藻生长的抑制率见表1。结果显示:与对照(不添加酚酸类化感物质)相比,随着处理时间的延长,25 mg·L-1苯甲酸对聚球藻的生长呈现先抑制后促进效应;30 mg·L-1苯甲酸对聚球藻的生长呈现明显的抑制效应,处理9 d,抑制率为33.99%;35和40 mg·L-1苯甲酸处理8 d,聚球藻的生长基本处于被阻止状态,而处理9 d,35 mg·L-1苯甲酸处理组的聚球藻出现生长恢复现象,40 mg·L-1苯甲酸处理组的聚球藻细胞出现衰亡现象。
与对照相比,25~40 mg·L-1水杨酸对聚球藻的生长呈现明显抑制效应,其中,30~40 mg·L-1水杨酸对聚球藻的生长抑制效应加剧,处理8 d,抑制率在70%左右,处理9 d,30 mg·L-1水杨酸处理组的聚球藻出现生长恢复现象,而35和40 mg·L-1水杨酸处理组的聚球藻细胞出现衰亡现象。说明水杨酸对聚球藻的抑制效应随其浓度升高而增强,处理9 d,25、30、35和40 mg·L-1水杨酸对聚球藻生长的抑制率分别为34.27%、66.01%、85.39%和83.43%。
与对照相比,30和40 mg·L-1阿魏酸明显促进聚球藻生长,而50和60 mg·L-1阿魏酸处理前8 d,聚球藻的生长基本被阻止,二者的抑制率在75%左右;50 mg·L-1阿魏酸处理9 d,聚球藻出现生长恢复现象。
比较3种酚酸类化感物质对聚球藻生长的抑制率,处理9 d,25 mg·L-1水杨酸对聚球藻生长的抑制率为34.26%,而25 mg·L-1苯甲酸对聚球藻生长还有一定的促进作用,说明水杨酸对聚球藻的抑制效果优于苯甲酸,但40 mg·L-1苯甲酸和水杨酸对聚球藻生长的抑制率均达到85%左右;而30和40 mg·L-1阿魏酸明显促进聚球藻生长。另外,苯甲酸和阿魏酸对聚球藻的生长均呈现低促高抑现象。
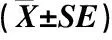
表1 不同浓度酚酸类化感物质处理下聚球藻生长的抑制率
2.1.2 对细胞形态的影响 不同浓度酚酸类化感物质处理下聚球藻的细胞形态响应见图2。结果显示:对照组聚球藻分裂旺盛、生长正常,分布相对均匀,细胞个体分明、表面光滑,形态完整。25 mg·L-1苯甲酸以及30和40 mg·L-1阿魏酸处理组的聚球藻细胞形态与对照组基本一致;30和35 mg·L-1苯甲酸抑制聚球藻的细胞生长,40 mg·L-1苯甲酸阻止聚球藻的细胞生长,基本抑制细胞分裂,细胞分布不均、凹陷明显,胞外出现大量絮状分泌物和内容物,部分细胞出现抱团聚集现象,且随浓度升高抱团聚集现象越明显。25和30 mg·L-1水杨酸抑制聚球藻细胞生长,细胞分裂相对减少,细胞表面出现皱缩和凹陷,存在少量胞外分泌物;35和40 mg·L-1水杨酸以及50和60 mg·L-1阿魏酸阻止聚球藻细胞生长,细胞分裂更少、分布不均,胞外出现大量的絮状分泌物和内容物,且50 mg·L-1阿魏酸导致聚球藻细胞破裂,细胞出现板结和凝聚现象。总体上看,上述3种酚酸类化感物质的浓度范围内,聚球藻细胞形态受影响程度随3种酚酸类化感物质浓度的升高而加剧。在酚酸类化感物质的作用下,随处理浓度的升高,聚球藻的细胞膜会逐渐出现皱缩、破损,细胞膜结构的破坏和功能的丧失,内容物大量外渗以及细胞黏连出现凝聚成团和板结等现象,最终细胞死亡。

A1,A2,A3,A4: 分别为25、30、35和40 mg·L-1苯甲酸处理25, 30, 35, and 40 mg·L-1 benzoic acid treatments, respectively; B1,B2,B3,B4: 分别为25、30、35和40 mg·L-1水杨酸处理25, 30, 35, and 40 mg·L-1 salicylic acid treatments, respectively; C1,C2,C3,C4: 分别为30、40、50和60 mg·L-1阿魏酸处理30, 40, 50, and 60 mg·L-1 ferulic acid treatments, respectively; D1,D2,D3: 对照(不添加酚酸类化感物质)The control (not adding phenolic acid allelochemicals).
2.2 不同浓度酚酸类化感物质处理下聚球藻的生理响应
2.2.1 对叶绿素a含量的影响 不同浓度酚酸类化感物质对聚球藻叶绿素a含量的影响见表2。结果显示:与对照(不添加酚酸类化感物质)相比,25 mg·L-1苯甲酸处理3 d,聚球藻叶绿素a含量显著降低,处理6和9 d,叶绿素a含量明显升高;30、35和40 mg·L-1苯甲酸处理3~9 d,叶绿素a含量总体上显著降低,处理9 d,叶绿素a含量分别为0.589 5、0.168 8和0.014 4 μg·mL-1,分别为对照的79.31%、22.71%和1.94%,苯甲酸浓度在30 mg·L-1及以上时,聚球藻叶绿素a含量随苯甲酸浓度升高而降低。随着处理时间的延长,25 mg·L-1苯甲酸处理叶绿素a含量的变化趋势与对照一致,呈逐渐升高的趋势,30和35 mg·L-1苯甲酸处理的叶绿素a含量呈先降低后升高的趋势。
与对照相比,25、30、35和40 mg·L-1水杨酸处理聚球藻叶绿素a含量显著降低,处理9 d,叶绿素a含量分别为对照的77.40%、28.36%、3.62%和1.33%。随着处理时间的延长,25、30和35 mg·L-1水杨酸处理的叶绿素a含量呈先降低后升高的趋势,40 mg·L-1水杨酸处理的叶绿素a含量总体呈降低的趋势。
与对照相比,30和40 mg·L-1阿魏酸处理6和9 d,聚球藻叶绿素a含量显著升高,而50和60 mg·L-1阿魏酸处理3~9 d,叶绿素a含量显著降低,处理9 d时叶绿素a含量仅为对照的29.99%和9.51%,与阿魏酸对聚球藻生长的影响呈低促高抑的趋势一致。随着处理时间的延长,30和40 mg·L-1阿魏酸处理的叶绿素a含量呈逐渐升高的趋势;50 mg·L-1阿魏酸处理的叶绿素a含量在处理0~6 d基本稳定,在处理9 d明显升高;60 mg·L-1阿魏酸处理的叶绿素a含量呈先降低后升高的趋势。
25 mg·L-1水杨酸处理的聚球藻叶绿素a含量显著低于对照,而同一浓度苯甲酸处理6和9 d时叶绿素a含量高于对照;40 mg·L-1苯甲酸和水杨酸处理9 d,叶绿素a含量均仅为对照的1.5%左右,而30和40 mg·L-1阿魏酸处理6和9 d,叶绿素a含量显著升高。总体上看,在不同浓度和不同种类的酚酸类化感物质处理下,聚球藻叶绿素a含量的变化趋势与其生长响应相似,且水杨酸对聚球藻叶绿素a含量的抑制作用最好,苯甲酸次之,阿魏酸最差。
2.2.2 对初始荧光(Fo)的影响 不同浓度酚酸类化感物质对聚球藻Fo值的影响见表3。结果显示:25 mg·L-1苯甲酸处理3 d,聚球藻的Fo值较对照显著降低,处理6和9 d,Fo值较对照升高,但差异不显著;与对照相比,苯甲酸浓度在30 mg·L-1及以上时,聚球藻的Fo值总体随着苯甲酸浓度升高而显著降低。随着处理时间延长,25和30 mg·L-1苯甲酸处理Fo值的变化趋势与对照一致,呈逐渐升高的趋势,35和40 mg·L-1苯甲酸处理的Fo值呈“升高—降低—升高”的波动变化。
与对照相比,25~40 mg·L-1水杨酸处理聚球藻的Fo值显著降低,且随水杨酸浓度的升高,处理3 d时Fo值先升高后降低,处理6和9 d时Fo值逐渐降低。随着处理时间延长,25 mg·L-1水杨酸处理的Fo值呈逐渐升高的趋势,30、35和40 mg·L-1水杨酸处理的Fo值呈“升高—降低—升高”的波动变化。

表2 不同浓度酚酸类化感物质对聚球藻叶绿素a含量的影响
与对照相比,低浓度(30和40 mg·L-1)阿魏酸处理聚球藻的Fo值升高,但总体差异不显著,而高浓度(50和60 mg·L-1)阿魏酸处理的Fo值显著降低。随着处理时间延长,30、40和50 mg·L-1阿魏酸处理的Fo值基本呈升高的趋势,60 mg·L-1阿魏酸处理的Fo值呈“升高—降低—升高”的波动变化,其中,处理9 d,Fo值有一定程度的恢复,这可能与聚球藻细胞的生长阻止效应被解除有关。
比较3种酚酸类化感物质的抑制效应发现,25、30和35 mg·L-1水杨酸处理9 d,聚球藻的Fo值均低于同浓度苯甲酸,仅在浓度为40 mg·L-1时,2个处理的Fo值均降低至190左右,说明水杨酸对聚球藻Fo值的抑制效应较苯甲酸更强;与对照相比,阿魏酸对聚球藻Fo值的影响仍呈现低促高抑现象。不同浓度的3种酚酸类化感物质对聚球藻Fo值的影响与聚球藻的生长响应和叶绿素a含量变化一致。
2.2.3 对PSⅡ最大光化学效率(Fv/Fm)的影响 不同浓度酚酸类化感物质对聚球藻Fv/Fm值的影响见表3。结果显示:与对照相比,25~40 mg·L-1苯甲酸处理聚球藻的Fv/Fm值总体上显著降低,且苯甲酸浓度越高,Fv/Fm值降幅越大。随着处理时间延长,25、30和35 mg·L-1苯甲酸处理的Fv/Fm值总体呈先降低后升高的趋势,说明这3个苯甲酸处理可抑制聚球藻光系统活性,但处理后期抑制效果减弱;而40 mg·L-1苯甲酸处理9 d时Fv/Fm值降为0。
25 mg·L-1水杨酸处理3 d,聚球藻的Fv/Fm值与对照相同,处理6和9 d,Fv/Fm值较对照有所降低,但差异不显著;与对照相比,30、35和40 mg·L-1水杨酸处理的Fv/Fm值显著降低,且水杨酸浓度越高,Fv/Fm值降幅越大。随着处理时间延长,25 mg·L-1水杨酸处理的Fv/Fm值一直在0.23左右,30 mg·L-1水杨酸处理的Fv/Fm值呈先降低后升高的趋势,而35和40 mg·L-1水杨酸处理的Fv/Fm值持续下降。
与对照相比,30和40 mg·L-1阿魏酸处理聚球藻的Fv/Fm值无显著变化,而50和60 mg·L-1阿魏酸处理的Fv/Fm值显著降低。随着处理时间延长,30和40 mg·L-1水杨酸处理的Fv/Fm值一直在0.24左右,50和60 mg·L-1阿魏酸处理的Fv/Fm值总体呈下降趋势。

表3 不同浓度酚酸类化感物质对聚球藻初始荧光(Fo)和PSⅡ最大光化学效率(Fv/Fm)的影响
比较3种酚酸类化感物质对聚球藻Fv/Fm值的影响发现,处理9 d,40 mg·L-1苯甲酸和水杨酸处理聚球藻的Fv/Fm值均降至0,25、30和35 mg·L-1水杨酸处理的Fv/Fm值低于同一浓度苯甲酸处理,而低浓度阿魏酸处理的Fv/Fm值无显著变化,高浓度阿魏酸处理的Fv/Fm值显著降低,说明水杨酸的抑制效果最佳,苯甲酸次之,阿魏酸最差。总体而言,高浓度酚酸类化感物质均可显著降低聚球藻的Fv/Fm值,甚至降为0,但促进聚球藻生长的低浓度阿魏酸并未增加其Fv/Fm值。
2.2.4 对抗氧化酶活性的影响 由于高浓度酚酸类化感物质阻止聚球藻生长,聚球藻细胞的抗氧化酶活性无法测定,故只在促进和抑制聚球藻生长的浓度范围内研究酚酸类化感物质处理9 d时聚球藻的抗氧化酶活性。结果(表4)显示:25、30和35 mg·L-1苯甲酸处理聚球藻的超氧化物歧化酶(SOD)活性均高于对照,且随浓度升高SOD活性逐渐下降,其中,25 mg·L-1苯甲酸处理的SOD活性较对照升高53.83%,差异达显著水平。25 mg·L-1水杨酸处理的SOD活性显著高于对照,30 mg·L-1水杨酸处理的SOD活性低于对照,但差异不显著。30、40和50 mg·L-1阿魏酸处理的SOD活性高于对照,且SOD活性随阿魏酸浓度的升高而升高,分别较对照升高13.33%、49.58%和61.93%。说明同一浓度水杨酸处理对聚球藻SOD活性的影响较苯甲酸更强,且二者均强于阿魏酸。
聚球藻的过氧化物酶(POD)活性随苯甲酸浓度升高而升高,但低浓度(25和30 mg·L-1)苯甲酸处理聚球藻的POD活性与对照差异不显著,而35 mg·L-1苯甲酸处理的POD活性较对照升高24.29%,二者间差异显著。25 mg·L-1水杨酸处理的POD活性高于对照,而30 mg·L-1水杨酸处理的POD活性低于对照,但差异均不显著。随阿魏酸浓度升高,聚球藻的POD活性逐渐升高,且40和50 mg·L-1阿魏酸处理的POD活性显著高于对照。
聚球藻的过氧化氢酶(CAT)活性随苯甲酸浓度升高而升高,且30和35 mg·L-1苯甲酸处理的CAT活性显著高于对照。25 mg·L-1水杨酸处理的CAT活性较对照显著升高,30 mg·L-1水杨酸处理的CAT活性与对照差异不显著,与不同浓度水杨酸处理下聚球藻SOD和POD活性的变化趋势相似。不同浓度阿魏酸处理的CAT活性基本随其浓度的升高而升高,与SOD和POD活性变化相似,40和50 mg·L-1阿魏酸处理的CAT活性分别较对照升高55.10%和54.78%,且差异达显著水平。
比较3种酚酸类化感物质对聚球藻SOD、POD和CAT活性的影响发现,25 mg·L-1水杨酸处理聚球藻的3种抗氧化酶活性均高于同一浓度苯甲酸处理,30 mg·L-1水杨酸处理的3种抗氧化酶活性低于同一浓度苯甲酸处理。阿魏酸处理下聚球藻的3种抗氧化酶活性总体上随其浓度升高而升高。说明3种酚酸类化感物质对聚球藻抗氧化酶活性的影响仍表现为水杨酸最大,苯甲酸次之,阿魏酸最小,与酚酸类化感物质对聚球藻叶绿素a含量、Fo值和Fv/Fm值的影响以及聚球藻的生长响应相一致。
对3种酚酸类化感物质浓度与聚球藻细胞密度、叶绿素a含量、Fo值和Fv/Fm值进行曲线拟合,由于酚酸类化感物质对聚球藻的生长存在低促高抑的现象,故采用二项式进行曲线拟合。结果(表5)显示:3种酚酸类化感物质与聚球藻的上述指标间均存在较高的浓度依赖关系,R2值均在0.8以上,其中水杨酸浓度与细胞密度的曲线方程斜率较小,表明低浓度水杨酸对聚球藻生长的促进效果较弱。

表4 不同浓度酚酸类化感物质对聚球藻抗氧化酶活性的影响
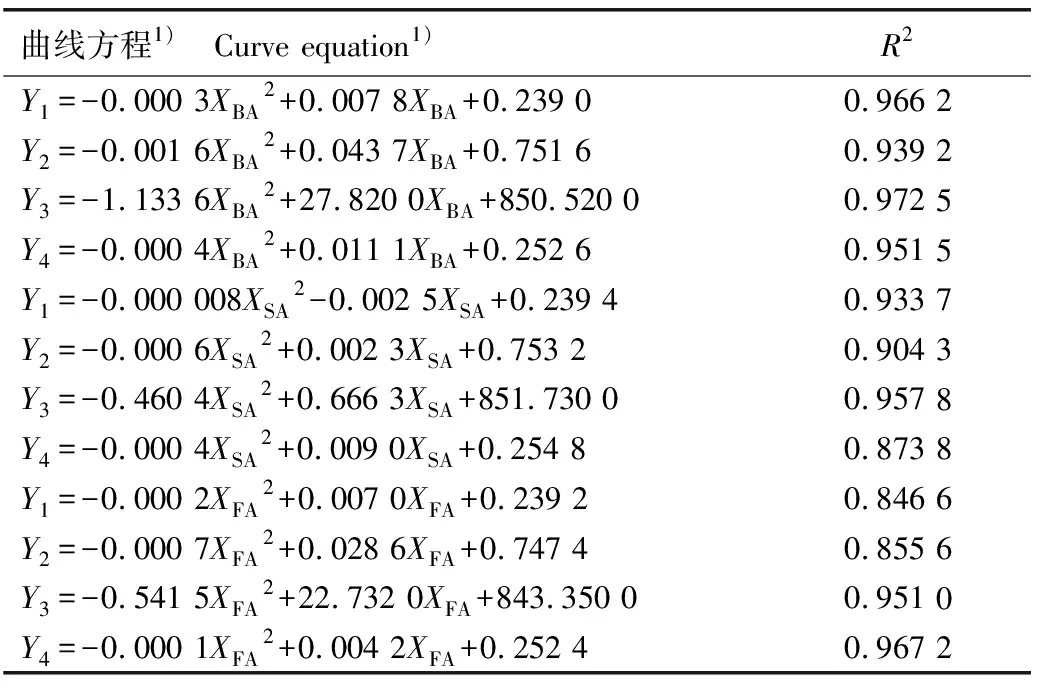
表5 不同酚酸类化感物质浓度与聚球藻部分生理指标的曲线拟合
3 讨 论
本研究中,随着处理时间的延长,25 mg·L-1苯甲酸对聚球藻的生长呈现先抑制后促进效应,而30 mg·L-1苯甲酸则显著抑制聚球藻生长;当苯甲酸浓度为35和40 mg·L-1时,可基本阻止聚球藻的生长。当水杨酸浓度为25~40 mg·L-1时,均抑制聚球藻细胞生长,且抑制效应随水杨酸浓度的升高而增强。聚球藻对阿魏酸的响应浓度较高,在30和40 mg·L-1浓度下聚球藻的生长被明显促进,而在50和60 mg·L-1浓度下其生长基本被阻止,体现为低促高抑现象,这与张庭廷等[14]对水华鱼腥藻和蛋白核小球藻的研究结果相似。3种酚酸类化感物质的抑藻效果由高至低依次为水杨酸、苯甲酸、阿魏酸。较低浓度的苯甲酸(25 mg·L-1)和阿魏酸(30和40 mg·L-1)可促进聚球藻的生长,可能是因为这2种酚酸类化感物质在低浓度下会与藻类的兴奋受体结合,促进藻细胞生长[28],还可能是低浓度酚酸类化感物质通过增加酶活性增加了细胞膜的渗透性,藻细胞更容易吸收营养物质[29]。通常认为,酚酸类物质的自氧化是其化感作用的主要机制之一,酚酸类物质自氧化会产生H2O2和醌,H2O2会造成藻细胞膜脂质过氧化,而醌经过氧化还原循环会产生活性氧,进一步影响藻细胞生长[30-32]。35 mg·L-1苯甲酸、30 mg·L-1水杨酸和50 mg·L-1阿魏酸对聚球藻生长的抑制效应在实验后期(处理9 d)出现解除和藻细胞生长恢复现象,可能是由于培养基中酚酸类化感物质浓度因藻细胞的吸收和自然降解等作用大大降低,导致抑藻效果减弱[33]。
光合作用作为初级生产者的重要生理过程,为化感物质的主要靶点之一[34]。聚球藻是一类光合自养原核生物,叶绿素是其主要的光合色素,化感物质能直接破坏藻细胞叶绿体或通过影响与叶绿素合成相关物质的活性阻碍藻类的叶绿素合成,降低藻细胞内的叶绿素含量[35-37],亦或对藻细胞中捕获和传递光能的辅助功能团色素(如藻胆蛋白和别藻蓝蛋白等)造成损害[38],间接影响藻细胞光合活性及速率,而叶绿素a含量的降低则会直接抑制藻类的繁殖和生长[39]。李锋民等[40]的研究发现,2-甲基乙酰乙酸乙酯(EMA)会降解铜绿微囊藻的叶绿素a,使其含量降低,影响铜绿微囊藻的光合作用速率。吴程等[41]研究认为,藻胆蛋白是化感物质抑制铜绿微囊藻的关键靶点之一。本研究中,30、35和40 mg·L-1苯甲酸总体显著降低聚球藻叶绿素a含量,且叶绿素a含量随苯甲酸浓度的升高而降低,而低浓度苯甲酸(25 mg·L-1)处理的聚球藻叶绿素a含量随着处理时间的延长呈逐渐升高的趋势。然而,25、30、35和40 mg·L-1水杨酸均可显著降低聚球藻叶绿素a含量。阿魏酸对聚球藻叶绿素a含量的影响与其对聚球藻生长的影响基本一致,呈低促高抑的现象。总体上看,聚球藻叶绿素a的含量对酚酸类化感物质的响应与其生长响应相似,表明高浓度酚酸类化感物质会阻碍叶绿素a合成或破坏叶绿体,影响藻胆蛋白等辅助功能团色素,从而抑制生长、减少生物量。值得注意的是,35和40 mg·L-1苯甲酸、30 mg·L-1水杨酸以及50和60 mg·L-1阿魏酸处理下的叶绿素a含量在实验后期回升,说明叶绿素a的合成受阻情况随培养基中酚酸类化感物质浓度的降低而减弱。
叶绿素荧光参数中初始荧光(Fo)是PSⅡ反应中心完全开放时的荧光产量,而PSⅡ最大光化学效率(Fv/Fm)代表藻类的潜在光合能力,反映PSⅡ在胁迫条件下的功能状态变化[18,27,42]。Fv/Fm值在外部环境胁迫下显著降低,说明环境胁迫会对PSⅡ造成损害[43]。Zhao等[44]研究认为,桉树(Eucalyptusgrandis×E.urophylla‘GLGU9’)叶的高浓度提取物处理铜绿微囊藻3 d后,铜绿微囊藻的Fv/Fm值显著降低。Zhu等[45]研究发现,穗状狐尾藻的分泌物焦碚酸和没食子酸会造成铜绿微囊藻叶绿素a含量下降,且抑制PSⅡ的活性,阻断电子在PSⅡ与PSⅠ之间的传递。Wang等[46]研究认为,3.47和5.17 mmol·L-1阿魏酸可完全抑制铜绿微囊藻的光合能力。本研究中,苯甲酸和阿魏酸对Fo值的影响呈低促高抑现象,而不同浓度水杨酸处理均显著降低聚球藻的Fo值,3种酚酸类化感物质浓度较高(35和40 mg·L-1苯甲酸、35和40 mg·L-1水杨酸以及50和60 mg·L-1阿魏酸)时聚球藻的Fv/Fm值显著降低。说明高浓度酚酸类化感物质会造成聚球藻光系统反应中心的损坏,导致其光系统活性受到抑制或破坏。另一方面,3种酚酸类化感物质在高浓度处理后期聚球藻的Fo值均出现不同程度回升,与生长响应和叶绿素a含量的变化相符合。
抗氧化酶活性的变化可反映藻细胞所受外界环境胁迫程度[47-49],当藻类受到外界环境胁迫时,抗氧化酶活性随活性氧的增加而升高,当活性氧积累过量时则下降,且对胞内物质造成氧化损伤[50-53]。酚酸类物质自氧化还会产生H2O2和醌,进一步造成活性氧的升高,破坏藻细胞内的结构与生物大分子[54]。张庭廷等[15]研究认为,酚酸类物质的自氧化是抑制铜绿微囊藻和蛋白核小球藻的主要机制之一。高浓度酚酸类物质可能直接导致抗氧化酶系统崩溃,进而阻止铜绿微囊藻的生长[55]。Hua等[4]发现,铜绿微囊藻的抗氧化酶活性在暴露于稻草水提物后呈浓度依赖性,且随着时间推移先升高后降低。李锋民等[40]和Hong等[49]研究发现,铜绿微囊藻细胞的抗氧化酶活性随着化感物质浓度升高呈现先升高至峰值后降低的趋势。花铭等[56]研究认为,邻苯三酚和咖啡酸能显著抑制铜绿微囊藻的SOD活性。本研究中,聚球藻的SOD活性随苯甲酸浓度的升高而降低,但均高于对照(不添加酚酸类化感物质),苯甲酸处理的CAT活性高于阿魏酸处理;SOD、POD和CAT活性均随水杨酸浓度的升高而降低,说明高浓度水杨酸处理的活性氧积累过量,影响抗氧化酶功能。然而,阿魏酸处理聚球藻的SOD、POD和CAT活性总体呈现随浓度升高而升高的趋势,其中50 mg·L-1阿魏酸处理的3个抗氧化酶活性仍较对照显著升高,并未出现下降,未造成抗氧化酶功能的破坏,进一步的研究发现,50 mg·L-1阿魏酸是通过抑制聚球藻细胞分裂而抑制其生长。总体上看,聚球藻抗氧化酶体系对3种酚酸类化感物质的敏感程度由高到低依次为水杨酸、苯甲酸、阿魏酸。
化感物质胁迫会造成藻细胞膜完整性下降,细胞内容物大量渗出[57],抑制藻类生长,最终导致死亡,因此,细胞膜是化感物质抑藻的主要部位之一。臭椿〔Ailanthusaltissima(Mill.) Swingle〕提取物和稻草水提物可引起铜绿微囊藻形态的明显改变以及细胞破裂和内容物外泄[4,58]。酚酸类物质自氧化产生的H2O2和醌还会进一步造成细胞膜的损伤和通透性增加[30]。李锋民等[59]研究发现,EMA会造成铜绿微囊藻和蛋白核小球藻的细胞膜破裂和内容物渗出,细胞内结构遭到破坏和解体。张庭廷等[17]研究发现,对羟基苯甲酸会造成铜绿微囊藻细胞膜的破裂和溶解,且破碎藻细胞会出现絮凝现象。本研究中,在酚酸类化感物质胁迫下,聚球藻细胞膜破裂,细胞周围出现大量的絮状物为外渗的内容物或吸附的添加物,藻细胞还出现聚团现象,因此对细胞膜的破坏和通透性的改变,也是酚酸类化感物质抑藻的机制之一。
4 结论和展望
本研究中,酚酸类化感物质对聚球藻的生长抑制效应由高至低依次为水杨酸、苯甲酸、阿魏酸。3种酚酸类化感物质一方面可通过阻碍聚球藻叶绿素a合成和抑制PSⅡ活性来抑制藻细胞的繁殖生长,另一方面可通过减少细胞分裂、破裂细胞膜、增加胞外絮状分泌物等途径抑制或阻止藻细胞的繁殖。聚球藻抗氧化酶体系对3种酚酸类化感物质的敏感程度与其生长抑制效应一致,但不同的抗氧化酶(SOD、POD和CAT)对不同种类和浓度的酚酸类化感物质的响应存在差异,其中,SOD活性随苯甲酸和水杨酸浓度的升高而降低,POD和CAT活性却随苯甲酸浓度的升高而升高,随水杨酸浓度的升高而降低,而SOD、POD和CAT活性基本随阿魏酸浓度的升高而升高,这一方面可能与处理时间有关,由于实验后期(处理6~9 d)化感效应减弱,聚球藻恢复生长,从而导致不同抗氧化酶活性的变化,另一方面也可能与不同抗氧化酶的基因或蛋白质表达以及相关调控因子有关,具体原因有待进一步的研究。
