基于SSR标记的大花序桉全同胞子代鉴定
2021-11-02吕佳斌翁启杰李发根李昌荣陈健波陈剑成甘四明
吕佳斌,翁启杰,李发根,李 梅,李昌荣,陈健波,陈剑成,甘四明,
(1.中国林业科学研究院 热带林业研究所,热带林业研究国家林业局重点实验室,广东 广州 510520;2.南京林业大学,江苏 南京 210037;3.广西壮族自治区林业科学研究院 a.广西优良用材林资源培育重点实验室;b.中南速生材繁育国家林业局重点实验室,广西 南宁 530002;4.玉林市林业科学研究所,广西 容县 537501)
分子标记技术为父本鉴定提供了快捷有效的工具。其中,简单序列重复(Simple sequence repeat,SSR,又称微卫星)标记是基于2~6 个碱基单元、通过重复数量的变异而形成DNA 片段长度的多态性[6-7]。其具有共显性、基因组中分布广泛、多态性高、重复性好和检测方法灵活等优点[8],已广泛用于群体遗传多样性分析[9]、核心种质构建[10]、品种指纹图谱构建[11]、亲子关系鉴定[10]及谱系分析和标记辅助育种[13]等研究。目前,利用SSR 分子标记技术已在尾叶桉[4]、巨桉Eucalyptus grandisHill ex Maiden[14]、蓝灰麻利Eucalyptus caesiaBenth.[15]、美洲黑杨Populusdeltoides(Bartr.)Marsh.[16]、木荷Schima superbaGardn.et Champ.[17]、马尾松Pinus massonianaLamb.[18]、日本落叶松Larix kaempferi(Lamb.) Carr.[19]和西美落叶松[5]等树种中进行了全同胞子代的父本鉴定。此外,Brondani 等[20]、He 等[21]和Zhou 等[22]已经开发了桉属EucalyptusL’Hérit.树种(简称桉树)的大量SSR 标记,为桉树子代的父本鉴定提供了丰富的标记资源。
大花序桉Eucalyptus cloezianaF.Muell.是桉属昆士兰桉亚属IdiogenesL.D.Pryor &L.A.S.Johnson ex Brooker 的唯一树种[23]。其木材硬度高、结构均匀、纹理通直且沉重耐久,是优良的实木用材树种,广泛用于建筑、家具、坑木和矿柱等[24]。本研究利用前期优化的12 个可多重检测的SSR 标记,对1 株母本自由授粉的2 184 株子代苗进行了父本鉴定,旨在为基于全同胞子代群体的遗传分析提供基础材料。
1 材料与方法
1.1 植物材料和DNA 提取
从14年生的大花序桉种源/家系试验林中采集优树5-018 的蒴果,晾晒后获得种子。该试验林于2004年5月建立,位于广西壮族自治区玉林市林业科学研究所(110°09′E,22°39′N),包括17 个种源115 个家系,该试验地为亚热带季风气候,年平均降水量为1 582 mm,年平均气温为21.8℃,并沿等高线方向以随机整块形式进行排列,行间距为2.0 m×3.5 m[25]。2018年11月初利用获得的种子在中国林业科学研究院热带林业研究所苗圃育苗,于2018年12月中旬移植到营养袋中,2019年4月底采集幼苗嫩叶并于-80℃超低温冰箱保存备用,共计2 184 株;同时,利用卷尺测量苗期株高。此外,试验林保留的其他706 株大树作为候选父本,已经开展了SSR 标记实验,具体见前期报道[26]。
嫩叶DNA 提取采用新型植物基因组DNA 提取试剂盒(深圳市艾伟迪生物科技有限公司),具体操作参照厂家提供的说明书,所得DNA 采用1.2%琼脂糖凝胶电泳检测完整性,利用NanoDrop 2000(美国Thermo Scientific)测定DNA 的浓度和纯度,并稀释至5 ng/μL 备用,存放于-20℃冰箱备用。
1.2 SSR-PCR 多重扩增及毛细管电泳检测
利用Brondani 等[20]、He 等[21]和Zhou 等[22]前期报道的12 个SSR 标记(表1),包括4 个前缀为EMBRA 的基因组SSRs[20]和8 个前缀为EUCeSSR 的表达序列标签(Expressed sequence tag,EST)SSRs[21-22],SSR 引物送至英潍捷基(上海)贸易有限公司合成,前向引物5′端进行HEX、6-FAM、ROX 或TAM 荧光修饰。基于前期优化的多重检测体系[26],对所有样品进行分型检测。聚合酶链式反应(Polymerase chain reaction,PCR)体系为10 μL,包括1.0 μL 10×buffer(100 mM Tris-HCl pH 9.0、100 mM KCl、80 mM (NH4)2SO4、0.5% NP-40 和20 mM MgCl2)、200 μM dNTP、正向和反向引物各0.13~0.50 μM[26]、1 U Taq DNA 聚合酶(上海博乐生物技术有限公司)和5 ng DNA。PCR 程序为:94℃预变性4 min;94℃变性30 s,56、58 或者60℃退火30 s,72℃延伸50 s,35 个循环;最后72℃延伸5 min。特别地,EMBRA332 标记采用降落PCR 程序:94℃预变性4 min;94℃变性30 s,60~70℃退火30 s、每个循环降低0.5℃,72℃延伸50 s,21 个循环;94℃变性30 s,60℃退火30 s,72℃延伸50 s,25个循环;72℃延伸5 min。
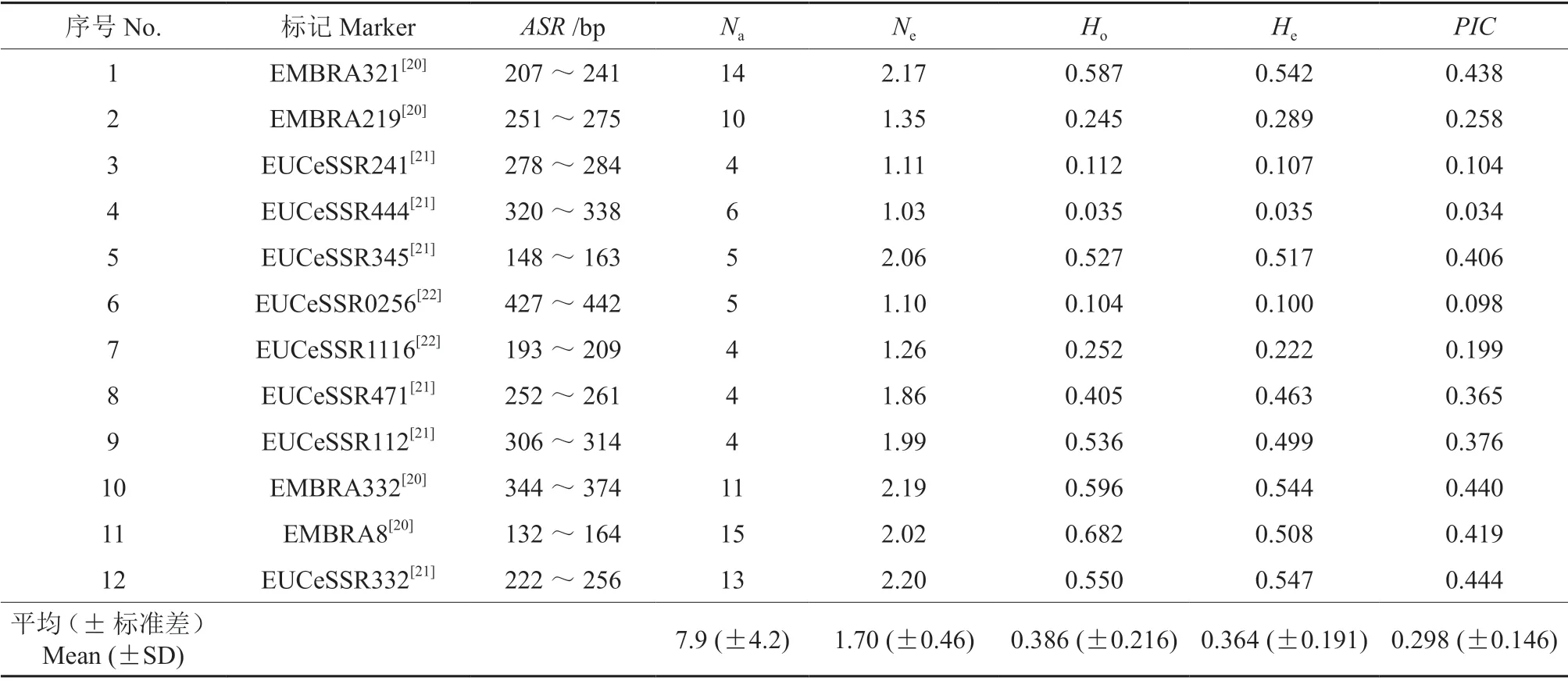
表1 参试12 个SSR 标记及其多样性参数†Table 1 Twelve SSR markers included and their polymorphism parameters
PCR 产物(0.25~1.0 mL)[26]加入9.34 μL超纯甲酰胺和0.16 μL GeneScan 500 LIZ 内标(美国Applied Biosystems)稀释,经95℃变性5 min,迅速冰上冷却。SSR 标记在ABI 3130xl 遗传分析仪(Applied Biosystems)上进行分型,参照测序仪操作手册,利用软件GeneMapper 4.1(Applied Biosystems)进行数据收集。
1.3 数据分析
桉属树种一般为二倍体[27],即一个子代在某个SSR 标记上最多有两条等位片段,一条来自母本、另一条来自父本。在本研究中,母本为已知的优树5-018,则需要鉴定的是单个子代中非母本的等位片段可能的父本来源。利用软件CERVUS 3.0[28]和已知母本的模型[12],基于最大似然法估算概率的对数(Logarithm of odds,LOD),设置10 000次模拟循环,候选父本取样比例和不匹配的标记位点比率分别设为0.8 和0.01,其中,LOD 值为负,则表明雄性样品为随机样本,并非测试的真实父本,LOD 值为正,则表明雄性样品是检测子代的真实父本的可能性大于随机样品,LOD 值越大,为真实父本的可能性也越大[29]。具有最大LOD 值的候选父本即为真实父本,同一父本的所有子代即为全同胞子代(或称全同胞家系)。
基于软件Joinmap 4[30-31]中的“CP”(Cross pollinator)模型要求,利用软件Excel 2013 将各标记的等位片段长度数据转换成对应的数据编码,无扩增或扩增不清晰的标记记为“-”。该模型考虑了共显性标记的所有亲本组合类型,避免将F1群体的标记数据按照拟测交的策略只进行1∶1 分离类型的计算,提高了分离类型检测的有效性[32]。利用Joinmap 4[30-31]对所有标记进行孟德尔期望分离比的检测,方法为卡方检验。
利用软件GenAlEx v6.5[33-34]计算等位片段数(Number of alleles,Na)、有效等位片段数(Number of effective alleles,Ne)和等位片段范围(allelic size range,ASR)等位点参数。利用软件CERVUS 3.0[28]计算观测杂合度(Observed heterozygosity,Ho)、期望杂合度(Expected heterozygosity,He)和多态性信息量(Polymorphic information content,PIC)等多样性参数。
为避免人造金红石产品发生粉化,20世纪80年代,长沙矿冶研究院对原有工艺进行改进,自主研发了预氧化- 流态化常压浸出工艺[6]。该工艺是将钛铁矿在回转窑中进行低温(750 ℃左右)预氧化焙烧,使其颗粒表面结构发生改变,并生成FeTiO3-Fe2O3固溶体和金红石微晶,冷却后加入流态化浸出塔中,用稀盐酸三段逆流浸出,再经洗涤、过滤和煅烧制得人造金红石。并于1982年在重庆天原化工厂建设了5 000 t/a中试线[7]。其关键创新点在于采用适度氧化焙烧与流态化浸出设备多段浸出相结合,有效解决了酸浸过程中的粉化问题,但仍未实现盐酸的再生和循环使用。
利用软件Excel 2013 进行全同胞家系苗高均值和变异系数的计算。利用软件SPSS 进行t检验以检测近交家系与异交家系的多样性参数是否存在差异显著(P≤0.01),并计算全同胞家系Ho和He与苗高均值和变异系数的Pearson 相关系数。
2 结果与分析
2.1 SSR 标记的有效扩增和多样性参数
12 个SSR 标记对优树5-018 的自由授粉子代均能有效扩增和分型检测,图1显示了标记EUCeSSR345 对母本5-018、候选父本16-057 和8株子代的等位片段分型结果。表1列出了标记的多样性参数,共获得138 个等位片段,其中,单个标记的Na最低为4,最高为15,平均为7.9;Ne最低为1.03,最高为2.20,平均为1.70;Ho最低为0.035,最高为0.682,平均为0.386;He最低为0.035,最高为0.547,平均为0.364;PIC最低为0.034,最高为0.444,平均为0.298。
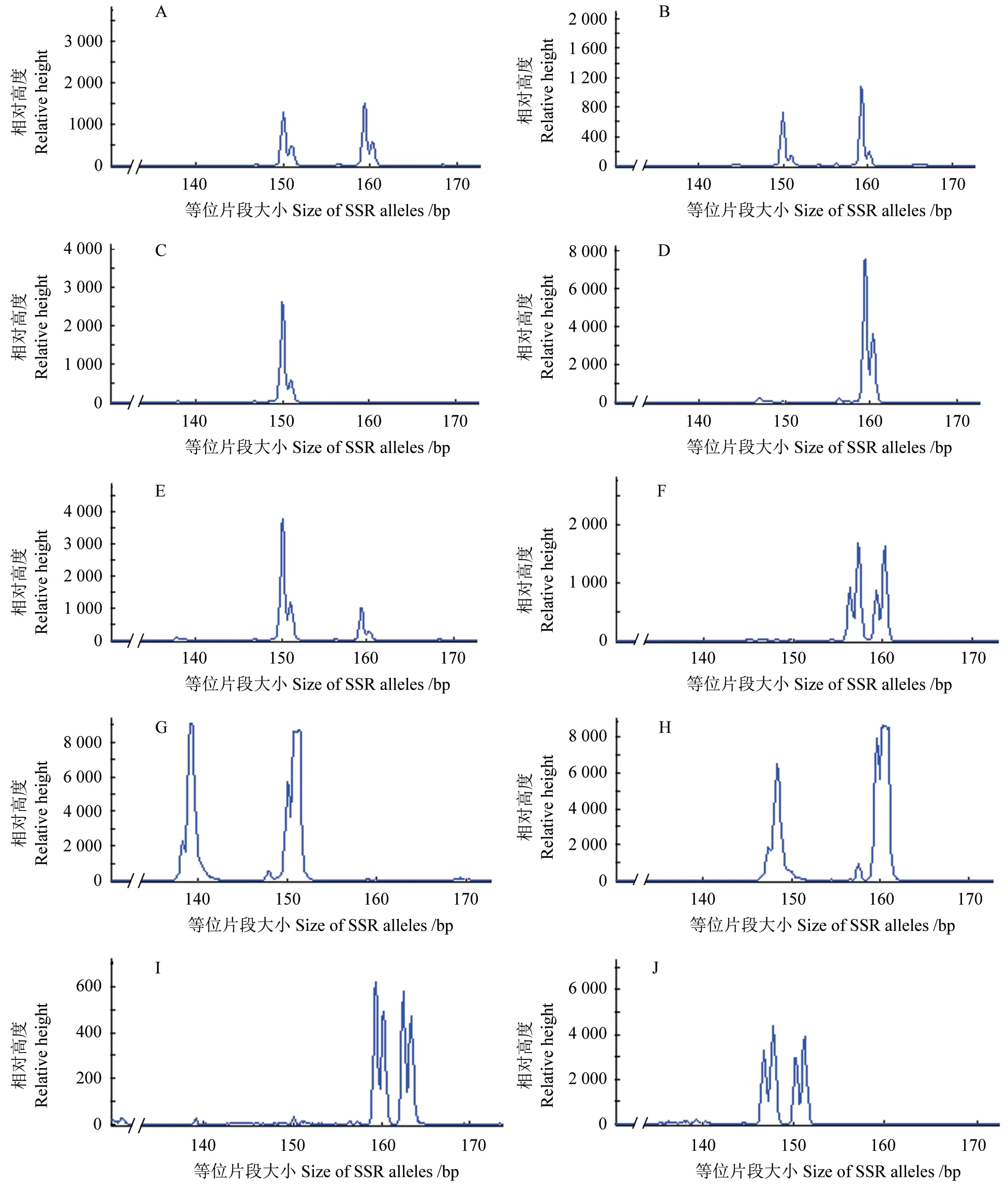
图1 标记EUCeSSR345 对母本、候选父本和8 株子代的分型检测Fig.1 Allelic genotyping with EUCeSSR345 against maternal and candidate paternal parents as well as eight sibs
2.2 父本鉴定
优树5-018 的2 184 株自由授粉子代中,1 697株明确了父本来源(表2),鉴定率为77.7%,而487 株因LOD 较低或者位点缺失较多,不能确定父本,占22.3%。其中子代130 株以上的主要父本有6 个,包括10-039、5-021、16-057、50-293、16-059 和5-017,单个父本的子代数量为138~395 个。其中,5-021 和5-017 与母本5-018来自同一个半同胞家系,其子代为近交子代,相应全同胞家系为近交家系。此外,父本107-646 有19 株子代,另外131 个父本共产生了244 株子代、单个父本的子代数量为1~9 株(数据未列示)。同时,为进一步验证大花序桉种子园的自交情况,也将5-018 作为父本进行了分析,未发现母本的自交子代,表明大花序桉自交的可能性极低。
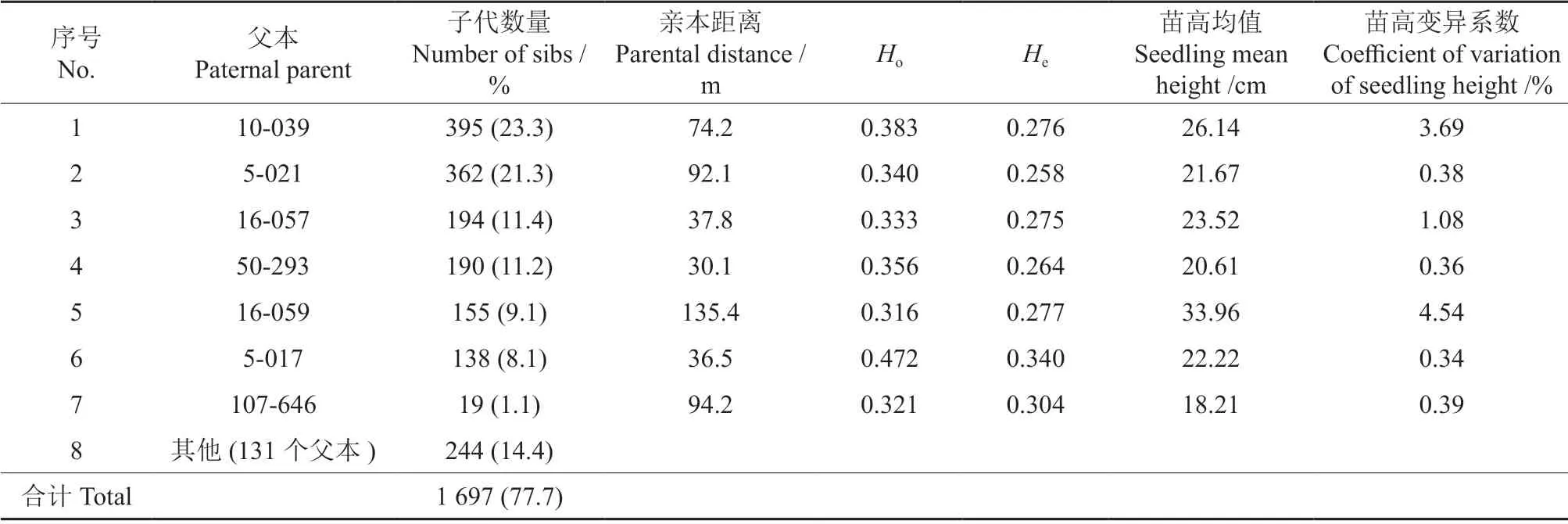
表2 鉴定的父本和子代数量及全同胞家系的多样性参数和平均苗高†Table 2 Paternal parents,their sib numbers,and full-sib family derived heterozygosity and seedling mean height
基于试验林种植图的父本与母本的距离,分析大花序桉花粉散布规律,可推测花粉传播的距离。图2显示了父本的距离及其子代数量,可见大花序桉花粉散布的距离较远,可达160 m,但主要范围在100 m,在此距离范围内,共产生了1 436 株子代,占已确定父本子代数量的84.6%,而在100~160 m 内仅277 株子代,占15.4%,这进一步表明100 m 之外大花序桉父本仍然可以为母本提供花粉,但随着距离的增加、产生子代的数量明显减少。特别地,父本16-059 距离母树达135 m,但全同胞子代数量仍有155 株,图1也显示了标记EUCeSSR345 对父本16-057 的3 株子代和5 株非亲子代的分型结果。
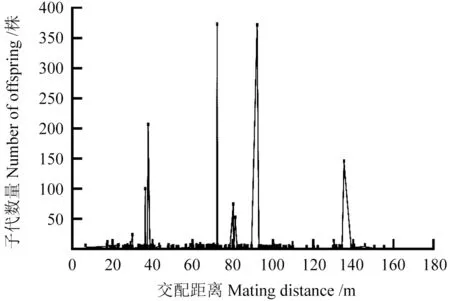
图2 父本与母本的距离及子代数量Fig.2 Parental distance and number of full-sibs
2.3 全同胞家系的标记偏分离分析
对子代数量10株以上的7个全同胞家系(表3)的12 个标记进行卡方检验,结果表明,各标记在不同家系中均存在不同程度的偏离期望的孟德尔分离比例,每个家系偏分离标记的数量从2~9个不等(P≤0.05),平均为6.1 个。父本10-039的全同胞家系中,标记EMBRA8 的χ2值高达308.62,严重偏分离。此外,标记EUCeSSR444、EUCeSSR0256、EUCeSSR241 和EUCeSSR1116 标记在多个全同胞家系中均存在无分离类型的现象。
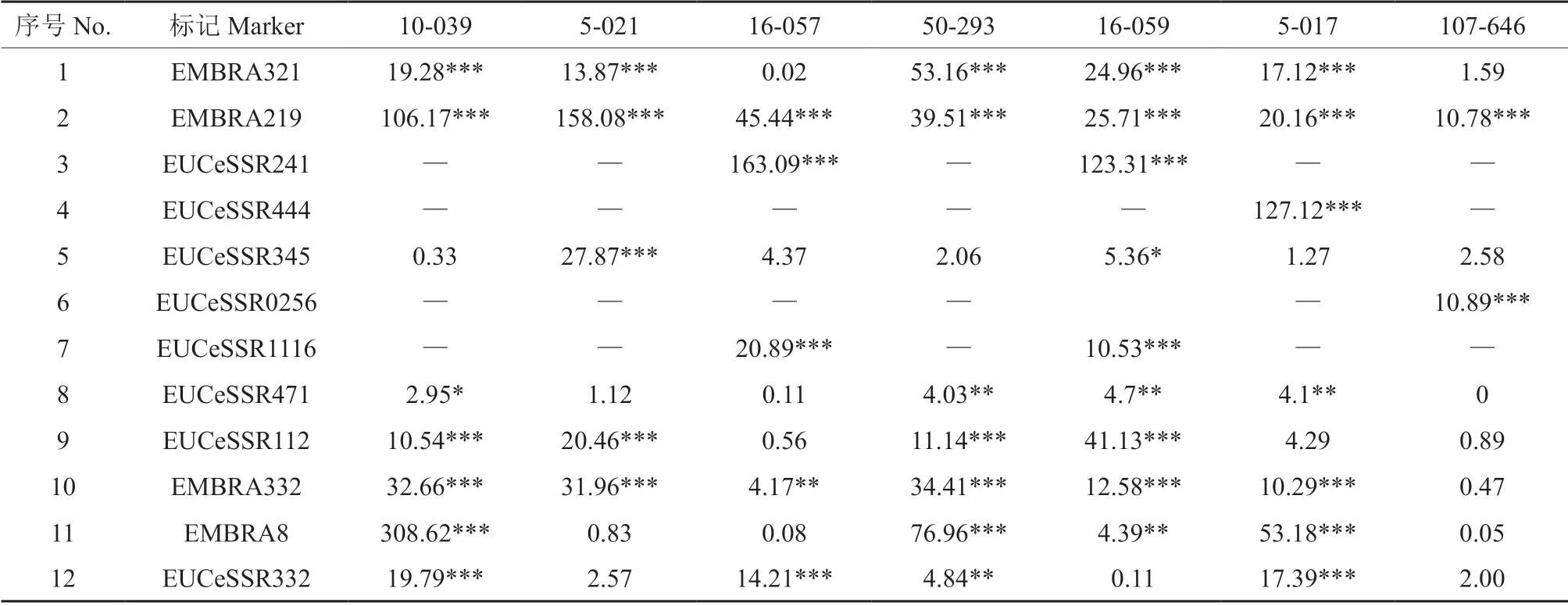
表3 SSR 标记在相应父本的全同胞家系中分离比的卡方检验†Table 3 χ2 test for marker segregation within each full-sib family with paternal parent identified
2.4 全同胞家系的多样性及其与苗高生长的相关
对于子代数量10 株以上的7 个全同胞家系(表2),多样性参数均较低,如Ho为0.316~0.472、He为0.258~0.340,杂合度最高的家系是父本为5-017 的近交家系。t检验也表明,异交家系与近交家系的Ho(t=0.227,P=0.822)和He(t=0.139,P=0.891)均无显著差别。
这7 个全同胞家系4月生苗高的平均为18.21~33.96 cm,变异系数介于0.34~4.54%(表2)。Ho和He与平均苗高的相关系数分别为–0.173(P=0.710)和–0.194(P=0.677),与苗高变异系数的相关系数分别为–0.226(P=0.626)和–0.232(P=0.617),均无显著相关性。
3 结论与讨论
本研究对大花序桉1 株母本的2 184 株自由授粉子代进行了父本鉴定,共有1 697 株(77.7%)子代确定了父本(花粉)来源。鉴定的比例高于木荷[17](61.9%)和马尾松[18](72.5%),但低于美洲黑杨[16](97.9%)、蓝灰麻利[15](92.4%)和日本落叶松[19](93.7%)。父本鉴定的子代比例与多种因素有关,如引物数量与多态性、外来花粉污染和候选父本数量等。一般认为,3~6 个共显性标记足以进行异交群体的分型鉴定[35-36],本研究所用的12个共显性SSR标记在数量上是足够的,也具有较高的多态性[26],子代鉴定的有效性应较高。大花序桉为昆士兰桉亚属唯一种,不会与其他种杂交,将采集的试验林附近的桉树人工林和行道树(主要是无性系DH32-29 和广9)20 株纳入分析、也未发现有授粉(数据未列示),并且试验林周围没有其他大花序桉林分,因此不存在外来花粉污染的可能性。候选父本数量上,一般认为超过100 时父本产生相同配子基因型的概率较高[37]而降低鉴定的有效性。本研究707 株候选父本且LOD 阈值较高,这在一定程度上影响了鉴定的子代比例;更为重要的是,大花序桉的蒴果可在母树上留存3年,少数授粉父本可能在取样时因多种原因死亡,因此无从追查父本来源,从而降低了鉴定比例。
SSR 位点变异也可能影响鉴定的有效性。在亲子遗传中,少数子代存在SSR 重复单元数的增减而产生非亲等位片段的现象[38-39],影响鉴定的准确性。例如,Moriya 等[40]发现苹果Malus×domesticaBorkh.子代SSR 突变是因为SSR 重复单元数的增加,而两端的序列(包括引物结合序列)没有发生变化。
等位基因的偏分离作为生物进化的动力之一[41],可以增加群体中杂合等位基因或者异型染色体的频率,是生物界普遍存在的一种现象,特别是共显性标记。目前,造成偏分离的原因尚不清晰,一般认为造成偏分离的原因与遗传分离机制[42]、染色体缺失[43]、花粉选择以及隐性致死等位基因遗传负荷表达[44]等一系列因素有关,以上几种造成基因偏分离现象的出现均是由于染色体的某些位置的重组率下降或者不发生重组造成的[45]。
大花序桉的授粉并非随机的,而是遵从较近距离花粉优先的原则[46],散布范围主要集中在100 m 以内。随着父本与母本距离的增大,授粉率逐渐降低,这与花粉流的强度随父本距离增加而降低有关[47]。这也与Chaix 等[14],Bezemer 等[15]和Eldridge 等[48]报道的桉树研究结果相似。
本研究利用前期优化的12 个可多重检测的SSR 标记,对大花序桉1 株母本的2 184 株自由授粉子代进行了父本鉴定,获得了6 个130 株以上的全同胞家系,本研究的结果可以为大花序桉进一步分析研究奠定材料基础,如遗传资源测定、遗传图谱构建和数量性状位点定位等研究。
