长江三角洲白山羊保种群体的SSR遗传多样性分析
2021-11-02李丹阳孙玲伟吴彩凤张树山张德福戴建军
李丹阳,孙玲伟,吴彩凤,张树山,张德福*,戴建军*
(1.上海海洋大学水产与生命学院,上海 201306;2.上海市农业科学院畜牧兽医研究所,上海市农业遗传育种动物遗传工程研究室,上海 201106)
长江三角洲白山羊,又称海门山羊,是长江三角洲地区主要山羊品种之一,是我国珍贵的少有的皮、肉、毛兼优的山羊品种[1]。其羊毛洁白、弯曲少、具光泽,常用于制笔,有“笔料毛山羊”之称;肉质细嫩、膻味小、脂肪分布均匀、味道鲜美;皮质致密、柔韧,为革皮原料。崇明白山羊属于长江三角洲白山羊的一个分支,在上海崇明岛特定水土条件下孕育而成。现如今,长江三角洲地区白山羊绝大部分为杂交群体,纯种海门山羊和崇明白山羊的饲养仅限于个别保种场内,因此对该品种的种质资源保护和利用提出了严峻的挑战。
物种或居群的遗传多样性大小是长期进化的产物,是其生存适应和发展进化的前提[2]。目前评估遗传多样性的分子标记遗传方法有多种,包括微卫星标记(simple sequence repeat,SSR)[3]、MHC区域突变[4]、单核苷酸多态性(single nucleotide polymorphisms,SNP)[5]、线粒体DNA[6]等。微卫星标记具有数量多、基因组内分布广、多态性丰富、呈孟德尔共显性遗传、检测快速方便等特点,广泛用于分析生物遗传多样性和群体遗传结构。
本研究选取30个微卫星位点,分析长江三角洲地区两个纯种白山羊保种群体(海门山羊和崇明白山羊)和一个杂交群体的遗传多样性和群体结构,为长江三角洲白山羊群体的种质资源保存、杂交利用和品种选育作数据支撑,为保护其特定良好基因提供理论依据。保护白山羊遗传多样性还可以保证育种生产能对环境、疾病和市场需求的变化做出及时和有效的反应。
1 材料与方法
1.1 试验材料
1.1.1试验样品 供试海门山羊(Haimen goat,HM)和崇明白山羊(Chongming goat,CM)分别来源于江苏金盛山羊繁育技术发展有限公司和上海崇明园都畜牧养殖有限公司,崇明本地杂交白山羊(hybrid white goat,ZY)的血液样品来源于上海崇明岛山羊养殖户。因选择群体的纯种白山羊饲养规模较小,根据公羊采样规模不低于10%的要求(NY/T1673—2008)[7]并结合相关研究进展[8-10],每个群体选取样本30只,其中公羊10只,母羊20只,抽取EDTA-K2抗凝血样3 mL用于后续微卫星检测。
1.1.2主要试剂 血液基因组DNA提取试剂盒购自天根生化科技有限公司,ROX500内标购自克劳宁(北京)生物科技有限公司,引物由通用生物系统有限公司合成。
1.2 方法
1.2.1微卫星位点的引物设计 使用联合国粮农组织(FAO)及国际遗传学会(ISAG)的推荐和中华人民共和国农业行业标准[7]所规定的30个微卫星位点,合成荧光标记微卫星引物(表1)。

续表 Continued序号Number位点名称Locus染色体位置Chromosome position引物序列Primer sequence(5′-3′)退火温度Annealing temperature/℃等位基因大小Allele size/bp P26INRABERN185CHI18CAATCTTGCTCCCACTATGCCTCCTAAAACACTCCCACACTA55261~289P27BM6444BTA2CTCTGGGTACAACACTGAGTCCTAGAGAGTTTCCCTGTCCATCC65118~200P28P19(DYA)AACACCATCAAACAGTAAGAGCATAGTAACAGATCTTCCTACA55160~196P29TCRVB6BTA10GAGTCCTCAGCAAGCAGGTCCCAGGAATTGGATCACACCT55217~255P30DRBP1BTA23ATGGTGCAGCAGCAAGGTGAGCAGGGACTCAGTCTCTCTATCTCTTTG58195~229
1.2.2PCR 扩增 利用血液基因组DNA提取试剂盒提取基因组DNA,以此为模板进行扩增。反应体系20 μL:DNA 5 μL,10×Buffer 1.5 μL,dNTPs(10 mmol·L-1)0.4 μL,引物(10 μmol·L-1)各1 μL,Taq酶0.4 μL,ddH2O 10.7 μL。PCR扩增反应条件:94 ℃预变性3 min;94 ℃变性15 s,55 ℃退火15 s,72 ℃延伸30 s,共35个循环;最终72 ℃延伸3 min,4 ℃保存。
1.2.3毛细管电泳 将产物稀释10倍,与ROX500内标0.25 μL和超纯去离子甲酰胺12.5 μL,混匀,95 ℃ 5 min,冰浴3 min,利用ABI3730测序仪进行毛细管电泳检测。
1.2.4数据统计分析 利用Popgene 3.4进行数据分析,包括观测杂合度(observed heterozygosity,Ho)、期望杂合度(expected heterozygosity,He)、等位基因数目(number of alleles,Na)、有效等位基因数(effective number of alleles,Ne)、Shannon指数(I)、Hard-Weinberg平衡(HWE)等指标,通过PIC-Cale软件分析多态信息含量(polymorphism information contents,PIC)。
使用FSTAT 2.9.3.2评估F-统计量(Fit和Fst)、基因流(Nm)。利用R 3.2.1(https://cran.r-project.org/bin/windows/base)对群体间遗传分化的主成分进行分析,通过Dispan软件分析各群体间Nei’s遗传距离和相似系数,同时利用MEGA 4.0软件构建群体间UPGMA系统发育树。
2 结果与分析
2.1 三个山羊群体等位基因频率分析
从三个山羊群体的30个微卫星位点的等位基因频率(图1)可以看出,三个群体在所检测到的等位基因中基因频率低的所占比例高,高频率所占比例低,符合L形态分布。其中CM最低基因频率为0.016 7,占17%,而最高频率为0.983 3;HM最低频率为0.020 0,占17%,最高频率为0.92;ZY最低频率为0.006 8,占9%,最高频率为0.924 7。
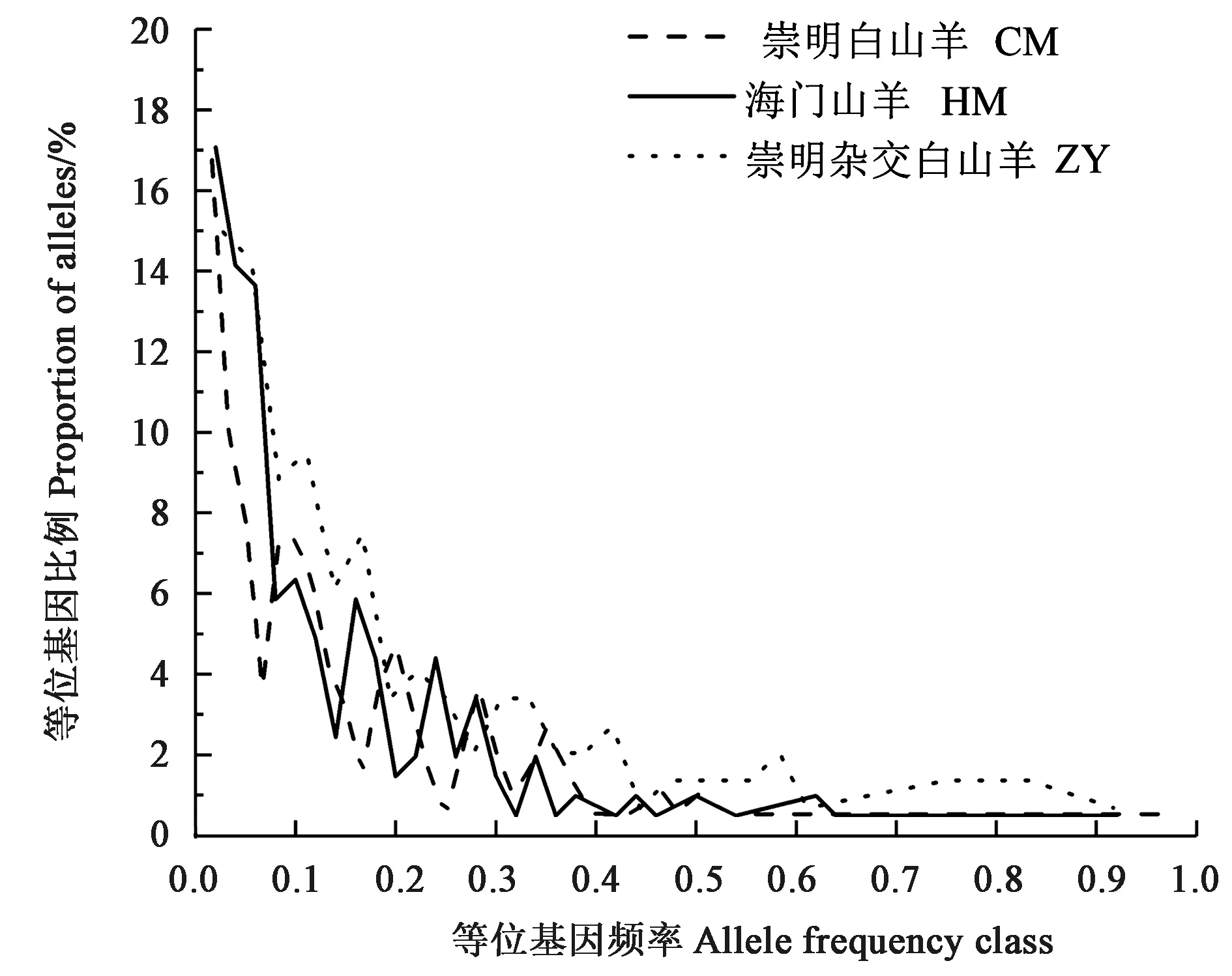
图1 三个群体的等位基因频率分布Fig.1 Allele frequency distribution of the three populations
2.2 三个山羊群体在30个微卫星位点遗传多样性分析
由表2可知,30个微卫星位点在CM群体上的等位基因数(Na)为2(INRABERN185)~12(BM6444)个,累计等位基因数191个;HM群体的等位基因数为3(MAF209等)~13(BM6444)个,累计205个;ZY群体的等位基因数范围为2(ETH10、MAF209)~9(BM6444)个,累计147个。部分位点出现期望杂合度小于观测杂合度(Ho 表2 三个群体在30个微卫星位点遗传多样性分析Table 2 Genetic diversity indices at 30 microsatellite locus in the three goat populations 由表3可知,有效等位基因数(Ne)HM>CM>ZY,分别为4.012、3.812、3.092。观察杂合度(Ho)均值CM为0.726、HM为0.691、ZY为0.633,期望杂合度(He)CM为0.668、HM为0.683、ZY为0.617,Ho均大于He。I值均大于1(CM>ZY>HM)。CM群体的PIC均值为0.630、HM为0.647、ZY为0.567,都大于0.5,为高度多态。总体上处于H-W平衡,均高于0.05,可以保持其大小和相对应的等位基因频率稳定。两个纯种白山羊群体和杂交繁育群体均表现出较高的杂合度,高度多态性和较高的遗传变异程度。 表3 三个群体遗传变异结果Table 3 Genetic variation results of three populations 表4统计结果显示,三个山羊群体的总群体近交系数(Fit)为0.011 0,近交繁殖率低。平均基因流(Nm)为4.680 6。平均群体间基因分化系数(Fst)为0.050 7,处于0.05~0.15之间,5.07%的遗传变异由于群体间引起的,而94.93%遗传变异分布于群体内,遗传分化程度中等,存在基因交流。 表4 30个微卫星位点F-统计量分析Table 4 Results of F-statistics for each of 30 markers 由表5可知,三个地方山羊群体中崇明白山羊和崇明杂交山羊相似系数最大(0.909 2)、遗传距离最近(0.095 2);海门山羊和崇明杂交山羊相似系数较小(0.811 8),遗传距离较远(0.208 5)。基于等位基因频率对三个山羊群体进行主成分分析(图2),崇明白山羊与崇明杂交山羊空间坐标距离较近,具有相似的主要成分。依据遗传相似系数对这三个群体进行聚类分析(图3),结果亦与表5结果一致,与主成分分析相似。 表5 三个地方山羊群体的Nei’s遗传距离和相似系数Table 5 Nei’s genetic distance and genetic similar index among three local goat populations 图3 三个山羊群体UPGMA聚类分析Fig.3 Dendrogram of three goad population relationship using DA-UPGMA 利用30个微卫星位点,崇明白山羊、海门山羊和崇明杂交白山羊群体得到等位基因数分别为191、205和147个,有效等位基因数分别为3.812、4.012和3.092个,说明群体遗传变异较大,遗传多样性丰富。王兰萍等[11]对长江三角洲白山羊的7个微卫星位点进行分析,结果平均杂合度达到0.887,高度杂合。本研究中CM、HM和ZY三个群体的平均杂合度分别为0.668、0.683和 0.617,比上述研究结果有所降低,可能原因是群体较小且长期封闭管理导致。杂合度Ho和期望杂合度He均大于0.5,且Ho均大于He,说明群体中近交程度较轻,但在部分位点出现Ho 有研究发现,杂交山羊的生长性状得到明显提高,但对遗传多样性方面研究较少[18]。从上述结果可以看出,杂交山羊30个微卫星位点的扩增得到的总等位基因数明显低于其他两个群体,Na、PIC、I值及杂合度的均值与其他两个群体相较也略低,说明杂交白山羊的多样性是不如其他两个群体丰富。杂交育种虽可以培育新的品种得到优良性状,但需要对杂交后代进行长期的观察培育。 Wright[19]提出,F-统计量(Fit、Fst、Nm)与遗传分化程度、近亲繁殖率、Hardy-Weinberg平衡偏离指标呈正相关关系,其值在0.05~0.15间,属中等分化水平。Nm主要分析群体间的基因交流程度,Nm越大基因交流越频繁[20]。本研究三个山羊群体的基因分化系数(Fst)为0.050 7,和河北7个山羊群体[8]和云南山羊群体[9]分化程度相差不大。三个群体的Nm值为4.680 6。说明虽然经过长期自然选择、人工选择、遗传漂变及地理隔离等因素,三个山羊群体并未产生较大的遗传分化,同属于长江三角洲白山羊,崇明白山羊为一个分支。遗传距离和主成分分析也显示,崇明白山羊和崇明杂交山羊亲缘关系较近,崇明杂交群体和崇明群体聚类为一支,该结果与崇明山羊群体绝大部分为崇明白山羊经杂交繁育而来的事实情况相符。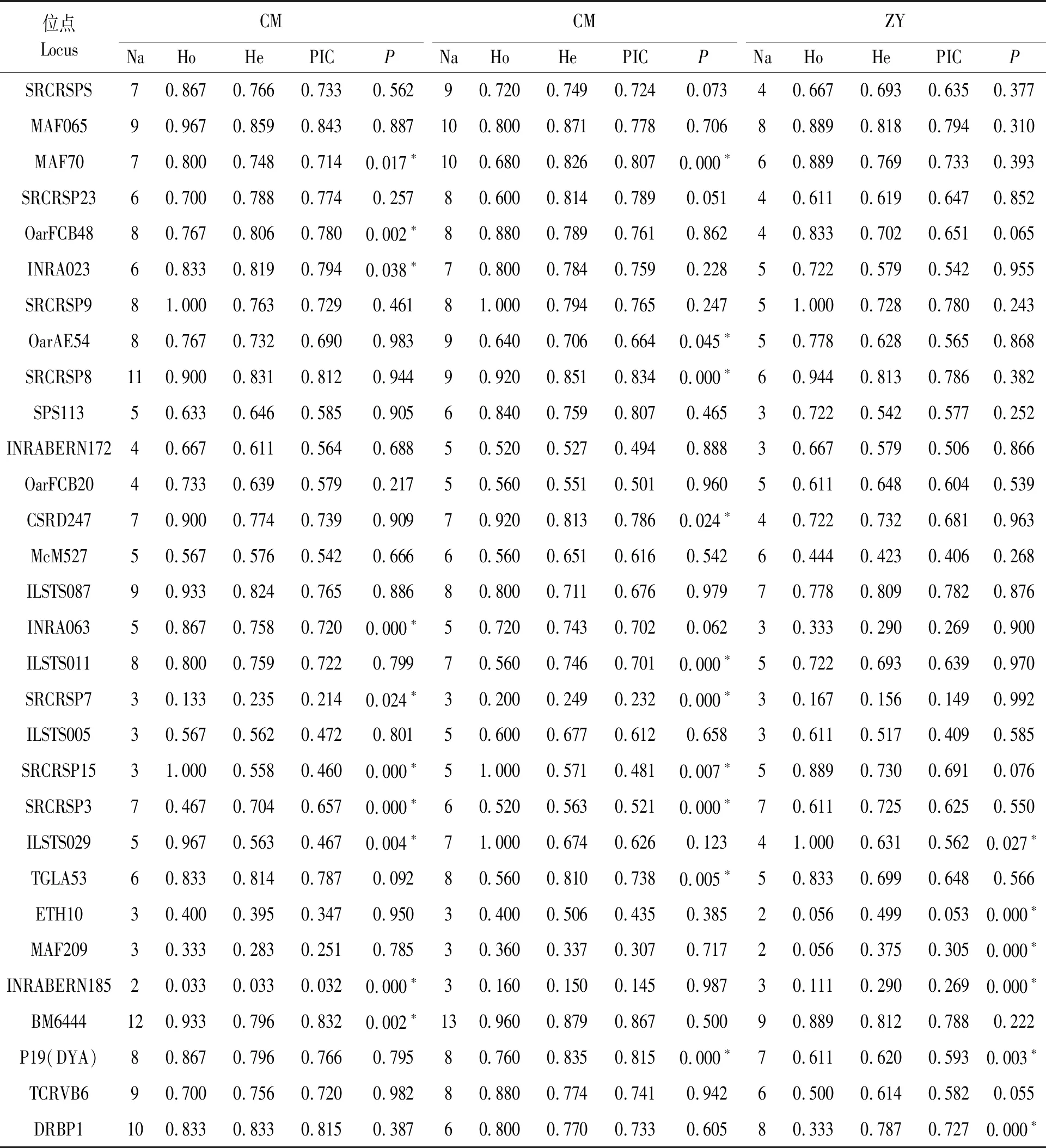
2.3 三个山羊群体遗传变异结果

2.4 微卫星位点的遗传分化

2.5 三个山羊群体遗传距离及聚类分析


3 讨论
