苹果3种潜隐病毒研究进展
2021-11-02袁彧伟付崇毅孙平平武占敏李正男
袁彧伟,张 磊,付崇毅,孙平平,武占敏,马 强,李正男
目前,苹果褪绿叶斑病毒(apple chlorotic leaf spot virus,ACLSV),苹果茎痘病毒(apple stem pitting virus,ASPV) 和苹果茎沟病毒(apple stem grooving virus,ASGV)在世界范围内的苹果种植区广泛发生,是苹果生产中最常见的3 种病毒,因为这3 种病毒在商业化苹果品种上没有危害症状,所以又被称为潜隐性病毒[1]。当这3 种病毒中的2 种或者3 种共同侵染苹果时,会对很多苹果品种造成生长衰退、嫁接不亲和等危害,从而导致减产甚至死亡,曾在我国渤海湾苹果产区和日本广泛发生,并引起严重危害的苹果“高接病”就是由这3 种苹果潜隐病毒复合侵染引起的[2]。迄今为止,还没有发现这3 种病毒的昆虫介体,机械摩擦、嫁接、携带病毒的砧木或接穗等植物材料的运输、交易等是这3 种病毒在不同地区间传播的主要途径[3-5]。有研究者在我国五大苹果产区对3 种病毒进行了检测,发现这3 种病毒在苹果上普遍发生[6-12]。由于潜隐性病毒在苹果上的症状往往不太明显,难以用生物学方法区分病树,而且树体一旦感病,终生带毒,给苹果病毒病的防治带来一定困难。目前,生产中还没有针对3 种病毒的有效防治手段,培育无病毒苗木以及加强植物材料进出口检疫是有效控制3 种病毒的重要手段。本文总结了近年来ACLSV、ASPV、ASGV 的研究,从生物学特性、分子特性和致病机制这3 个方面介绍了3 种苹果潜隐病毒的研究现状,以期为未来深入研究3 种病毒的致病机制及防治奠定理论基础。
1 苹果褪绿叶斑病毒研究进展
ACLSV 最早由MINK 等[13]于1959年在苹果上发现,之后越来越多的研究证明,其寄主范围广泛,除了可以侵染苹果的不同栽培品种,还可以侵染梨(Pyrus spp.)、沙梨(Pyrus pyrifolia)、榅桲(Cydonia oblonga)、桃(Prunus persica)、李(Prunus domestica)、杏(Prunus armeniaca)、樱桃(Prunus avium)、山楂(Crataegus pinnatifida)、枇杷(Eriobotrya japonica)等果树[14-22],引起梨环纹花叶病、李痘病、李假痘病、李裂皮病、杏环斑病、樱桃环斑病等,并造成这些果树的减产以及生长衰退。ACLSV 在世界范围内广泛分布,在亚洲地区如中国、韩国、印度、叙利亚、约旦等国家,南美洲如乌拉圭等国家,欧洲如英国、法国、波兰、捷克等国家,以及澳大利亚等种植苹果的国家都有报道。在我国已有调查表明,57.9%~100%的苹果树感染ACLSV。生产中常用的苹果商用品种感染ACLSV 后一般不出现明显症状,但如果用感病的接穗嫁接到砧木上,以及ACLSV 与ASPV、ASGV 复合侵染果树时,会在苹果树上引起症状。俄罗斯苹果(Malus sylvestris cv.R12740-7A)可用于ACLSV 的生物学鉴定,感染ACLSV 后叶片变小、畸形,出现褪绿斑,严重时整个植株生长衰退、萎蔫枯死。ACLSV可通过叶片摩擦的方式由木本寄主向草本寄主传播,或是草本寄主向草本寄主传播。在实验室常见的ACLSV 草本寄主有西方烟(Nicotiana occidentalis)[23]、苋色藜(Chenopodium amaranticolor)[24]和昆诺藜(Chenopodium quinoa)[25]。ACLSV 在西方烟上表现为非接种叶系统褪绿,叶片由叶缘向内卷曲、变细变长。接种昆诺藜后,叶片首先出现褪绿症状,随后出现坏死病斑,非接种叶出现不同程度的褪绿和花叶等。在苋色黎上也引起坏死,病斑呈点状,非接种叶出现斑驳、褪绿等。ACLSV 寄主种类信息见表1。

表1 ACLSV 寄主种类信息
ACLSV 在生物学分类上属于乙型线形病毒科(Betaflexivirdae)纤毛病毒属(Trichovirus)的成员。病毒为正义、单链的RNA 分子,病毒粒子呈扭曲的长线形,无包被,长度645~750 nm,直径约12 nm,不计算3′末端多聚腺嘌呤核糖核苷酸[Poly(A)]尾时,基因组大小约7.4 kb,5′端形成帽子结构,两端各有160~180 nt 的非翻译区。ACLSV 基因组包括3 个部分重叠的开放阅读框(open reading frames,ORFs),ORF1 编码包括甲基转移酶(methyltransferase,MTR),解旋酶(nucleotide triphosphate-binding helicase,HEL),RNA 依赖的RNA 聚合酶(RNA-dependent RNA polymerase,RdRp)等在内的一系列与复制相关的蛋白,大小约为216 kDa;ORF2 编码大小为50 kDa 的运动蛋白(movement protein,MP),这个蛋白与病毒在植物体内的移动有关;ORF3 编码大小约21 kDa 的外壳蛋白(coat protein,CP)[26]。其中,ORF1 直接由基因组表达,ORF2 和ORF3 则由亚基因组表达。
ACLSV 的CP 由ORF3 编码,N 端变异较大,而C 端相对保守,研究者们通常以CP 基因为依据,将世界上发现的所有ACLSV 分离物划分为B6 组、P205 组、SHZ 组和Ta Tao 5 组这4 个组群[10];而以全基因组序列为依据进行系统发育分析时,ACLSV会聚为B6 组、P863 组、Balatonl 组、MO-5 组、JB 组和Ta Tao 5 组6 个类群。张双纳等[27]将ACLSV 辽宁分离物与世界上其他分离物基于全基因组序列进行系统发育分析,与基于CP 基因的分组相比更好地表现了ACLSV 株系的多样性。基因组是最能代表遗传信息的,截至目前,在NCBI 数据库共报道47 个ACLSV 分离物基因组序列,其中有14 个来自中国、6 个来自日本、7 个来自韩国、6 个来自澳大利亚、4 个来自巴西、2 个来自印度、3 个来自德国、1 个来自美国、1 个来自法国、1 个来自捷克、2 个未知;按照寄主种类分,来源于苹果的有20 个,来源于桃的有9 个,来源于樱桃的有7 个,来源于梨的有4 个,来源于山楂的有3 个,来源于李子的有2 个,来源于枇杷的有1 个;所有分离物基因组序列长度在7 377~7 562 nt。ACLSV 分离物基因组序列具体信息见表2。
LIU 等[28]研究发现,ACLSV 陕西分离物在CP 基因的第40、59、75、86、130 位和第184 位6 个氨基酸位点处存在共变异,而将分离物构建系统进化树后发现,ACLSV 分离物的组群分支结果与该氨基酸共变异位点一致,分为3 个类型。LIU 等[28]研究发现的重组事件集中在CP 基因上,两个重组体的寄主分别为梨和苹果。梨和苹果并不共用砧木体系,可以排除嫁接导致的ACLSV 在两种植物间传播,表明ACLSV 的重组可以在不同的寄主之间发生,这或许是进化过程中病毒侵染力增强的体现。该研究阐述了在ACLSV 种群的进化历程中,CP 基因主要受到负选择调节,并且负选择是ACLSV 进化过程中的主要动力,种群遗传多样性分析表明,ACLSV 正处于种群扩张时期。李科等[29]于2015年首次获得完整的中国ACLSV 苹果分离物全基因组序列,除此之外还克隆得到了22 个CP 基因。与GenBank 中其他CP基因的氨基酸序列比较后可分为3 个类型。李科等[29]结合前人的研究发现,ACLSV CP 的第40 位和第75 位氨基酸位点最容易发生变异。李科等[29]在ACLSV 山东苹果分离物中发现了潜在的重组事件,其中有两个重组事件均获得7 种算法中的5 种支持,最低P 值都小于10-5,重组事件集中在MP 基因上。CHEN 等[30]以Ser40-Tyr75-Ser79在CP 上的组合为特征,发现了新的系统发育类型SHZ;从全球ACLSV 分离物中鉴定出2 个来自中国的重组体,它们的重组断点位于CP 基因序列的3′端。MAZEIKIENE等[31]也发现立陶宛ACLSV 分离物与数据库分离物中的CP 基因存在重组。所有算法显示重组事件位于CP 基因的3′端,发生在CP 基因的322~571 nt 和311~582 nt。RANA 等[32]此前对ACLSV 印度分离物CP 基因进行重组分析,只得到一个单一的重组事件。在多个研究中,发生在ACLSV CP 基因的重组事件并不普遍,这说明ACLSV 的CP 基因可能是一个重组“冷点”。DHIR 等[33]对ACLSV 印度分离物的复制酶基因、运动蛋白基因、外壳蛋白基因和NCRs(非编码区)等所有基因进行了重组分析,共发现18 个重组位点,检测到的重组事件具有普遍性,其中2 个位于5′非编码区、14 个位于聚合酶基因,其余位点发生在基因组的其他基因上,4 700~5 400 nt 是聚合酶基因上发生重组事件最多的区域。DHIR 等[33]讨论了重组位点与寄主类型的相关性,发现苹果分离物内的株系间重组多于株系内重组。重组在植物病毒的变异上占有至关重要的地位,并且有利于病毒更好地适应环境。但重组后病毒序列发生了变化,与之前基因编码的蛋白会产生一定的排斥作用,影响了病毒基因和蛋白相互作用,不利于选择[34]。研究表明,ACLSV 基因组之间的重组并不普遍,但重组导致了ACLSV 更加丰富的遗传多样性,重组情况的分析有利于定义分离物的进化关系。值得注意的是,上述研究中一些重组分离物的主要亲本和次要亲本有不同的地理来源,或者是重组分离物和亲本分离物来自不同的地理位置,这意味着ACLSV 的基因组非常多变,可能是多次嫁接或远距离运输繁殖材料的结果。ACLSV 的遗传多样性,是否完全与地理来源和寄
主植物种类相关,还需要更多的序列分析和证明。
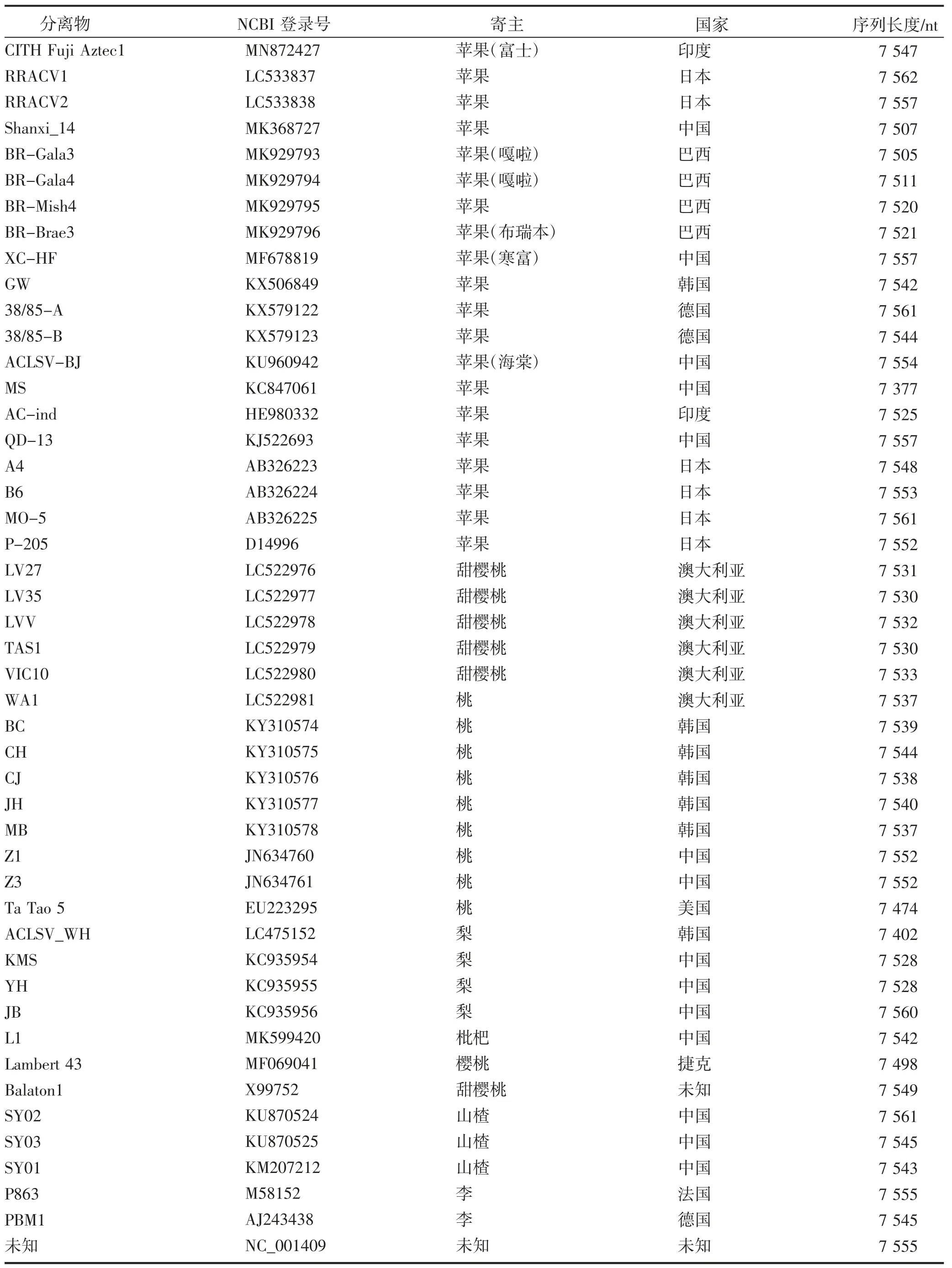
表2 ACLSV 分离物基因组序列信息
YAEGASHI 等[35]研究发现,ACLSV CP 基因的第40、59、75、130 位和第184 位5 个氨基酸位点上存在共变异,分为P205 和B6 两种类型,这也与基于CP 氨基酸序列构建的系统发育树中的两个主要聚类完全一致。后续通过构建侵染性克隆和农杆菌接种的方法对CP 的5 个氨基酸位点进行突变分析,证明第40 位和第75 位两个氨基酸位点的组合(Ala40和Phe75或Ser40和Tyr75)对ACLSV 的侵染性和病毒在细胞中的有效复制至关重要。而MP 基因除了与病毒在细胞内运动有关,还是一个可以抑制植物系统性沉默的弱抑制子,YAEGASHI 等[36]通过构建缺失突变体,发现ACLSV MP 的N 末端区域(1~284位氨基酸)是干扰沉默信号长距离运动的抑制子活性的必要区域。目前,ZHANG 等[2]和张双纳[37]分别构建了ACLSV 德国株系和中国株系的侵染性克隆,SATOH 等[38]构建了ACLSV日本株系的侵染性克隆,KIM 等[39]构建了ACLSV 韩国株系的侵染性克隆,为ACLSV 致病性及其与寄主互作研究奠定了基础。
2 苹果茎痘病毒研究进展
1954年,SMITH[40]在出现茎痘斑和坏死的苹果砧木上首次发现ASPV。除苹果外,ASPV 也在梨上普遍发生。近年来,陆续有ASPV 侵染榅桲、樱桃、山楂、枇杷、花楸(Sorbus pohuashanensis)等蔷薇科木本果树的报道[41-46],在种植苹果的国家都有ASPV 分布。ASPV 与ACLSV、ASGV 相比,发生率相对较低,在我国北方苹果主产区的发生率为25.7%~85.7%。弗吉尼亚小苹果(Malus pumila cv.virginia crab)和Spy227(Malus domestica Spy227)是ASPV 的木本指示植物,症状分别表现为木质部上产生茎痘斑,以及叶片畸形和树势衰退,但ASPV 在大多数商用苹果品种上仍无症状[47]。ASPV 也可以通过摩擦接种侵染西方烟[48]、墙生藜(Chenopodium murale)[49]等实验室草本寄主,发病的西方烟叶片出现褪绿和黄斑;发病的墙生藜叶片局部褪绿。吴雅琴等[49]将ASPV 通过摩擦接种的方式侵染千日红(Gomphrena globosa)和鸡冠(Celosia cristata)等观赏植物,观察到叶片出现局部坏死斑、斑驳等症状。ASPV 寄主种类信息见表3。
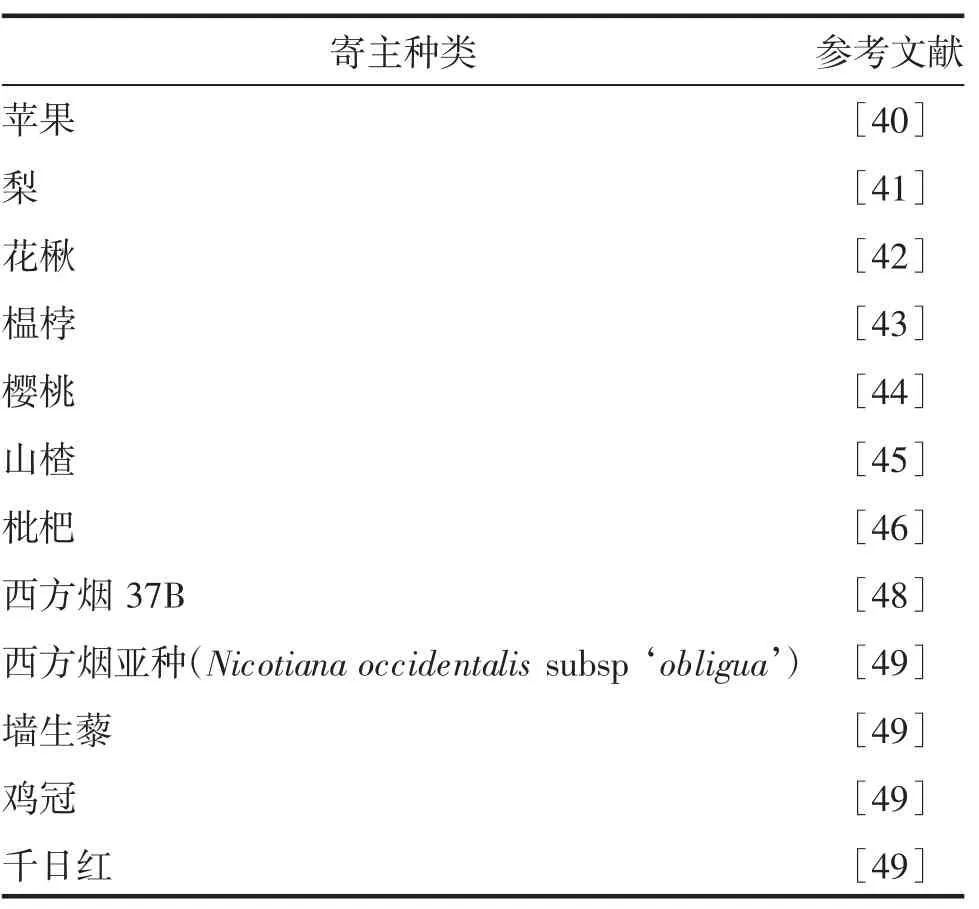
表3 ASPV 寄主种类信息
ASPV 为乙型线形病毒科(Betaflexivirdae)凹陷病毒属(Foveavirus)的代表种。ASPV 基因组是一条全长约9.3 kb(不包括3′端poly-A 尾巴)的单链、正义RNA。病毒粒子线性,大小为12~15 nm×800 nm。病毒基因组编码5 个ORF,ORF1 编码RNA 依赖的RNA 聚合酶(RdRp),ORF2~ORF4 编码三联体蛋白(triple gene block protein,TGBp1-p3),ORF5 编码病毒外壳蛋白(CP)[48]。
目前,多个研究表明,ASPV CP 的N 端不同位置存在不同的缺失或插入,而CP 的C 端相对保守。KOMOROWSKA 等[50]通过对来自苹果和梨的ASPV分离物的CP 基因序列分析,研究了波兰ASPV 分离物的遗传群体结构,结果显示,波兰ASPV 分离物的CP 基因大小在1 092~1 245 nt,这种差异是由于CP 基因N 端部分缺失造成的。LIU 等[51]研究发现,ASPV 分离物的系统发育位置似乎与ASPV 分离物CP 大小的分化以及氨基酸插入或缺失的位置有关。WU 等[52]根据CP 基因的长度或序列多样性,分别提出了ASPV 分离物的3 种类型(1、2、3)和4 个组(A、B、C、D),1 型仅包含CP 基因长度为1 245 nt的分离物,而带有不同长度或不同位置缺失的分离物分别被归为2 型(1 191 nt 和1 185 nt)和3 型(1 125 nt、1 128 nt 和1 131 nt)。LIU 等[53]将27 个ASPV 分离物(其中18 个已在WU 等[52]的研究中分析)分为Ⅰ、Ⅱ、Ⅲ3 个组,不同于WU 等[52]分成的A、B、C、D 4 个组。MA 等[54]以ORF5 和ORF2~ORF4 编码的基因序列为依据进行系统发育分析,将ASPV 分离物按照寄主种类分为3 个组群,说明ASPV 分离物的分组与寄主种类有一定相关性。HU 等[55]对ASPV 的CP 基因和TGBp1~TGBp3 基因全序列进行系统发育分析,都产生了3 个组。中国苹果ASPV 分离物聚集在一组,中国梨分离物聚集在另一组,表现出一定的地理来源相关性和寄主相关性。截至目前,在NCBI 数据库共报道32 个ASPV 分离物基因组序列,其中有14 个来自中国、4 个来自巴西、5 个来自德国、3 个来自印度、2 个来自日本、2 个来自韩国、1 个来自英国、1 个来自西班牙;按照寄主种类分,来源于苹果的有21 个、来源于梨的有8 个、来源于枇杷的有1 个、来源于山楂的有1 个;所有分离物基因组序列长度在9 206~9 363 nt。ASPV 分离物基因组序列具体信息见表4。
基因组中出现如此大的缺失而没有降低病毒粒子的适应性,是发生在病毒中的一种例外现象。KOMOROWSKA 等[56]进一步研究发现,ASPV CP 基因N 端区域的删除与病毒适应不同的寄主无关,基于波兰ASPV 分离物CP 序列的系统发育分析表明,寄主种类对病毒分子变异沿系统发育树的分布没有显著影响,而在以往的大多数报道中,ASPV 分离物的系统发育分组与寄主种类相关。ASPV 基因组间存在频繁的重组现象,在RdRp 基因、TGB 基因、CP 基因上均有报道发生重组事件。CP 基因上的重组位点集中在5′端以及700~900 nt 区域[57]。HU 等[55]在ASPV CP 基因和TGB 基因都发现有重组事件发生,所有的重组事件发生在与ASPV 以外的其他病毒混合感染的样品中。LI 等[58]分析了全基因组序列内的重组情况,确认了多个假定的重组事件贯穿于RdRp 基因、TGB 基因和CP 基因编码区域,这表明ASPV 分离物之间发生了广泛的基因组重组。孙平平等[48]将获得的ASPV 内蒙古分离物与NCBI 数据库中其他分离物的基因组序列共同进行重组分析,发现18 个分离物中有16 个分离物的基因组中存在重组事件,重组位点集中在RdRp 基因5′端区域,部分分离物基因组中存在三重组或双重组事件,说明重组事件在ASPV 分离物中极具普遍性,进一步表明,重组是ASPV 分子进化的主要动力。植物病毒的重组具有普遍性和随机性,大部分个体在发生重组后并不能适应环境,这可能是某种与“瓶颈”效应相似的机制对这些重组事件进行了甄别,以过滤和淘汰不利的突变[59]。KOMOROWSKA 等[56]研究认为,重组产生了具有不同程度有害突变的基因型,而选择的力量移除了具有更多有害突变的基因型。在这种情况下,重组的功能可能是通过选择加快清除有害突变的速度。由于缺乏传播ASPV 的介体,可能使ASPV 的外壳蛋白比通过介体传播的植物病毒外壳蛋白更能耐受序列变异性,从而对氨基酸变化进行了更强的负选择。虽然负选择在ASPV CP 基因的进化中占主导地位,但不同密码子受到的选择力不同。刘萍[9]研究发现,TGBp1 基因在进化过程中承受的选择压力最小,忍受的限制最多;ASPV 经历了明显的种群扩张,并且不断扩展和蔓延。KOMOROWSKA等[56]研究表明,ASPV 分离物作为病毒准种存在,是一群相关但遗传上不同的变种。ASPV 种群的准种性为其快速进化和适应不断变化的环境提供了一种机制。此外,ASPV 产生准种种群似乎与寄主种类无关,但与症状的严重程度有关。准种的变异似乎有助于形成ASPV 群体的遗传结构和动态。RNA 病毒的准种性质导致了高适应潜力,从而在新环境中快速选择具有最高适应性的生物学上不同的变种。确定受感染个体之间和病毒群体内部的遗传变异特征,可以提供有关病毒进化和流行病学过程的基本信息,对于设计可靠的诊断工具和制定更有效和持久的病害防控策略至关重要。
ASPV TGBp1 的功能是驱动病毒粒子在细胞内和细胞间移动,还具有抑制系统性沉默而非局部沉默的RNA 沉默抑制子(viral suppressor of RNA silencing,VSR)活性。ASPV 编码的5 个基因均具有较大的遗传变异性,特别是ORF5 编码的CP 基因。病毒CPs 通常与侵染性、致病性和症状有关,MA 等[60]研究发现,ASPV CP 基因插入植物瞬时表达载体PVX 后增强了PVX 在西方烟上的症状,表明CP 基因也是一个症状决定子。ARNTJEN[61]用CPEC(circular polymerase extension cloning)方法构建了ASPV PB66 分离物的侵染性cDNA 克隆,ZHANG[62]利用融合克隆(in-fusion cloning)技术构建了ASPV 德国株系的侵染性cDNA 克隆,为ASPV 的致病机制和病毒与寄主互作的研究奠定了基础。
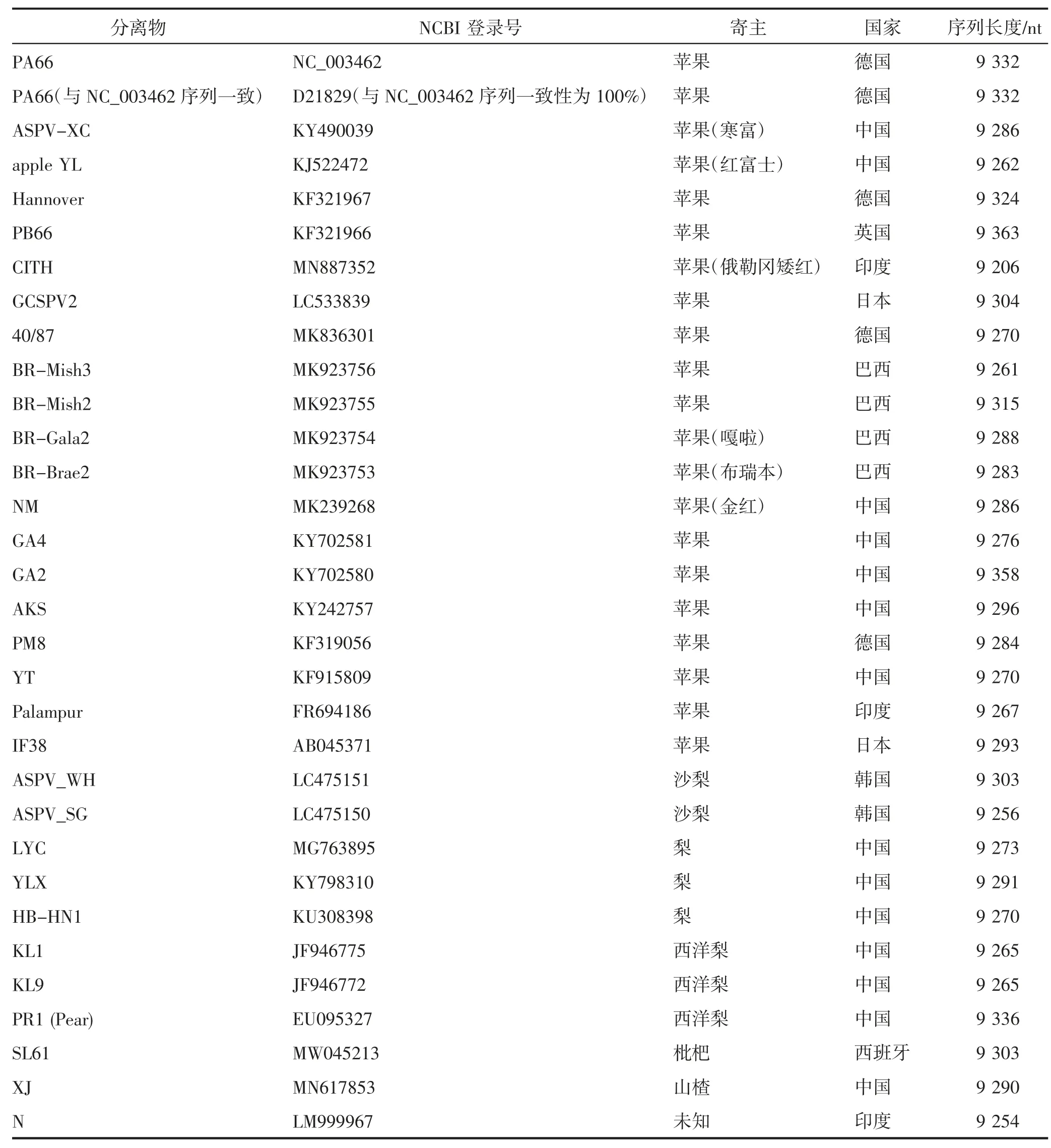
表4 ASPV 分离物基因组序列信息
3 苹果茎沟病毒研究进展
ASGV 是一种在世界范围内广泛分布的潜隐性病毒,在亚洲、欧洲、北美洲、南美洲、大洋洲分布的国家陆续有研究报道,苹果园内ASGV 的发生率经常达到60%以上。LISTER 等[63]于1965年最先在苹果上发现ASGV,随后的研究表明ASGV 还可以侵染梨、杏、樱桃[64-66]等蔷薇科果树。随着RT-PCR 和siRNA 高通量测序技术的应用,近年来陆续在沙果(Malus sylvestris)、柑橘(Citrus reticulata)、猕猴桃(Actinidia chinensis)、枣(Ziziphus jujuba)、无花果(Ficus palmata)等果树[67-71],以及百合(Lilium brownie)、月季(Rosa chinensis)、莲(Nelumbo nucifera)、竹(Dendrocalamus hamiltonii)等观赏植物[72-75]和黄精(Polygonatum kingianum)、 椭圆悬钩子(Rubus ellipticus)[76-77]上检测到该病毒,寄主范围十分广泛。除非嫁接到敏感的砧木上,否则ASGV 在大多数商用的苹果和梨品种上是不表现症状的。弗吉尼亚小苹果可用于ASGV 的生物学鉴定,ASGV 可造成木质部出现长凹槽和鼓包,但不同的ASGV 分离物造成的症状会有差异,还可能出现韧皮部坏死和生长衰退等[78]。用染病材料嫁接的植株,会出现嫁接不亲和、植株发育不良、产量下降甚至致死等现象。马强等[79]通过人工接种的方法将ASGV 摩擦接种到苋色藜、昆诺藜、心叶烟(Nicotiana glutinosa)、西方烟、芸豆(Phaseolus vulgaris)等实验室草本植物,均产生病毒侵染症状。苋色藜表现为叶片褪绿、内卷;昆诺藜表现为花叶;心叶烟表现为叶片均匀褪绿;西方烟表现为叶片内卷、变细、变长;芸豆叶片形成坏死斑点。洪霓等[80]通过汁液摩擦的方法鉴定ASGV 的草本寄主范围,发现灰藜、菜豆也是ASGV 的草本寄主,接种后灰藜出现褐色坏死斑、叶片皱缩等症状;菜豆出现叶片反卷、新叶枯死等症状。ASGV 没有昆虫传播介体,目前已发现在草本寄主百合和昆诺藜上ASGV 可以通过种子传播[81]。ASGV 寄主种类信息见表5。
ASGV 为乙型线形病毒科(Betaflexiviridae)毛状病毒属(Capillovirus)的模式种,为正义、单链的RNA病毒,不计算3′poly(A)尾时,全长大约为6 500 nt,5′端有一个帽子结构。病毒粒子呈螺旋对称的弯曲线状,长600~700 nm,直径12 nm,螺距在3.6 nm 左右。ASGV 基因组含有两个互相重叠的ORF,ORF2嵌套在ORF1 内,分别编码242 kDa 左右的多聚蛋白和36 kDa 左右的运动蛋白。ORF1 编码的ASGV多聚蛋白包含甲基转移酶,木瓜蛋白酶(papainlike-protease,P-PRO),解旋酶,RNA 依赖的RNA 聚合酶和外壳蛋白等功能区域。MP 和RdRp 及CP 之间存在重叠,外壳蛋白区域位于C 末端[82]。ASGV 的蛋白结构与其他乙型线形病毒科成员相比十分特殊,如ACLSV、ASPV 都是在一个单独的ORF 中编码CP,这可能与ASGV 的基因组较小有关,目的是增加有限大小的基因组中存储的遗传信息的数量,产生更具多样性的蛋白。目前,在NCBI 数据库登记的ASGV 分离物基因组序列共有65 个,其中有33 个来自中国、11 个来自日本、6 个来自美国、5 个来自韩国、5 个来自巴西、4 个来自印度、1 个来自德国;按照寄主种类分,来源于苹果的有16 个、来源于沙果的有2 个、来源于柑橘的有29 个、来源于梨的有8 个、来源于枇杷的有2 个、来源于日本川芎(Cnidium officinale)的有2 个、来源于百合的有2 个、来源于猕猴桃的有1 个、来源于黄精的有1 个、来源于牡丹(Paeonia suffruticosa)的有1 个、1 个未知,所有分离物基因组序列长度在6 368~6 509 nt。ASGV分离物基因组序列具体信息见表6。

表5 ASGV 寄主种类信息
NEGI 等[83]对ASGV CP 在氨基酸水平上的多重比对显示,CP 基因的C 端高度保守,且在CP 上有重组事件发生。ASGV 和柑橘碎叶病毒(citrus tatter leaf virus,CTLV)的一致性较高,后续研究证明CTLV 是ASGV 的一个株系,只是ASGV 和CTLV 的寄主偏好性不同。NEGI 等[83]研究发现,ASGV 印度分离物CP 氨基酸序列与CTLV 的一致性为95%~98%,基于ASGV 分离物CP 基因分析,发现相同国家来源的分离物聚集在一起。LIEBENBERG 等[84]在ASGV 分离物中检测到2 个具有高变异性的区域,即V1(532~570 aa)和V2(1 583~1 868 aa)。基于V1和V2 两个区域的系统发育分析表明,ASGV 的多样性是由寄主种类构成的,与地理来源无关。对ORF1的V1 和V2 区域的进化分析表明,它们对应于进化约束较宽松的区域,但没有表现出显著的正选择。连接复制酶C 端的CP 可能对病毒的功能很重要,这也可以解释V2 区域中终止密码子的缺失。ORF2 与CP 基因重叠的区域可能比与RdRp 基因重叠的区域起源更晚,也许是ORF2 在更低选择压力下的新延伸。ASGV 基因组中各区域的进化模式差异很大,基因组整体上负选择占优势,但是V1 和V2 区域有部分密码子受到正选择压力。CHEN 等[85]基于全基因组的系统发育分析,将来自世界各地分离物分为2 组,与寄主或地理来源无关;并且发现了可能是由于带毒植物材料远距离运输或嫁接导致的不同种类寄主来源的ASGV 重组事件,重组位点集中在MP 基因上,也是ORF1 和ORF2 重叠的区域。选择压力分析表明,ORF1 主要受负选择推动,第1 756 位和第1 798 位的两个密码子处于正选择状态,负选择是ASGV 的主要进化动力。与LIEBENBERG 等[84]的报道类似,CHEN 等[85]在ASGV 分离物中发现532~570 aa 和1 583~1 868 aa 两个高度可变区。LIU 等[86]通过系统发育分析发现,ASGV 分离物的聚集与寄主种类和地理来源没有关联;选择压力分析表明,ORF1 编码的基因变异性比较大。ASGV CP 基因在不同寄主来源的分离物上表现出的变异性差异较大,这可能是寄主植物不同导致的差异,也可能是一种和寄主相关的选择。马强等[79]分别以全基因组、RdRp 基因和CP 基因序列为依据构建系统发育进化树,发现ASGV 分离物的分类与地理位置或者寄主种类并不相关,而且对不同基因序列进行的系统发育分析结果差异较大。
有研究表明,ASGV CP 和MP 是由亚基因组RNA 表达的,且CP 对ASGV 的侵染性至关重要。HIRATA 等[87]研究发现,在RdRp 基因和CP 基因编码区之间,位于4 646 位的核苷酸沉默突变导致症状减弱和ASGV 病毒粒子积累减少。与该病毒分离物的野生型相比,第4 646 位核苷酸替换可能改变了该区域基因组的二级结构,从而减轻症状。KOMATSU 等[88]研究发现,位于1.0 kb CP sgRNA 转录起始位点下游的ASGV CP 翻译起始位点突变(AUG 突变为ACG),可抑制ASGV 系统性侵染昆诺藜。目前,LI 等[89]用Gibson 组装法构建了ASGV 中国株系的侵染性cDNA 全长克隆,TERAUCHI 等[90]构建了ASGV日本分离物的侵染性克隆,OHIRA[91]构建了CTLV 百合分离物的侵染性克隆,为后续研究病毒基因功能和致病性以及病毒与寄主互作奠定了基础。目前还没有对ASGV 基因组功能和致病机制的深入研究,了解ASGV 的种群动态变化以及遗传特点,可以掌握ASGV 流行传播的趋势,为ASGV 防治策略的制定奠定基础。
4 问题与展望
我国作为世界上最大的苹果生产国,每年都要生产全球产量一半以上的苹果,带来巨大的经济效益。然而在此表象之下,苹果潜隐病毒因其致病特点以及感病后低脱毒率等问题阻碍了我国苹果产业快速发展。ACLSV、ASPV、ASGV 同属于乙型线形病毒科,主要通过嫁接和繁殖材料的运输传播,暂未发现传播介体昆虫。3 种病毒经常复合侵染苹果树,造成巨大的经济损失。我国对苹果潜隐病毒的调查研究起步较晚,目前国内主要围绕这3 种病毒的生物学进行研究,而分子生物学的相关研究仅停留在分子变异、基因组结构等方面,对病毒的基因功能、致病机制等没有深入了解。3 种苹果潜隐病毒的寄主种类很广泛,且正在不断扩充,这也是病毒不断进化的结果。在苹果病毒病害中树体往往并不是只被某一种病毒侵染,而是几种病毒或者一种病毒的不同株系共同侵染导致的,这些病毒在树体更容易产生基因重组事件,导致基因组发生变化。因此,重组是推动病毒快速进化和遗传多样性的主要因素之一,它可以帮助病毒适应新的环境,扩大寄主范围,对病毒的变异起重要作用。ACLSV 基因组间的重组情况并不普遍,部分集中发生在RdRp 基因上,而ACLSV CP基因甚至被认为是一个重组“冷点”,这可能与重组后基因与编码蛋白的不亲和有关。ASPV 基因组间存在频繁的重组现象,在RdRp 基因、TGB 基因、CP 基因上均有报道发生重组事件。ASGV 的重组主要集中在MP 基因上。病毒在漫长的自然进化中一直受到选择压力的调控,这种调控具有方向性。从基因组整体受到的选择压力来看,ACLSV、ASPV、ASGV 主要受负选择调控,而负选择虽然在ASPV CP的进化中占主导地位,但不同密码子受到的选择力不同,ASGV 基因组的高度可变区也存在正向选择位点。总而言之,这3 种病毒在进化中趋于保守,并且与地理位置和寄主种类等因素互相作用。
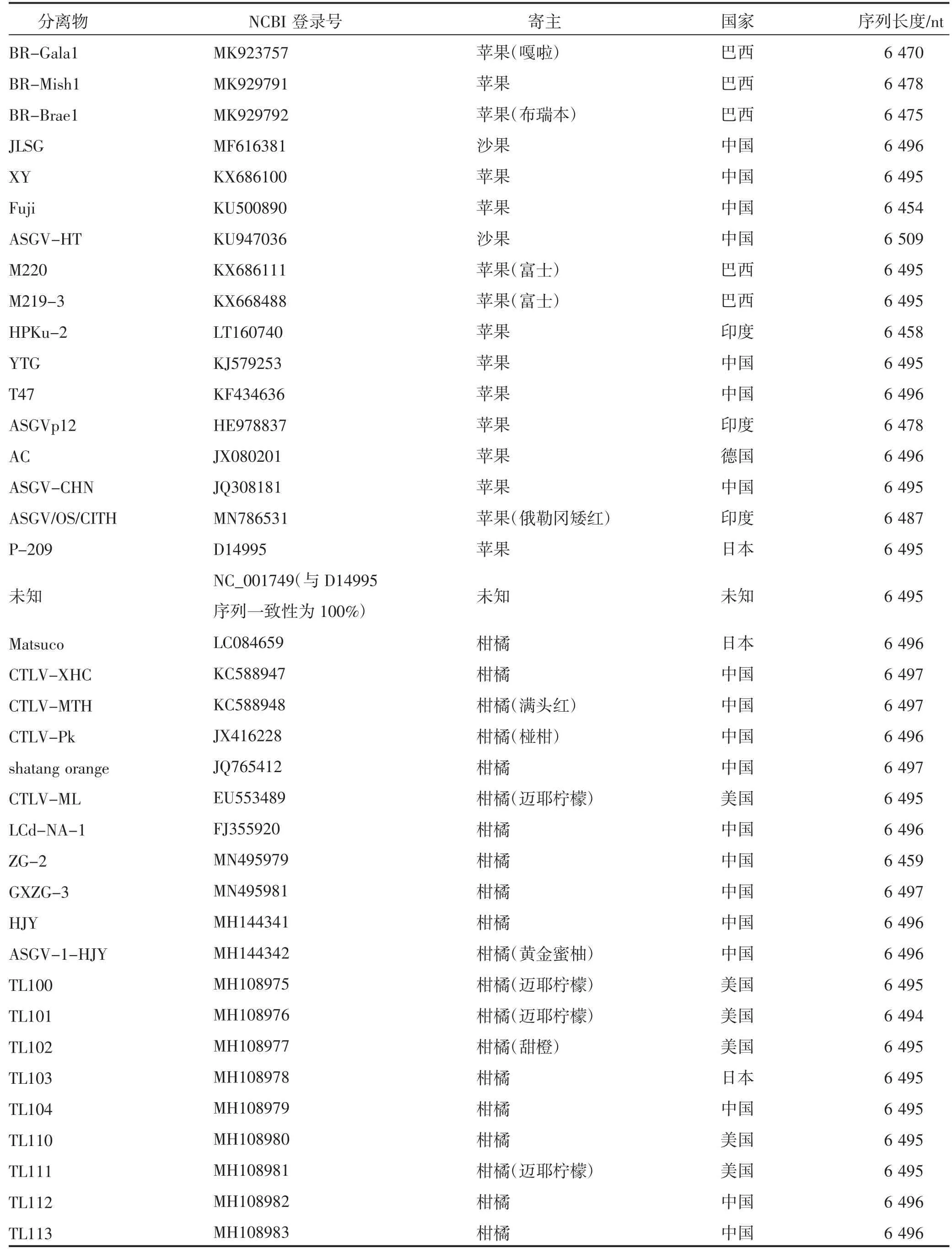
表6 ASGV 分离物基因组序列信息
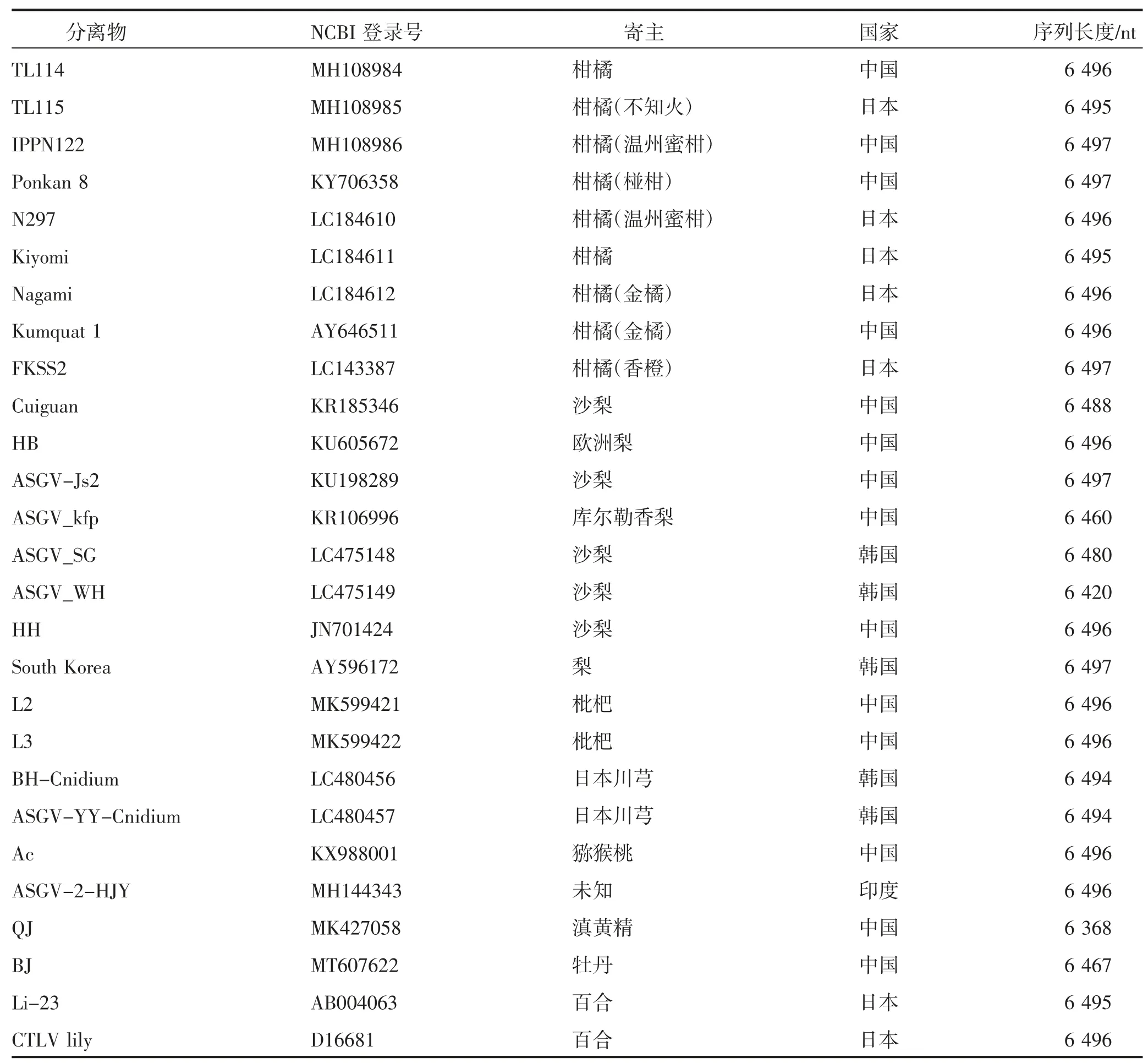
表6(续)
近年来测序技术发展迅速,即使是植物病毒全长基因组测序需要的经济和时间成本也大幅降低,这对植物病毒的分子进化研究是一个非常有利的促进因素。在病毒进化与种群演变的漫长过程中,病毒与环境、寄主之间,以及病毒与病毒之间的互作一直在影响着进化及演变的方向。明确植物病毒的流行病学特点和分子层面的进化历程,对提出有效可行的病毒病害防治策略具有重要意义。目前已分别有研究者成功构建了ACLSV、ASGV、ASPV 的侵染性克隆,为后续研究病毒基因功能、致病机制以及病毒与植物的互作奠定了基础。
