EGFR共突变对非小细胞肺癌患者治疗和预后影响的研究进展
2021-11-01刘灵丽廖德华杨农南华大学湖南衡阳4200湖南省肿瘤医院中南大学湘雅医学院附属肿瘤医院肺胃肠内科长沙4003湖南省肿瘤医院药学部长沙4003
刘灵丽,廖德华,杨农(. 南华大学,湖南 衡阳 4200;2. 湖南省肿瘤医院/中南大学湘雅医学院附属肿瘤医院肺胃肠内科,长沙 4003;3. 湖南省肿瘤医院药学部,长沙 4003)
肺癌是全球范围内死亡率最高的呼吸系统恶性肿瘤[1],其中85%为非小细胞肺癌(non-small cell lung cancer,NSCLC),且有三分之一的患者在初诊时已经发生远处转移而被诊断为晚期[2]。近年来,一系列致癌驱动基因被发现,其相应的靶向治疗使NSCLC治疗发生革命性的变化。特别是EGFR-TKIs的出现,改变了晚期EGFR突变NSCLC的治疗模式,显著改善了患者总体生存期(OS)和无疾病进展生存期(PFS),改善了患者生活质量,并促进了肺癌向慢性疾病的转化[3]。
而随着二代测序技术的不断发展与成熟,人们发现绝大多数EGFR突变都有伴随突变,并且提示与预后较差相关[4]。因此,单一驱动基因的常规模型已不足以解释NSCLC的复杂性,EGFR-TKIs单药治疗也不能成为EGFR突变人群固定治疗模式。本文通过对近年来EGFR共突变对NSCLC治疗及预后的影响进行综述,希望对此类患者临床EGFR-TKI的研究和治疗提供一定指导。
在本文中,我们讨论了EGFR共突变对NSCLC治疗和预后的影响,并评估了共突变为个性化抗肿瘤治疗带来的挑战和机遇。
1 共突变类型
EGFR共突变主要分为抑癌基因突变(TP53、RB1、PTEN等),多重驱动基因突变(ALK、MET、ROS1等)两种类型,其中抑癌基因突变为最常见类型。在最新的一项关于晚期EGFR突变肺腺癌患者接受一代EGFR-TKI治疗的研究中,共收录180名肺腺癌患者,其中仅EGFR突变的患者59名(32.8%),EGFR伴随抑癌基因突变的患者97名(53.9%),EGFR伴随多重驱动基因突变的患者24名(13.3%)。接受吉非替尼治疗后结果显示,这些患者的中位PFS分别为13.2个月vs9.3个月vs4.0个月(P<0.05),OS分别为32.0个月vs21.7个月vs15.5个月(P<0.001),揭示存在EGFR共突变与预后差相关,其中多重驱动基因突变预后最差[5]。
2 常见共突变基因
2.1 TP53
TP53基因是编码肿瘤蛋白p53的抑癌基因,超过50%的癌症患者携带了TP53的功能丧失突变[6]。TP53可通过调节细胞周期,DNA修复,细胞程序性凋亡等通路参与多种肿瘤的发展与转移和放化疗的耐药[7]。TP53属于最常见的EGFR共突变基因,54.6%~64.6%的EGFR阳性的NSCLC患者中存在TP53突变[8],而TP53基因突变最主要是错义突变[9]。
EGFR/TP53共突变与NSCLC预后不良相关。有临床前研究表明,TP53基因的表达情况与肺癌细胞对EGFR-TKI的敏感性存在相关性[10]。在肺癌细胞系中给予吉非替尼治疗后,野生型的P53基因从细胞质向细胞核转移,通过上调质膜上的FAS和casepase的表达从而诱导肺癌细胞的凋亡,增加肺癌细胞对吉非替尼的敏感性。相反,在TP53突变的肺癌细胞系中,吉非替尼诱导凋亡的能力受到了抑制。临床上,Labbé等[11]发现,在接受了EGFRTKIs治疗的晚期EGFR突变肺癌患者中,TP53突变与野生型的客观缓解率(ORR)无显著性差异。与TP53基因野生型(n=36)比较,在TP53基因错义突变(n=17)中PFS显著缩短(PFS:8.9个月vs12.8个月,HR=1.91,95%CI:1.01~3.60,P=0.04)(见表1)。
一项针对于TP53突变类型的研究表明,不同的TP53突变类型对EGFR-TKIs 治疗的敏感性存在差异。其中与TP53外显子8野生型患者相比,TP53外显子8突变患者的反应最差,TP53外显子8突变的疾病控制率(DCR)显著降低(87.3%vs41.7%;P<0.001),PFS和OS明显缩短,且TP53外显子8突变患者的疾病进展的相对危险度(RR)几乎是野生型的10倍(P<0.05)。该研究还根据EGFR突变类型进行亚组分析TP53与TKIs反应的关系,发现在EGFR19外显子缺失的患者(n=74)中,其中66例患者携带TP53突变。EGFR19外显子缺失且TP53野生型的患者 DCR 为 98%,而同时携带了TP53突变的患者DCR为70%,中位PFS为16.8个月vs4.2个月(P<0.001),中位OS为未达到vs7.6个月(P=0.006),TP53外显子8突变的患者的疾病进展或死亡风险几乎是TP53野生型的患者的7倍[HR6.99(2.34~20.87),P=0.006]。但是其他类型EGFR突变患者中,是否伴随TP53突变与预后没有相关性。同时该研究还发现,TP53外显子8突变中最常见的为非破坏性的,约占总数的92%。然而非破坏性TP53突变也与预后不良相关,在EGFR19外显子缺失的患者中,与伴随TP53破坏性突变的患者相比,同时伴随TP53非破坏性突变患者的ORR和DCR明显降低,分别为70.7%vs37.5%(P=0.079),93.1%vs75%(P=0.151),后者的疾病进展风险几乎是野生型患者的4倍[12](见表1)。以上研究证明EGFR/TP53共突变与NSCLC预后不良相关,且TP53外显子 8 突变患者对EGFR-TKI的反应最差。
2.2 PTEN
第10号染色体上缺失的磷酸盐和张力同源物基因(PTEN),属于肿瘤抑制基因,是PI3K/AKT途径的主要负调节因子,编码参与PTEN蛋白的合成[13]。蛋白质水平下调,杂合性缺失和表观遗传沉默等导致PTEN蛋白失活,从而激活PI3K/AKT途径并促进肿瘤细胞的增殖[14]。
PTEN缺失在NSCLC病例中占40%以上,但与EGFR基因共突变较少见[15]。在Zhong等[16]的研究中,仅在1名原发耐药患者中检测到PTEN缺失,约占总数的9.1%。目前已有研究表明PTEN缺失与预后不良相关,同时PTEN与EGFR-TKI敏感性也有相关性[17]。Endoh等[18]在78名肺癌术后复发使用吉非替尼治疗的患者中检测PTEN的表达水平,发现高PTEN表达水平与OS延长有关。Wang等[19]对169例接受EGFR-TKIs治疗的EGFR敏感突变的晚期NSCLC患者进行研究,发现EGFR突变合并PTEN缺失的患者PFS和OS短于仅EGFR突变的患者[PFS:HR,3.64;95%CI(1.47~9.00);OS:HR,2.86;95%CI(1.04~7.89)],同时PTEN缺失(HR,4.29;95%CI:1.72~10.70)和PTEN低蛋白表达(HR,1.96;95%CI:1.22~3.13)是EGFR-TKIs治疗预后不良的独立影响因子(见表1)。
既往研究表明EGFR突变合并PTEN缺失的患者对EGFR-TKI治疗不敏感,提示预后不良,但对于PTEN缺失影响EGFR-TKIs疗效的机制,仍需要进一步探讨。
2.3 间变性淋巴瘤激酶(ALK)
ALK重排不超过NSCLC总数的3%~5%,但它是继EGFR之后第二个使NSCLC治疗策略发生重大改革的靶向基因[20]。ALK与包括EML4、HIP1和TPR在内的基因融合,通过异常激活下游信 号,如Ras/MAPK、PI3K/AKT和JAK/STAT通路,促进癌症的发生发展[21]。有研究发现,在西方患者中ALK重排的发生与EGFR突变相互排斥[22]。近年来,随着检测方法变得更加敏感,共突变检出的频率越来越高,有研究发现存在EGFR突变伴随ALK重排的NSCLC患者,其发生率为0.45%~1.6%,占EGFR突变的3.9%~13.6%,占ALK重排患者的15.4%~18.8%[23-25]。
一项针对中国患者的研究发现,EML4-ALK/EGFR共突变患者发生率(3.06%,11/359)显著低于非EML4-ALK/EGFR共突变患者(16.67%,10/60,P<0.01),在使用EGFR-TKI治疗后EML4-ALK/EGFR共突变患者(n=7)的PFS显著短于非EML4-ALK/EGFR共突变患者(n=8)(6.0个月vs15.0个月,P=0.046),该研究说明EML4-ALK/EGFR共突变和非EML4-ALK/EGFR共突变显示出不同的临床特征且对EGFR-TKI的敏感性存在差异,EML4-ALK/EGFR共突变的患者预后相对较差[26](见表1)。
在Lou等[27]的研究中,入组了118名晚期NSCLC患者进行靶向治疗,10例EGFR/ALK共突变的患者中有9例对一线EGFR-TKI有良好的反应,EGFR-TKI对EGFR/ALK共改变和仅EGFR突变患者的ORR分别为80%(8/10)和65.5%(55/84)(P=0.57),PFS分别为11.2个月和13.2个月(HR=0.95,95%CI:0.49~1.84,P=0.87)。而克唑替尼对EGFR/ALK共改变患者和对仅ALK重排患者的ORR分别为40%(2/5)和73.9%(1/23)(P=0.29),中位PFS分别为1.9个月和6.9个月(HR=0.40;95%CI:0.15~1.10,P=0.08)。针对EGFR突变、ALK重排和EGFR/ALK共改变3种不同的突变类型进行生存分析,发现其中位生存期分别为21.3个月、23.7个月和18.5个月(P=0.06),其中ALK重排和EGFR/ALK共突变的中位总生存期差异有统计学意义(P=0.03)[27](见表1)。以上研究证明EGFR/ALK共突变与NSCLC预后不良相关,且EML4-ALK/EGFR共突变的患者预后相对较差。
2.4 肝细胞生长因子受体(MET)
MET基因属于共突变中的多重驱动基因突变类型,其发生率较低。在Zhong等[16]的研究中,通过对11例原发性耐药患者和11例对EGFR-TKIs敏感的患者进行对比分析,结果在2名原发耐药患者中检测到MET扩增,约占总数的18.2%[16]。
MET受体是跨膜酪氨酸激酶,它可以通过与配体肝细胞生长因子结合来激活下游的RAS/RAF/MAPK和PI3K/AKT/mTOR等信号传导途径,从而介导肿瘤细胞的增殖、迁移和侵袭[28-29]。
目前MET基因扩增已被认为是EGFR-TKIs耐药的常见机制,且伴随MET基因扩增提示与预后差相关[30]。在体外实验中,通过对吉非替尼耐药的HCC827细胞(EGFR外显子19突变扩增)进行检测后发现MET基因扩增通过erbB3以与EGFR相同的方式激活PI3K信号传导,从而导致了肿瘤细胞对EGFR-TKIs产生抵抗。同时该研究在22%(18/4)对吉非替尼或厄洛替尼获得性耐药的NSCLC标本中检测到了MET基因扩增[31]。
Lai等[32]对200例EGFR突变阳性的患者进行MET荧光原位杂交,将每个细胞核≥5个拷贝视为MET表达高,结果显示MET表达高和MET表达低患者的ORR分别为74.4%和53.9%(P=0.033),而治疗失败的中位时间在这两组中相似(12.2个月vs13.1个月)[32](见表1)。以上研究表明EGFR合并MET扩增导致EGFR突变阳性的患者对EGFR-TKIs发生原发性耐药。
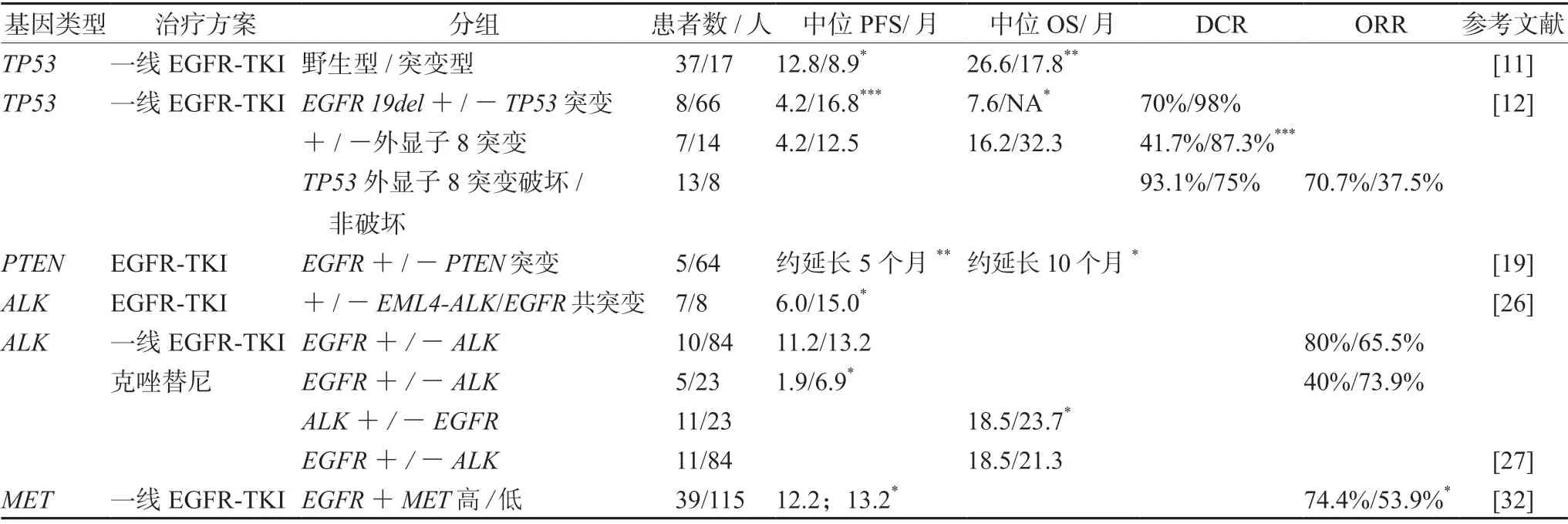
表1 常见EGFR共突变基因疗效比较Tab 1 Efficacy of common EGFR co-mutation genes
3 治疗策略
3.1 EGFR-TKI联合化疗
EGFR-TKIs仍为EGFR突变阳性的晚期NSCLC患者的一线标准治疗方案,但目前不少研究证明EGFR-TKIs联合化疗相比EGFR-TKIs单药能给患者带来更长的生存期。
NEJ005研究显示吉非替尼联合化疗同期方案和序贯方案的PFS分别为17.5个月和15.3个月(P=0.13),OS分别为41.9个月和30.7个月(P=0.036)[33]。此项研究证实,EGFR-TKIs联合化疗同步较序贯治疗能获得更大的临床效益。
在NEJ009研究中,在晚期EGFR突变NSCLC患者中比较了吉非替尼单药与吉非替尼联合培美曲塞和卡铂的疗效,联合治疗组的ORR和PFS均优于吉非替尼组[ORR,84%vs67%(P<0.001);PFS,20.9个月vs11.9个月(P=0.001)],同时联合组的OS也显著长于吉非替尼组(50.9个月vs38.8个月;HR0.722;P=0.021)。但是联合治疗组≥3级治疗相关不良事件(如血液学毒性)的发生率高于吉非替尼组(65.3%vs31.0%)[34]。Cheng等[35]发现,在晚期EGFR突变NSCLC患者中,吉非替尼联合培美曲塞组的PFS显著长于吉非替尼组(15.8个月vs10.9个月;P=0.029)。对EGFR外显子19缺失和EGFR外显子21 L858R点突变进行亚组分析,结果显示,吉非替尼联合培美曲塞治疗未能明显改善21 L858R亚组患者的PFS[HR=0.58,95%CI(0.33~1.01)]。
目前并没有针对于EGFR共突变患者使用EGFR-TKIs联合化疗的临床研究,但针对EGFR敏感突变的NSCLC患者来说,相较于EGFR-TKIs单药治疗而言,EGFR-TKIs联合化疗效果临床获益有所提高,可以成为克服EGFR共突变的一种备选治疗方案。但联合治疗组的患者不良反应的发生率也比单药组明显升高,在临床应用中应警惕不良反应的发生。
3.2 EGFR-TKI联合抗血管生成治疗
临床前研究证明,激活EGFR途径可增加肿瘤相关血管内皮生长因子(VEGF)的产生,其以旁分泌方式作用于内皮细胞以促进血管生成。因此,使用EGFR抑制剂的同时伴随着VEGF表达的下调,且肿瘤细胞对EGFR抑制剂的耐药性与VEGF水平的上调相关[36]。这为EGFR-TKIs与抗血管生成药物的联合使用提供了理论依据。
近年来关于EGFR-TKIs联合抗血管生成药物治疗EGFR突变的晚期NSCLC患者的研究越来越多,均得到不错的预期疗效。一项多中心、随机试验JO25567入组154例携带EGFR突变的患者,分为厄洛替尼组和厄洛替尼联合贝伐珠单抗组。结果显示联合治疗组和厄洛替尼组的中位PFS分别为16.4个月和9.8个月(HR=0.52,P=0.0005),中位OS分别为47.0个月和47.4个月(HR=0.81,P=0.3267),5年OS率分别为41%和35%,表明抗血管生成药物联合EGFR-TKIs治疗EGFR突变的晚期NSCLC的疗效优于EGFR-TKI单药治疗[37]。在另一项Ⅲ期随机试验NEJ026中,扩大了入组的患者数,将224名携带EGFR突变的患者同样分为厄洛替尼组和厄洛替尼联合贝伐珠单抗组,该研究得到同样的结论,联合治疗组的中位PFS为16.9个月,厄洛替尼单药组为13.3个月(P=0.016)[38]。
中国研究者发起了一项针对EGFR突变阳性的晚期NSCLC人群的多中心、随机对照、开放性Ⅲ期临床研究CTONG1509,一组为EGFR-TKI单药治疗模式,另一组为EGFR-TKI联合贝伐珠单抗。贝伐珠单抗联合厄洛替尼组和厄洛替尼单药组的中位PFS分别为18.0个月和11.3个月[HR=0.55,95%CI(0.41~0.75);P<0.001]。此外,针对19外显子缺失和21 L858R这两种最经典的EGFR突变亚型进行亚组分析,结果显示21 L858R突变患者接受联合治疗的获益更加显著,其中位PFS达19.5个月,比TKI单药的9.7个月延长了近10个月。而联合治疗模式主要的不良事件为蛋白尿和高血压,与EGFR-TKI单药治疗相比,3级及以上不良事件发生率分别是18.5%vs3.3%、8.3%vs0,虽然联合治疗的不良事件发生率有所上升,但仍在可控可管理的范围内[39]。
ALTER-L004是一项针对EGFR突变阳性伴有共突变的晚期NSCLC患者的临床研究。数据截止至2020年4月30日,共入组34名患者,其中包括伴随TP53(14/34)、ALK(1/34)、RB1(1/34)等基因与EGFR共突变,其使用安罗替尼联合埃克替尼治疗的ORR为70.6%,DCR为97.1%。而在数量最多的伴随TP53共突变的亚组中,1名(7.1%)患者得到完全缓解(CR),10名(71.4%)患者得到部分缓解(PR),3名(21.2%)患者病情稳定(SD),其ORR为78.5%,DCR为100%[40]。
以上研究结果表明EGFR-TKIs联合抗血管生成药物治疗EGFR突变的晚期NSCLC患者效果优于EGFR-TKIs单药,且对于伴随了EGFR共突变的患者同样具有潜在的疗效。
3.3 EGFR-TKI联合其他靶向药物
Zhao等[41]认为一代EGFR-TKIs和ALKTKIs对EGFR/ALK共突变的患者均有效,并且提出EGFR-TKIs和克唑替尼序贯治疗可以作为一种治疗选择。他们筛选出了26名EGFR/ALK共突变的患者(26/5816,4.47%),在22名适合进行生存分析的患者中,与95例仅EGFR突变的患者和60例仅ALK重排的患者进行对比分析。在进行EGFR-TKIs治疗后,EGFR突变患者和双突变患者的ORR分别为62.1%(59/95)和63.2(12/19)(P=0.93),PFS分别为11.4个月和10.3个月[HR0.96;95%CI(0.59~1.57);P=0.87]。而在进行克唑替尼治疗后,双突变患者和ALK重排患者的ORR分别为66.7%(8/12)和65.0%(39/60)(P=1.00),PFS分别为11.1个月和12.5个月[HR1.39;95%CI(0.69~2.80);P=0.28]。有9名EGFR/ALK共突变患者同时接受EGFRTKIs和克唑替尼治疗,其中8名在EGFR-TKIs治疗进展后接受克唑替尼治疗,另一名患者在接受克唑替尼治疗进展后接受EGFR-TKIs治疗。在该亚组中,EGFR-TKIs的ORR为55.6%(5/9),克唑替尼的ORR为66.7%(6/9)。在EGFR-TKIs治疗进展后,改用克唑替尼作为序贯疗法时,观察到PFS为15.0个月[41]。此研究表明,同时具有EGFR/ALK突变的患者使用EGFR-TKIs和克唑替尼与具有单一驱动基因突变的患者一样有效,且EGFR-TKIs治疗失败后克唑替尼可作为后续有效治疗方案。
在Lai等[32]的研究中,一名EGFRL858R突变合并MET扩增的患者在使用厄洛替尼治疗的1个月内发生了疾病进展,但在改用克唑替尼单药治疗后肺部病灶显著缩小。同时Li等[42]也报道了一名EGFR19号外显子缺失合并MET扩增的患者,在一线使用埃克替尼治疗后,该患者疾病进展,但在改用克唑替尼单药治疗后,患者肺部肿块明显缩小。这些研究表明,同时合并MET扩增的患者可能会受益于MET抑制剂。但这些研究仅为个案,还需要增加样本量进行进一步的验证。
目前有几项临床研究表明EGFR-TKIs联合MET抑制剂对EGFR突变合并MET扩增患者有效[43-45]。在INSIGHT研究中,Wu等[43]比较了EGFR-TKIs耐药后MET过表达或MET扩增的EGFR敏感突变NSCLC患者应用Tepotinib联合吉非替尼与标准化疗的临床疗效,结果显示在MET扩增(拷贝数≥5或MET/CEP7≥2)亚组(n=19)中,Tepotinib联合吉非替尼相比含铂双药化疗PFS和OS得到显著的延长,中位PFS分别为16.6个月和4.2个月[HR=0.13,90%CI(0.04,0.43)]。同样TATTON研究证实了奥希替尼联合MET抑制剂在MET扩增的EGFR突变NSCLC患者中显示出了良好的抗肿瘤效果和可靠的安全性[45]。因此,MET抑制剂单药治疗和联合EGFR-TKIs的治疗方案可能是EGFR突变合并MET扩增患者的潜在治疗策略,其中EGFRTKIs联合MET抑制剂的双靶向药治疗模式有可能成为未来的一线治疗选择。
EGFR-TKI针对EGFR基因突变患者的治疗效果毋庸置疑,但对于伴随多重驱动基因突变的患者的治疗方法存在争议。如果肿瘤细胞同时携带多种基因突变,相对应靶点的抑制剂进行联合治疗可能是一个潜在的合理选择。
4 小结与展望
本文对常见EGFR共突变基因进行综述,通过一系列的回顾性研究发现共突变基因的存在可能导致了EGFR突变患者对EGFR-TKIs产生原发性耐药,从而促进了肿瘤进展,限制了患者对靶向治疗的应答。
在EGFR突变的NSCLC中,癌基因和肿瘤抑制基因的共突变现象变得越来越常见,其中伴随TP53突变最为常见,其他还有伴随PTEN、ALK等突变。而目前研究表明EGFR共突变与预后不良相关,且根据突变类型的不同,对EGFRTKIs的敏感性也存在差异。相比较而言,伴随TP53外显子8或者EML4-ALK突变类型的患者对EGFR-TKIs的反应较差。
令人遗憾的是,针对此类型患者,目前为止并没有关于标准治疗方法的定论。但目前针对EGFR共突变治疗的研究已经引起全球专家的关注,EGFR共突变相关的临床研究取得一定的进展,提示我们进行联合治疗化疗、抗血管生成治疗或其他靶向药物联合EGFR-TKI疗法可能是目前增加患者生存获益的最佳选择。虽然进行了不同药物的叠加,但其毒性仍在可控范围,仍具有可靠的安全性。而具体选择何种联合方式,需要我们依据患者的具体情况进行探索。目前来看,EGFR伴随驱动基因突变的患者使用双靶向治疗模式能获得更好的临床效益,而EGFR伴随抑癌基因突变的患者可以选择EGFR-TKI联合化疗或抗血管生成治疗,EGFR-TKI联合抗血管生成药物在未来可能将会是一个可靠的治疗方向。
然而目前的研究以回顾性研究为主,且样本量较少,未来仍需要对EGFR共突变的耐药影响机制进行深入研究,探索不同突变基因对原发耐药的影响,并总结归纳开发出相对应的最优治疗模式,给患者带来更好的临床效益,EGFR共突变将是今后精准治疗的主要研究方向。
