留兰香不同提取物中香芹酮、柠檬烯的含量及其抑菌活性研究
2021-11-01万红才罗洪莲刘晓艳段萍徐作刚安军曾琦黔南州检验检测院贵州都匀558000
万红才,罗洪莲,刘晓艳,段萍,徐作刚,安军,曾琦(黔南州检验检测院,贵州 都匀 558000)
留兰香Mentha spicataL.为唇形科植物,全草入药,夏、秋两季采收,除去杂质,鲜用或阴干;留兰香具有疏风清热、解表和中、里气止痛之功效;用于感冒头痛、胃痛、咳嗽、腹胀、吐泻、痛经、肢麻、跌扑肿痛[1]。同时留兰香被人们作为食品广泛食用,还应用于食品化工不同行业,说明留兰香药用及食用保健的价值均得到广泛认同[2]。留兰香药材中香芹酮、柠檬烯是活性成分也是主要成分,本文拟建立气相色谱法对留兰香药材及其提取物中香芹酮、柠檬烯进行定量分析,并制订合理的限度,严格控制其质量;采用管碟法对留兰香药材提取物的抑菌活性进行探索,采用稀释倍数法[3]测定留兰香不同提取物对枯草芽孢杆菌、金黄色葡萄球菌、藤黄微球菌的最低抑菌浓度(MIC),为留兰香药用机制及食用领域的拓展开发提供实验依据,为留兰香药材的临床使用剂量提供参考。
1 仪器与试药
1.1 仪器
气相色谱仪(Aglient 7890B),紫外分光光度计(岛津2600),高压灭菌锅(LMQC-80E),超声波清洗仪(SK250LHC),电子天平(梅特勒托利多AG135,感量:0.01 mg),生化培养箱(SPX-250BⅢ),游标卡尺。
1.2 试药
香芹酮对照品(批号:c11052000,含量:99.0%)、正十一烷对照品(批号:c17896300,含量:99.6%)(德国Dr.Ehrenstorfer GmbH),柠檬烯对照品(批号:100470-201302,含量:96.0%)、枯草芽孢杆菌[批号:63501,每颗(1.0~2.0)×103cfu]、金黄色葡萄球菌[批号:33301,每颗(1.0~2.0)×103cfu]、藤黄微球菌[批号:28001-8a6-2,每颗(1.0~2.0)×103cfu]、菌株复溶液(批号:181105)(中国食品药品检定研究院);链霉素(批号:130308-201514,含量:726 U·mg-1)、新霉素(批号:130309-201512,含量:652 U·mg-1)、土霉素(批号:130305-201321,含量:872 U·mg-1)(对照品,中国食品药品检定研究院);其他试剂均为化学分析纯,无菌室及其他常用微生物测定器皿由药品检验微生物检测室提供。
1.3 样品
留兰香共10批次,经贵州省食品药品检验所李扬教授鉴定,均属于唇形科植物留兰香[4],样品信息见表1。

表1 样品信息Tab 1 Sample information
2 方法
2.1 香芹酮、柠檬烯含量测定气相色谱分析[5]
2.1.1 色谱条件及系统适用性试验 色谱柱HP-5弹性石英毛细管柱(30 m×0.32 mm×0.25 μm),检测器氢火焰离子化检测器(FID),载气为高纯氮气≥0.9999,柱流量线速度5 mL·min-1;程序升温条件初始温度50℃,以2℃·min-1升温至115℃,以5℃·min-1升温至150℃,气化室温度250℃,检测室温度280℃,分流比30∶1,尾吹20 mL,空气400 mL,氢气40 mL,进样量1 μL。在上述色谱条件下,样品中柠檬烯、内标物正十一烷、香芹酮成分的分离度、理论板数、拖尾因子、对称性均符合《中国药典》2020年版要求[6],空白样品无干扰(见图1)。

图1 混合对照品、供试品及内标溶液气相色谱图Fig 1 Gas chromatogram of mixed reference substance,test substance and internal standard solution
2.1.2 内标溶液的制备 取正十一烷对照品适量,精密称定,用正己烷稀释制成0.2 mg·mL-1的溶液作为内标溶液[6]。
2.1.3 对照品溶液的制备 取柠檬烯对照品10.44 mg,置于10 mL量瓶中,用内标溶液溶解并稀释至刻度,摇匀,作为柠檬烯对照品储备液;另取香芹酮对照品20.36 mg,置于100 mL量瓶中,加柠檬烯对照品储备液5.00 mL,用内标溶液溶解并稀释至刻度,摇匀,制成混合对照品溶液。
2.1.4 留兰香样品的制备 留兰香挥发油的制备参照《中国药典》2020年版四部通则2204挥发油测定法,准确称量干燥留兰香药材100 g,加入300 mL蒸馏水,连接至挥发油提取装置,采用常压水蒸气蒸馏法提取,得到淡黄色有特殊香味的油状物作为供试品挥发油[6];称取经粉碎的留兰香药材50 g,加乙醇400 mL,水浴加热回流提取1 h,滤过,重复提取2次,合并提取液,蒸干得供试品醇提浸膏;称取经粉碎的留兰香药材50 g,加水400 mL,热回流提取1 h,滤过,重复提取2次,合并提取液,蒸干得供试品水提浸膏。精密称取供试品挥发油、供试品醇提取浸膏、供试品水提取浸膏约0.5 g和干燥药材粉末约1.3 g,精密称定,分别置于50 mL量瓶中,加入适量内标溶液超声使溶解,放冷,用内标溶液稀释至刻度,摇匀,用0.45 μm微孔滤膜滤过,即得各供试品溶液。
2.1.5 线性关系考察 精密称取20.40 mg香芹酮对照品与10.23 mg柠檬烯对照品置10 mL量瓶中,用内标溶液溶解并稀释至刻度,作为混合对照溶液;分别精密量取混合对照溶液1.00 mL置于10、25、50、100、200 mL量瓶中,用内标溶液稀释至刻度,摇匀,得香芹酮0.204、0.0816、0.0408、0.0204、0.0102 mg·mL-1和柠檬烯0.1023、0.0409、0.0205、0.0102、0.0051 mg·mL-1的混合对照品溶液。取上述混合对照品溶液及“2.1.3”项下混合对照品溶液,按“2.1.1”项下色谱条件测定,记录色谱图,用内标法校正,分别以香芹酮、柠檬烯对照品溶液峰面积与内标溶液峰面积的校正值f(f=A样/A内)为纵坐标(Y),以香芹酮、柠檬烯对照品质量浓度C(mg·mL-1)为横坐标(X)分别绘制标准曲线,并进行线性回归,结果见表2。
2.1.6 精密度试验 取同一对照品溶液重复进样6次,结果f(f=A样/A内)统计值符合《中国药典》2020年版四部通则9101药品质量标准分析方法验证指导原则精密度要求[6](RSD≤2.0%),见表2。
2.1.7 稳定性试验 分别于0、4、8、12、16、20 h精密吸取编号201701留兰香药材挥发油样品,按“2.1.4”项下方法制备供试品,按“2.1.1”项下色谱条件测定,记录色谱图,结果见表2,说明各成分在20 h内稳定。
2.1.8 重复性试验 精密称取编号201701留兰香药材提取挥发油样品6份,按“2.1.4”项下方法制备供试品溶液,取供试品溶液及“2.1.3”项下对照品溶液,按“2.1.1”项下色谱条件测定,记录色谱图,按内标法以峰面积计算,结果见表2。

表2 香芹酮、柠檬烯方法学考察(n=6)Tab 2 Methodology for determination of carvone and limonene (n=6)
2.1.9 回收试验 称取编号201701原药材粉末约0.25 g,置10 mL量瓶中,精密量取混合对照品溶液(取柠檬烯、香芹酮对照品适量,加内标溶液制成每毫升含柠檬烯0.001 947 mg、香芹酮0.045 58 mg的混合对照品溶液)1.00、2.00、3.00 mL制成低、中、高质量浓度供试品溶液(各平行3份),分别用含内标物的正己烷溶解超声30 min,冷却后稀释至刻度,用0.45 μm微孔滤膜滤过,取续滤液作为供试品,按“2.1.1”项下方法测定,计算得香芹酮低、中、高质量浓度的平均回收率在96.2%~97.5%,柠檬烯低、中、高质量浓度的平均回收率在95.9%~99.8%,RSD均小于3%,符合2020年版《中国药典》要求。
2.1.10 香芹酮、柠檬烯含量测定结果 取采集的10个批次留兰香样品,按“2.1.4”项下方法制备供试品溶液,分别精密吸取“2.1.3”项下对照品溶液和上述供试品溶液1 μL进样测定,记录色谱图,按内标法以峰面积计算,结果见表3。

表3 留兰香不同提取方法香芹酮、柠檬烯含量测定(mg·g-1)Tab 3 Determination of carvone and limonene content with different extraction methods of Mentha spicata extract (mg·g-1)
2.2 留兰香药材抑菌活性测定
2.2.1 供试菌悬液制备 取枯草芽孢杆菌、金黄色葡萄球菌、藤黄微球菌分别加菌株复溶液复活,再加2%的蛋白胨稀释液稀释含菌量为106~109 cfu·mL-1的菌悬液作为供试菌悬液[7]。
2.2.2 培养皿制备 取经高压蒸汽灭菌冷却至45℃的琼脂培养基15 mL至无菌培养皿中,加供试菌悬液0.05 mL制成各菌种培养皿,每组平行制备3个。
2.2.3 标准品溶液的制备 精密称取链霉素、新霉素、土霉素标准品适量,分别加灭菌水稀释至约0.002、0.02、0.02 mg·mL-1的标准溶液[6]。
2.2.4 供试品溶液的制备 取“2.1.4”项下201701样品制备的供试品挥发油0.5 g,加灭菌水稀释至1.0 mg·mL-1的溶液,供试品醇提浸膏1.0 g加灭菌水稀释至10.0 mg·mL-1、供试品水提浸膏1.0 g加灭菌水稀释至10.0 mg·mL-1的溶液。
2.2.5 方法 参照《中国药典》2020年版四部通则1201抗生素微生物检定法管碟法测定。取各供试品溶液至枯草芽孢杆菌、金黄色葡萄球菌、藤黄微球菌培养皿中,每皿4碟,皿中1、3接种供试品溶液,2、4接种标准溶液,于37℃恒温箱培养16 h,测定抑菌圈直径[6],结果见表4。
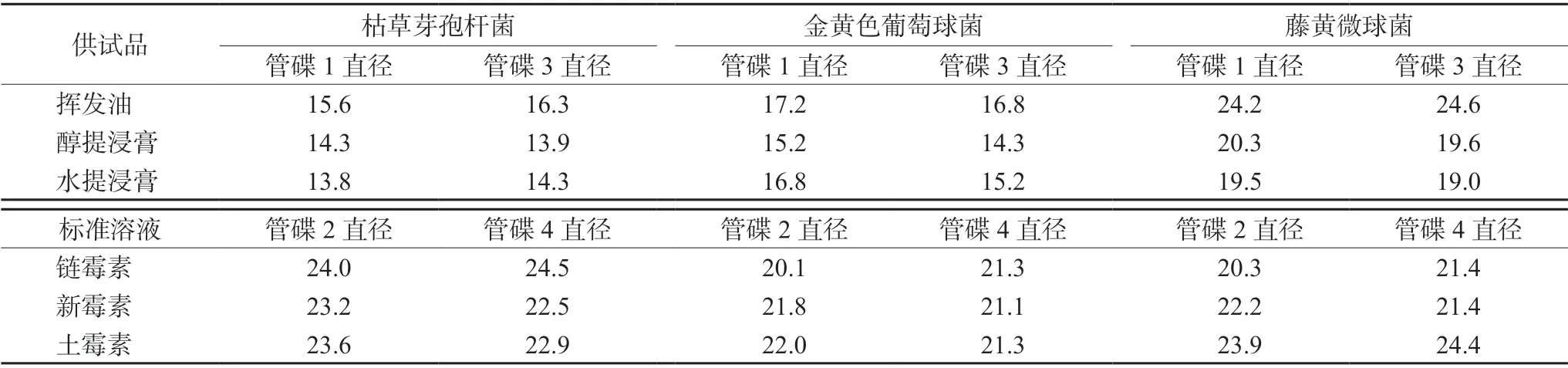
表4 供试品及标准溶液抑菌圈直径(mm)Tab 4 Antibacterial circle diameter of test product and standard solution (mm)
2.3 最低抑菌浓度测定
用稀释倍数法测定最低抑菌浓度,取“2.1.4”项下201701样品提取的供试品挥发油0.5 g、醇提浸膏1.0 g及水提浸膏1.0 g,分别加灭菌的2%蛋白胨灭菌稀释液稀释至50 mL为供试品挥发油溶液、供试品醇提浸膏溶液、供试品水提浸膏溶液,分别用微孔滤膜滤过装入无菌试管中备用。取试管38支,每支装9 mL胰酪蛋白培养基溶液,加压灭菌后,冷却备用,用灭菌的2%蛋白胨为稀释液,制备供试品挥发油质量浓度分别约为5、0.5、0.05 mg·mL-1和供试品醇提浸膏、供试品水提浸膏质量浓度分别约为10、1.0、0.01 mg·mL-1的溶液,同法制备0.01 mg·mL-1的罗红霉素对照品溶液,制备阳性对照管(加对照品溶液)与空白管。分别接种各实验菌液0.05 mL,于37℃恒温箱培养18 h后,取出,加5%的甲醛溶液抑制细菌再生长,在600 nm波长处测定吸光度[8],结果见表5。
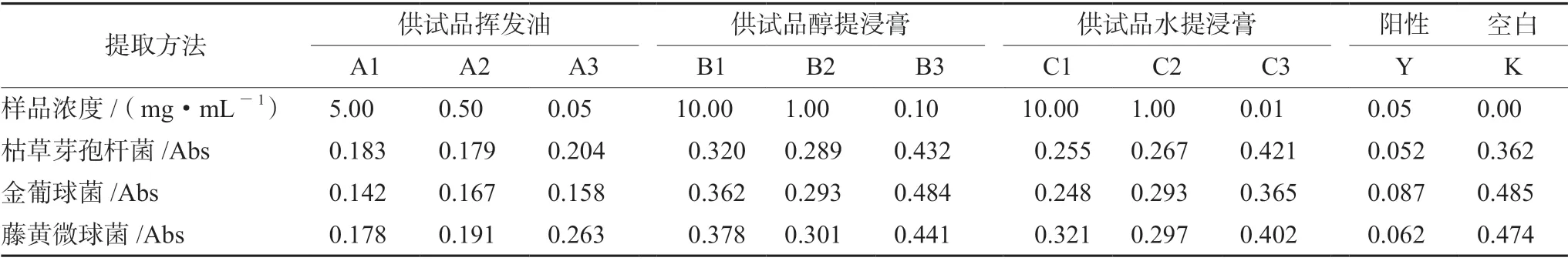
表5 培养管吸光度值表Tab 5 Absorbance of culture tubes
3 结果
3.1 香芹酮、柠檬烯气相分析结果
各样品中香芹酮、柠檬烯含量相对稳定,原药材中香芹酮达到0.38%以上、柠檬烯0.02%;挥发油中含量较高,香芹酮达到58.1%、柠檬烯2.7%;醇提浸膏以干燥浸膏计香芹酮18.5%、柠檬烯0.9%;水提浸膏以干燥浸膏计香芹酮12.2%、柠檬烯0.6%;该方法适用于留兰香药材各形态样品中香芹酮、柠檬烯测定。
3.2 抑菌活性与最低抑菌浓度分析结果
参照2020年版《中国药典》抗生素效价测定法及中药生物活性测定指导原则,对留兰香药材提取物进行抑菌活性实验,从表4中数据分析结果可知,该样品在不同菌株培养皿中均产生一定的抑菌效果,各抑菌圈直径与标准溶液一致;其中藤黄微球菌培养基灵敏度高,可作为该药材抑菌效价研究首选,同时对枯草芽孢杆菌、金黄色葡萄球菌产生抑菌活性,说明留兰香药材有广谱抑菌作用,可为临床用药提供依据。用稀释倍数法测定最低抑菌浓度,根据培养后观察菌群生长浊度及表5测定吸光度值(A)分析,留兰香药材各组供试品溶液的浊度及吸光度均不同,根据菌群生长浊度观察及吸光度数据分析,将A≤0.30定为有抑菌作用的样品浓度,得到供试品挥发油的MIC为0.05 mg·mL-1,供试品醇提浸膏和水提浸膏的MIC均为0.1 mg·mL-1。
4 讨论
4.1 色谱条件与样品处理的优化
根据文献对测定留兰香样品中香芹酮、柠檬烯成分的气相色谱条件进行优化,采用超声提取法作为样品前处理方法,耗时短(耗时30 min),操作简便;比较甲醇、乙醇、乙酸乙酯、正己烷等提取溶剂,从色谱图的干扰背景及待测成分回收率结果分析,选择用正己烷为提取溶剂效果最佳;内标法是减少气相色谱进样误差,选正十一烷作内标物,保留时间在被测物香芹酮、柠檬烯之间,并与两成分的分离度符合2020年版《中国药典》要求,并将内标物配制成0.2 mg·mL-1的溶液作为内标溶液,该浓度时色谱峰与待测组分一致,用内标溶液作溶剂,确保对照品与供试品溶液制备过程中内标物含量的稳定,减少分次加入内标物的浓度变化误差[9]。该分析方法系统适用性试验中,柠檬烯、内标物正十一烷、香芹酮成分的分离度、理论板数、拖尾因子、对称性均等参数均符合2020年版《中国药典》要求,优化的分析方法灵敏度高,易普及,可为留兰香药材及成品的质量控制提供参考。
4.2 抑菌活性与抑菌浓度研究意义
根据抑菌圈测定数据及最低抑菌浓度分析,留兰香药材对枯草芽孢杆菌、金黄色葡萄球菌、藤黄微球菌都有一定的抑制作用,结合气相色谱分析数据,提取方法不同各供试品溶液中香芹酮、柠檬烯成分含量不同,但提取方法与抑菌活性无显著关系,进一步证明单一的分析方法控制药材质量存在缺陷,用中药生物活性测定方法综合评价药材质量具有科学性。
