汉防己甲素调控Chk1基因对宫颈癌细胞增殖、凋亡及放射敏感性的影响
2021-11-01龚妙添杨桂生黄仕尧
龚妙添 杨桂生 黄仕尧
宫颈癌(cervical cancer)是世界八大恶性肿瘤之一,在女性恶性肿瘤中发病率居第二位,仅次于乳腺癌,据统计,全球每年宫颈癌新发病例约有53万例,死亡病例达27万[1]。宫颈癌的发病原因已逐渐明确,该病主要是由于高危型人乳头状瘤病毒(human papillomavirus,HPV)的持续感染,引起人体皮肤黏膜的鳞状上皮增殖,形成上皮内瘤[2]。根治性子宫切除术及辅助性放化疗是宫颈癌的主要治疗方式,可以在一定程度上提高宫颈癌患者的生存率,但多数转移性宫颈癌患者预后较差,并且随着放射治疗剂量的累积,肿瘤对于放射的敏感性减弱,严重影响放疗效果[3,4]。汉防己甲素(tetrandrine,Tet)是由中药粉防己的块根提取,又被称为粉防己碱,是一种双苄基异喹啉类生物碱,Tet为天然的非选择性钙离子通道阻滞剂,具有抗高血压、抗炎和抗纤维化等作用[5]。已有研究表明,Tet具有抗癌作用,在结肠癌[6]、膀胱癌[7]和肝癌[8]等疾病中,Tet可以抑制癌细胞的增殖、迁移侵袭,促进其凋亡,逆转上皮间质转化。为研究汉防己甲素在宫颈癌中的作用,本文通过体外培养宫颈癌Hela细胞的方法,探究汉防己甲素对宫颈癌细胞的增殖、凋亡和放射敏感性的影响,并探讨其作用机制,旨在为宫颈癌的治疗提供新理论依据。
1 材料与方法
1.1 材料 人宫颈癌细胞株Hela购自ATCC;DMEM培养基购自Gibco;胎牛血清、青霉素、链霉素购自杭州四季青公司;胰蛋白酶、噻唑蓝(MTT)、二甲基亚砜(DMSO)、汉防己甲素购于美国Sigma公司;Lipofectamine 2000转染试剂购自美国Invitrogen公司;Annexin V-FITC/PI凋亡检测试剂盒购自上海翊圣生物科技有限公司;BCA蛋白浓度测定试剂盒、SDS-PAGE试剂盒购自碧云天生物技术公司;反转录试剂盒、荧光定量试剂盒购自日本TaKaRa公司;PVDF膜、RIPA裂解液、ECL发光液购自北京Solarbio公司;吉姆萨(Giemsa)染液购自Applichem公司;control siRNA和Chk1 siRNA由山东维真生物科技有限公司设计合成;兔抗人Chk1多克隆抗体、兔抗人GAPDH多克隆抗体、HRP标记的山羊抗兔IgG购自Abcam公司。
1.2 方法
1.2.1 细胞培养:Hela细胞培养于DMEM培养基(含10% 胎牛血清、1% 青霉素和1% 链霉素)中,置于37℃、5% CO2及饱和湿度条件下的培养箱中培养,至细胞融合度达到80% 左右时加入胰蛋白酶进行细胞传代。
1.2.2 细胞转染:取对数生长期的细胞使用胰蛋白酶消化后重悬,以1×106个/孔接种至6孔板,按照Lipofectamine 2000说明书分别将control siRNA、Chk1 siRNA、pcDNA、pcDNA-Chk1转染至Hela细胞,记为si-NC组、si-Chk1组、pcDNA组、pcDNA-Chk1组;选择转染pcDNA和pcDNA-Chk1的细胞,在培养液中加入Tet并调整终浓度为5.00 μg/ml,常规培养48 h。
1.2.3 分组:将Hela细胞随机分为Con组、不同浓度Tet处理(0.01 μg/ml、0.10 μg/ml、1.00 μg/ml、5.00 μg/ml、10.00 μg/ml)组、Tet组。处理方法:Con组:不添加Tet;不同浓度Tet处理组:在细胞培养基中加入Tet并调整终浓度分别为0.01 μg/ml、0.10 μg/ml、1.00 μg/ml、5.00 μg/ml、10.00 μg/ml;Tet组:以含Tet终浓度为5.00 μg/ml的培养基培养细胞。每组6个复孔,重复3次。
1.3 qRT-PCR检测 收集Tet(5.00 μg/ml)处理的Hela细胞,研磨充分后加入Trizol试剂提取总RNA,微量核酸测定仪检测RNA纯度和浓度。使用逆转录试剂盒将RNA反转录成cDNA,采用TaKaRa 荧光定量试剂盒,按照使用说明配制反应体系,以GAPDH为内参进行PCR扩增,每个样品重复3次,采用2-ΔΔCt法分析基因相对表达量。
1.4 Western blot检测 加入RIPA裂解液裂解各组细胞,4℃,12 000 g离心15 min,收集蛋白上清液,BCA蛋白定量法检测蛋白浓度。将蛋白样品煮沸变性冷却至室温后,进行SDS-PAGE电泳,转至PVDF膜后,5%脱脂奶粉室温封闭2 h。分别加入Chk1抗体(1∶500)和GAPDH抗体(1∶1 000),4℃孵育过夜,TBST洗膜3次;加入HRP标记的山羊抗兔IgG(1∶2 000)室温孵育2 h,TBST洗膜3次。采用ECL化学发光法检测蛋白的表达,计算相对灰度值。每个蛋白样品重复3次。
1.5 MTT检测细胞增殖 在上述各组细胞培养至24 h、48 h、72 h时加入20 μl(5 g/L)的MTT溶液,37℃继续培养4 h,弃掉培养液,每孔加入150 μl DMSO,置于摇床上室温振荡10 min,用酶标仪测定490 nm处的吸光度(A),计算细胞增殖抑制率,抑制率(%)=(1-实验组A值/对照组A值)×100%。
1.6 流式细胞仪检测细胞凋亡 在上述各组细胞培养至48 h后弃掉培养基,PBS洗涤,用无EDTA的胰酶消化细胞后,4℃、300 g离心10 min收集,加入PBS制成细胞悬液。按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书,加入5 μl FITC标记的Annexin-V和5 μl PI轻轻混匀,室温下避光孵育15 min,流式细胞术检测细胞凋亡。
1.7 克隆形成实验 取上述各组细胞经胰酶消化计数后,制成细胞悬液,按照射剂量将不同数目细胞接种于6孔板中,待细胞贴壁后每板分别以0、2、4、6、8 Gy的剂量进行照射,继续培养至出现肉眼可见的克隆形成,倒掉培养基,PBS洗涤,甲醇固定10 min,吉姆萨染色10 min,清洗染液,晾干后计数细胞数>50个的克隆。使用GraphPad Prism 7软件进行单击多靶模型拟合细胞存活曲线,计算平均致死剂量(D0)、准阈剂量(Dq)、存活分数(SF2)、放射增敏比(SER)。

2 结果
2.1 不同浓度Tet对宫颈癌Hela细胞增殖抑制的影响 MTT法检测结果,不同浓度Tet(0.01 μg/ml、0.10 μg/ml、1.00 μg/ml、5.00 μg/ml、10.00 μg/ml)处理后的Hela细胞,随着培养时间的延长,细胞增殖抑制率逐渐升高,具有浓度依赖性。选取作用时间48 h,5.00 μg/ml的Tet浓度(抑制率约为50%)用作后续实验。见表1。

表1 不同浓度汉防己甲素对Hela细胞增殖抑制的影响
2.2 Tet对宫颈癌Hela细胞凋亡的影响 流式细胞仪检测结果,与Con组比较,Tet(5.00 μg/ml)处理后的宫颈癌Hela细胞其凋亡率显著增加(P<0.05)。见图1,表2。
2.3 Tet对宫颈癌Hela细胞放射敏感性的影响 以不同剂量(0、2、4、6、8Gy)X线照射各组细胞,与Con组比较,Tet组Hela细胞存活分数明显降低(P<0.05);单击多靶模型参数,D0和Dq分别由Con组的2.621、1.297降低为Tet组的1.458和0.460,SER放射增敏比为1.798,表明,Tet可增强Hela细胞放射敏感性。见表3。
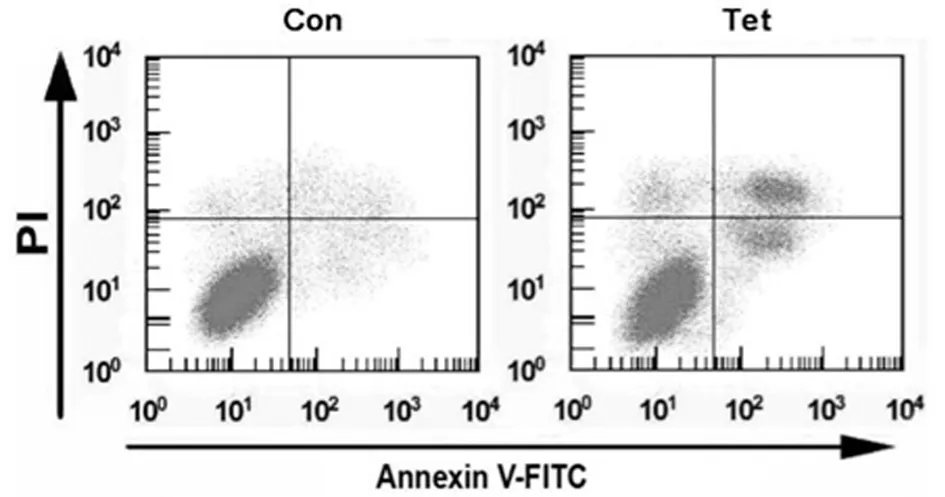
图1 汉防己甲素对Hela细胞凋亡的影响

表2 汉防己甲素对Hela细胞凋亡的影响

表3 单击多靶模型参数
2.4 Tet对宫颈癌Hela细胞中Chk1基因表达的影响 qRT-PCR和western blot检测结果,与Con组比较,Tet组宫颈癌Hela细胞中Chk1基因在mRNA和蛋白水平的表达均显著降低(P<0.05)。见图2,表4。

图2 汉防己甲素对Hela细胞中Chk1基因表达的影响

表4 汉防己甲素对Hela细胞中Chk1基因表达的影响
2.5 抑制Chk1表达对宫颈癌Hela细胞增殖、凋亡、放射敏感性的影响 转染Chk1 siRNA至Hela细胞,与si-NC组比较,si-Chk1组的Chk1蛋白表达显著降低,细胞的增殖抑制率与细胞凋亡率均显著升高(P<0.05);以不同剂量(0、2、4、6、8Gy)X线照射后,与si-NC组比较,si-Chk1组Hela细胞存活分数明显降低(P<0.05),SER放射增敏比为1.542,表明,抑制Chk1表达可增强Hela细胞放射敏感性。见图3,表5、6。
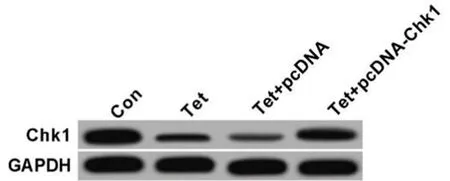
图3 Chk1蛋白相对表达量
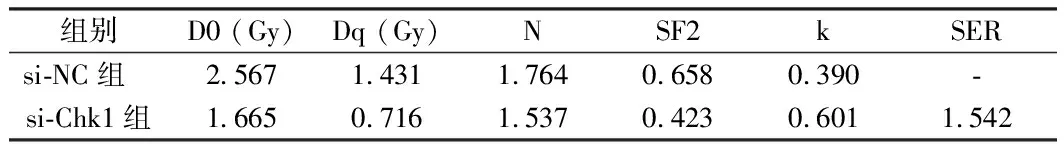
组别D0 (Gy)Dq (Gy)NSF2kSERsi-NC组 2.5671.4311.7640.6580.390-si-Chk1组1.6650.7161.5370.4230.6011.542

表6 抑制Chk1表达对Hela细胞增殖、凋亡的影响
2.6 过表达Chk1逆转了Tet对宫颈癌Hela细胞增殖、凋亡和放射敏感性的影响 以Tet(5.00 μg/ml)处理Hela细胞,与Con组相比,Tet组Chk1蛋白表达量显著降低,Hela细胞的增殖抑制率和细胞凋亡率明显升高,Tet组Hela细胞存活分数明显降低(P<0.05);转染pcDNA-Chk1至Hela细胞,并经过Tet(5.00 μg/ml)处理后,与Tet+pcDNA组比较,Tet+pcDNA-Chk1组Chk1蛋白表达量显著升高,Hela细胞的增殖抑制率与细胞凋亡率均显著降低,Tet+pcDNA-Chk1组Hela细胞存活分数明显升高(P<0.05)。提示,过表达Chk1逆转了Tet对Hela细胞增殖、凋亡和放射敏感性的影响。见表7、8,图4。
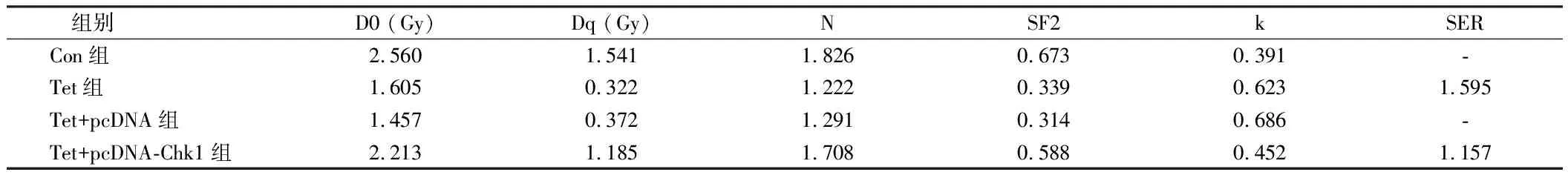
表7 单击多靶模型参数

表8 过表达Chk1逆转了汉防己甲素对Hela细胞增殖、凋亡的影响
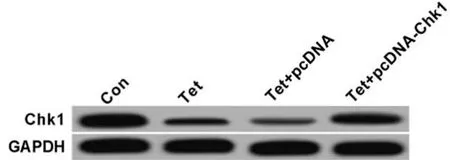
图4 Chk1蛋白相对表达量
3 讨论
宫颈癌的发生与环境卫生、居住地域、受教育水平、HPV疫苗覆盖率等多种因素有关[9,10]。全球85%的宫颈癌病例发生在发展中国家,在我国城市地区,与农村地区相比,宫颈癌发病率较高,死亡率较低,2013年我国宫颈癌新发病例为10万,死亡病例为2.6万,其发病率和死亡率随年龄增长而增加[11]。由于宫颈癌早期症状不明显,多数患者就诊时已处于局部晚期,对于局部晚期宫颈癌,放疗是最主要的治疗手段之一,但易复发且对放化疗耐受[12]。因此,探究新的宫颈癌治疗药物及其作用机制具有重要意义。
Tet是从汉防己块根中提取的有效活性成分,越来越多的研究发现,Tet具有一定的抗肿瘤作用,例如,在肺癌中,Tet能够抑制肺癌细胞的增殖,诱导其凋亡[13]。王君等[14]研究发现,最大非毒性剂量Tet联合放疗后可以去除放疗导致的G2/M期阻滞,增加放疗引起的鼻咽癌细胞的DNA断裂及细胞凋亡。新近研究发现,Tet呈浓度和时间依赖性抑制乳腺癌细胞增殖,诱导癌细胞G1期阻滞,降低Bcl-2的蛋白水平,促进癌细胞的凋亡[15]。本研究发现,Tet能明显抑制宫颈癌Hela细胞的增殖,且呈浓度依赖性;经过5.00 μg/ml浓度的Tet处理的Hela细胞其凋亡率明显升高,并且Hela细胞的放射敏感性显著增强。
细胞周期检测点激酶1(cell cycle checkpoint kinase 1,Chk1)是细胞周期检测点的转导因子,Chk1在肿瘤的发生、发展过程及细胞复制的调节过程中具有重要作用,Chk1抑制剂与DNA损伤试剂联用可以增强抗肿瘤的疗效[16,17]。有研究发现,Chk1在肺癌[18]、肝癌[19]的组织或细胞系中呈高表达。Zhou等[20]研究表明,在三阴性乳腺癌中,Chk1抑制剂可影响癌细胞的增殖,增加癌细胞的放射敏感性。在宫颈癌中,沉默Chk1的表达抑制了Hela细胞的增殖,并且能够增强Hela细胞的放射敏感性[21]。本研究发现,沉默Chk1基因后,Hela细胞中的Chk1蛋白表达量显著降低,Hela细胞的增殖抑制率和凋亡率显著升高,对放射照射的敏感性显著增加,这与前人研究结果[21]一致。Tet(5.00 μg/ml)处理后Hela细胞中Chk1基因在mRNA和蛋白水平的表达均显著降低;转染pcDNA-Chk1至Hela细胞,并经过Tet(5.00 μg/ml)处理后,Chk1蛋白表达量显著升高,细胞增殖抑制率与细胞凋亡率均显著降低,经过放射照射Hela细胞存活分数明显升高。表明过表达Chk1逆转了Tet对Hela细胞增殖、凋亡和放射敏感性的影响。
综上所述,Tet可抑制Hela细胞的增殖,促进细胞凋亡,增强细胞放射敏感性,其机制可能与Tet抑制Chk1基因的表达有关。本研究探讨了Tet对宫颈癌细胞增殖、凋亡和放射敏感性的影响及其分子机制,这为汉防己甲素治疗宫颈癌提供了新的理论依据。
