过表达miRNA-217由P13/AKT信号通路促进膀胱癌T24细胞增殖作用
2021-11-01陈先平窦红珍刘庆丰宋志东陈康
陈先平 窦红珍 刘庆丰 宋志东 陈康
膀胱癌是泌尿系统中最为常见的恶性肿瘤,男性发病率显著高于女性。膀胱癌具有时间上反复发作和空间上多中心性的特点,并且具有局部浸润转移、术后复发率高的生物学特点[1]。微小RNA(miRNA)是真核生物以及某些大型病毒中存在的,长度为20~24个核苷酸的一类内源性非编码单链小分子RNA。miRNA具有调节性,可与mRNA的3’UTR互补结合,使mRNA的翻译被抑制或导致mRNA的稳定性降低,从而负调节mRNA的表达[2],进而调控细胞发育、分化以及凋亡等多种生物学功能[3]。miRNA表达的异常以及生物合成的紊乱是许多癌细胞的重要特征,研究表明,不同的miRNA在肿瘤发生过程中发挥抑癌或致癌的不同功能[4]。例如miRNA-143可以抑制结直肠癌细胞的侵袭能力,而miRNA-15a的下调或缺失会导致抗凋亡基因bcl2的表达量升高,引起淋巴瘤和白血病的发生[5]。本研究通过对膀胱癌组织和T24细胞株的研究,探讨miRNA-217对T24细胞增殖、侵袭、迁移的影响及其可能的作用机制,为临床治疗膀胱癌提供新的思路。
1 资料与方法
1.1 一般资料 收集2017年12月至2018年4月于我院接受手术治疗的80例膀胱癌患者癌组织及距离癌组织超过2 cm处的正常组织,用以上组织构建膀胱癌组织芯片。在免疫组织化学染色后有16例组织标本出现不同程度缺失,其余64例标本经组织病理学检测证实为原发性膀胱癌,并纳入研究。其中男28例,女36例;年龄40~75岁,平均年龄(54.01±6.21)岁;术前患者均未进行放化疗。所有患者同意本研究并签署知情同意书,且经我院伦理委员会审核批准后收集标本。
1.2 材料 人源膀胱癌细胞株T24购自上海博古生物技术有限公司。慢病毒过表达载体RSK4-miRNA-217、阴性对照RSK4-NC及miRNA-217、U6引物均由上海吉玛制药技术有限公司设计完成。DMEM培养基(D777)、蛋白定量试剂盒于TOYOBO采购;Trizol reagent(9009)采购自TaKaRa;ECL化学发光试剂盒购自美国 Advansta、Transwell小室采购自BD;抗体购自碧云天有限公司;10~12周无特定病原体(specific pathogen free,SPF)级雄性 SD 大鼠,体重200~230 g,购自北京维通达生物技术有限公司[生产许可证号:SYXK(京)2017-005],裸鼠实验遵循动物保护和做好动物福利规定,并经实验动物伦理委员会批准。苏净Airtech超净工作台;三洋 MCO-15AC细胞培养箱;尼康 Ti-U/Ti-s倒置荧光显微镜;艾本德5810R 型高速离心机;罗氏 R480实时荧光定量PCR仪;蔡司LSM710共聚焦激光扫描显微镜。
1.3 方法
1.3.1 qRT-PCR:采用Trizol法提取各组细胞及组织中总RNA并进行反转录,按照PrimeScrip反转录试剂盒进行反转录成cDNA,采用SYBR Premix Ex Taq说明书配置PCR反应体系,反应过程:①预变性:75℃,120 s;②变性:90℃,5 min;③退火:60℃,60 s;④延伸72℃,30 s;⑤PCR仪采集荧光信号40个循环,每个样本独立重复实验5 次。U6作为内参(上游引物为5’-AACAGAGATGAGCCTTGTGC-3’,下游引物为5’-CGTACGTAGTCGAACCGAGA-3’), 目的基因miR-217(上游引物为5’-CCATATCGCTGGATGACGAT-3’,下游引物为5’-GCCGTGGGGTGTTCAATACT-3’),Jagged-1的mRNA(上游引物为 5’-CTCGCTTCGGCAGCACA-3’,下游引物为 5’AACGCTTCACGAATTTGCGT-3’),目的基因相对表达量用2-ΔΔCT表示;每个样本独立重复测量3次。
1.3.2 细胞培养及转染:将T24细胞接种于含有灭活的10%胎牛血清的DMEM培养基中,置于生化培养箱中培养,条件37℃,5%CO2,当细胞生长密度达85%时,胰蛋白酶消化传代。取对数生长期细胞进行转染,调整膀胱癌T24细胞株浓度至1×106个/ml,采用Lipofectamine 2000将浓度均为100 nmol/L的RSK4-miRNA-217和RSK4-NC慢病毒载体转染至细胞,细胞分为RSK4-miRNA-217组、RSK4-NC组以不转染的T24细胞作为空白对照组。
1.3.3 CCK-8及平板克隆实验检测miR-217对T24细胞增殖的影响:将各组按照每孔500~1 000个密度铺至96 孔板,轻轻混匀后,置入37℃培养箱继续培养,细胞继续培养0、24、48、72、96 h,每孔加CCK-8 10 μl,37℃避光4 h 后,弃掉孔内液体,再加DMSO各100 μl,置于37℃摇床上快速振荡15 min,以便充分溶解结晶物,最后将96 孔板置于酶标仪上检测 450 nm 处的OD值。将上述2种稳转细胞按每孔5 000个密度铺6孔板继续培养,隔周更换新鲜培养液,2周后用考马斯亮蓝染色,记录菌落形成数量。
1.3.4 裸鼠皮下荷瘤模型:调整细胞浓度,以1×105个/孔接种于96孔培养板中,分组处理同上,轻轻混匀后,置入37℃培养箱继续培养,待生长密度达到1×106个/ml时,消化细胞,200 r/min离心5 min,弃掉上清液,加入500 μl PBS缓冲液,避光放置于冰上,同时备好2 ml注射器。4周雄性裸鼠,随机分为3组,每组6只。用10%的水合氯醛将已经禁食12 h的SD大鼠麻醉后(每组6只),将1 ml细胞悬液注射进裸鼠右前肢下部皮肤。接种第5天后能观察到原位肿瘤。同时使用活体成像系统(IVIS)来检测生物信号强度(备注:检测前10 min,需以150 mg/kg剂量腹腔注射Luciferin)。7 d后裸鼠皮下成瘤,之后每隔3 d用游标卡尺测1次移植瘤长径(a)和短径(b),并计算肿瘤体积(V)=ab2/2,绘制肿瘤生长曲线。
1.3.5 生物信息学预测及双荧光素酶报告基因验证miR-217和PI3K的关系:根据www.microRNA.org网站预测miR-217和PI3K的结合片段。采用PCR扩增含有miR-217、PI3K结合位点的Dicer1片段,并将扩增的该片段插入荧光素酶载体psi-CHECK中,构建野生型质粒psi-CHECK-PI3K-wild,同时将结合片段中的核苷酸进行基因突变,并构建突变型质粒psi-CHECK-PI3K-mutant。将miR-217及阴性对照分别与野生型质粒psi-CHECK-PI3K-wild和突变型质粒psi-CHECK-PI3K-mutant共转染至293FT细胞,以空载质粒做为对照。24 h后,根据双荧光素酶检测试剂盒说明书测定荧光素酶活性,萤火虫荧光素酶/海肾荧光素酶活性值即为报告基因活性。
1.3.6 Western blot检测:调整细胞浓度,按1×105个/孔接种于6孔培养板中,分组处理同上,置入5%CO2、37℃培养箱12 h,加入裂解液,常规方法提取各组细胞中的FRY和NRP1,BCA测定蛋白含量,取50 μg 蛋白上样,SDS-PAGE凝胶电泳结束后,转至PVDF膜,封闭,加入相应一抗(1∶2 000),维持4℃过夜孵育,次日PBS漂洗,加入二抗(1∶5 000),PBS漂洗,ECL显色。Image Quant软件扫描并分析相应蛋白的灰度值,用GAPDH为内参蛋白,来计算目标蛋白的相对表达量。

2 结果
2.1 膀胱癌组织和正常组织中miRNA-217、PI3K、p-AKT和E2F3表达 qRT-PCR结果显示,miRNA-217在膀胱癌组织中的表达明显高于正常组织(P<0.05);Western blot检测结果显示P13K/AKT信号通路中PI3K、P-AKT及E2F3蛋白在膀胱癌组织表达明显高于正常组织,差异均有统计学意义(P<0.05)。见表1,图1。

表1 miR-217、PI3K、p-AKT和E2F3相对表达量
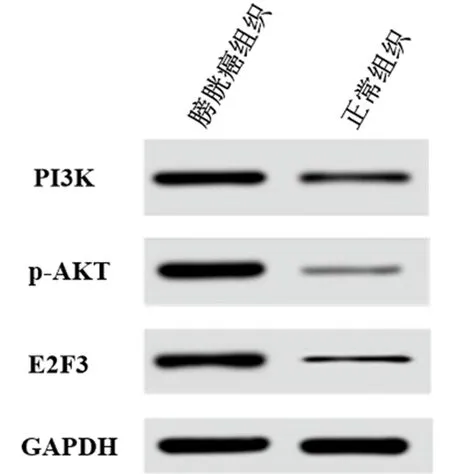
图1 miRNA-217、PI3K、p-AKT和E2F3在膀胱癌组织和正常组织表达
2.2 细胞系构建 qRT-PCR结果显示,空白对照组、RSK4-NC组和RSK4-miRNA-217组细胞中miRNA-217的相对表达量分别为0.97±0.18、1.02±0.10和1.82±0.15,与空白对照组和RSK4-NC组比较,RSK4-miRNA-217组细胞中miRNA-217的表达量明显升高,差异有统计学意义(P<0.05),空白对照组和RSK4-NC组miRNA-217的表达差异无统计学意义(P>0.05),提示成功构建miRNA-217过表达细胞系。
2.3 CCK-8检测miRNA-217对细胞增殖能力的影响 CCK-8实验结果显示,与空白对照组和RSK4-NC组比较,RSK4-miRNA-217组细胞OD450明显升高,差异有统计学意义(P<0.05);平板克隆实验结果显示,过表达miRNA-217后,RSK4-miRNA-217组细胞克隆数明显增加,差异有统计学意义(P<0.05);空白对照组和RSK4-NC组细胞增殖和细胞克隆数差异无统计学意义(P>0.05)。见图2,表2。
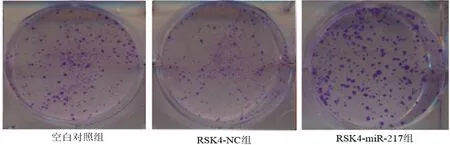
图2 平板克隆实验检测细胞增殖

表2 miRNA-217对T24细胞增殖能力的影响
2.4 裸鼠皮下成瘤能力 空白对照组、RSK4-NC组和RSK4-miRNA-217组移植瘤体积分别为(20.02±1.53)mm3、(21.12±1.60)mm3和(46.65±3.25)mm3,与空白对照组和RSK4-NC组比较,RSK4-miRNA-217组细胞移植瘤体积明显增大,差异有统计学意义(P<0.05);空白对照组和RSK4-NC组细胞间差异无统计学意义(P>0.05)。见图3。
2.5 miR-217和PI3K关系预测及验证 经www.
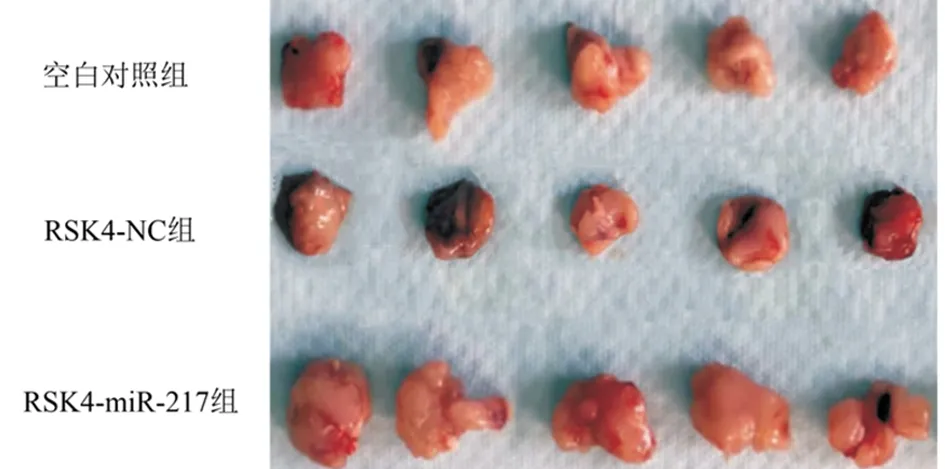
图3 miRNA-217对裸鼠皮下成瘤能力增殖能力的影响
microRNA.org网站预测发现miR-217和PI3K之间有互补结合序列,提示两者具有靶向调控关系。双荧光素酶报告实验显示,miR-217能显著抑制野生型psi-CHECK-PI3K-wild的荧光素梅活性(P<0.05),而对突变型psi-CHECK-PI3K-mutant的荧光素酶活性无影响(P>0.05)。说明miR-217能特异性结合PI3K。见图4,表3。
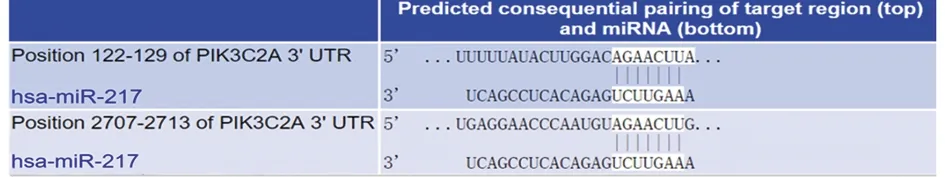
图4 www.microRNA.org网站预测miR-217和PI3K的结合位点

表3 双荧光素酶报告基因检测结果
2.6 miRNA-217对T24细胞PI3K、p-AKT、E2F3表达的影响 Western blot 结果显示,与空白对照组和RSK4-NC组比较,RSK4-miRNA-217组细胞PI3K、p-AKT、E2F3蛋白表达明显升高,差异有统计学意义(P<0.05),在空白对照组和RSK4-NC组细胞中差异无统计学意义(P>0.05)。见表4,图5。

表4 PI3K、p-AKT和E2F3在T24细胞中相对表达量
3 讨论
膀胱癌因其发病位置比较隐蔽,不容易检查,且早期症状复杂,缺少明显的特征,所以往往被忽视,导致诊断和治疗延误,所以确诊时一般多属癌症中期或者晚期,已经不能进行手术切除或者局部放疗,且其预后较差[6],给患者的家庭和社会均带来沉重的负担。因此从分子生物学角度出发寻找其进展和转移的标志物,对于患者选择合适的治疗方法和预后指标的判定有着重要的意义。
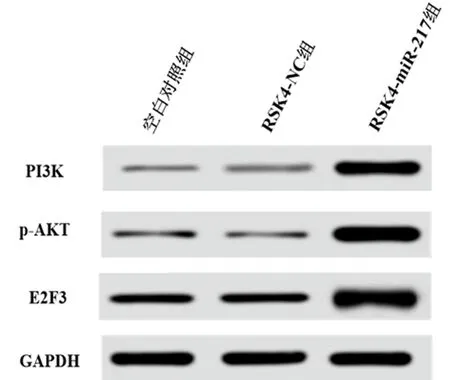
图5 miRNA-217过表达后T24细胞中PI3K、p-AKT和E2F3表达
目前,microRNAs已被发现广泛分布于多个物种中,1个microRNA在同一物种的单一细胞类型中可调控多个功能靶标,多个microRNAs则可竞争或协同靶向调控1个mRNA[7]。此外,miRNAs在多种肿瘤中表达异常,且在肿瘤的增殖、凋亡、侵袭及转移过程中,通过调控癌基因或抑癌基因间接参与癌细胞生物学进程[8]。miRNA-217位于染色体lp36.2上,全长95个核苷酸,Nakashima等[9]报道miRNA-217诱导骨肉瘤细胞通过Wnt/β-catenin途径增殖并增强转移。但其他研究表明,miRNA-217抑制肿瘤细胞转移,miRNA-217通过抑制环氧合酶-2抑制肿瘤的增殖侵袭[10]。miRNA-217通过抑制前列腺癌细胞侵袭蛋白1抑制肿瘤增殖侵袭[11]。miRNA-217通过靶向三阴性乳腺癌中的偏二氢吡啶抑制肿瘤的增殖和转移[12],miRNA-217在肿瘤转移中的不同作用,可能取决于肿瘤和组织类型[13]。本研究结果显示膀胱癌组织中miRNA-217表达水平明显高于正常组织,提示miRNA-217在膀胱癌的发生发展中可能起着重要作用。为了进一步研究miRNA-217在膀胱癌中的作用,本研究构建了miRNA-217过表达细胞系,结果显示LmiRNA-217上调后,促进了膀胱癌细胞T24的增殖和侵袭能力。
miRNA-217对不同肿瘤有不同靶标,这些不同靶标发挥不同作用。例如,miRNA-217通过靶向Serbp1抑制乳腺癌细胞增殖[14],通过靶向α5整合素促进人肝癌细胞的失活[15],通过抑制Zeste同源物的增强子抑制人肝细胞癌上皮间充质转化[16]。研究表明,P13/AKT信号通路在各种类型的癌症中会异常激活,与肿瘤细胞的生存、增殖和侵袭过程可能息息相关[17]。几项研究表明miRNA可以通过靶向P13/AKT信号通路调控肿瘤发生。例如,miR-1246通过靶向P13促进食管癌转移[18],miR-1303通过靶向P13促进神经母细胞瘤的细胞增殖[19]。本研究经www.microRNA.org网站预测发现miRNA-217和P13K有互补结合序列,双荧光素酶报告实验证实两者的靶向结合关系。PI3K也介导miRNA对化疗的耐药性和转移的影响[20]。E2F3是P13/AKT信号通路下游重要蛋白,参与细胞分化、增殖以及侵袭等生物反应过程[21]。E2F3作为一种细胞周期关键蛋白,在细胞周期的调控过程中发挥重要作用,并参与体内主要两条细胞增殖调节和肿瘤监控途径的表达[22]。本研究结果显示miRNA-217过表达组PI3K、P-AKT和E2F3表达均上调,说明PI3K受 miRNA-217靶向调控,功能性P-AKT表达增多,促进E2F3蛋白表达。
综上所述,miRNA-217促进了膀胱癌细胞癌细胞增殖、侵袭和转移,其作用机制可能是miRNA-217通过靶向P13/AKT信号通路调控E2F3表达实现的。
