基于CTA三维可视化辅助脑动脉瘤介入术的应用研究
2021-11-01叶世阳刘先波
叶世阳 游 涛 刘先波
江西省萍乡市人民医院神经外科,江西萍乡 337000
脑动脉瘤是常见外科急症,可引起自发性蛛网膜下腔出血,即使得到及时救治,仍有半数以上患者遗留肢体障碍,在全球范围内病死率较高[1]。血管内介入术是治疗脑动脉瘤的常用方法,利用微创方式进入动脉瘤所在动脉并进行栓塞,尤其适用于无法耐受开放手术、合并颅内感染患者[2]。而血管内介入术中需采用影像学检查方法,明确瘤体形态学,以精确手术操作。三维电子计算机断层扫描血管造影(computed tomography angiography,CTA)能够模仿内镜成像,精确显示脑动脉瘤位置、直径等,提高手术精确性[3]。鉴于此,本研究就基于CTA三维可视化辅助脑动脉瘤介入术的应用价值做以下探究。
1 资料与方法
1.1 一般资料
选择2018年11月—2020年6月江西省萍乡市人民医院收治的74 例脑动脉瘤患者作为研究对象,按交替分组法分为观察组和对照组,每组各37 例。观察组中,男15 例,女22 例;年龄41~60 岁,平均(51.07±2.43)岁;动脉瘤位置(动脉):颈内9 例,前交通9 例,后交通10 例,大脑中5 例,椎基底4 例;动脉瘤直径5~13 mm,平均(9.75±1.12)mm。对照组中,男17 例,女20 例;年龄40~59 岁,平均(51.14±2.49)岁;动脉瘤位置(动脉):颈内10 例,前交通8 例,后交通11 例,大脑中3 例,椎基底5 例;动脉瘤直径5~14 mm,平均(9.72±1.09)mm。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究已经医院医学伦理委员会审核批准,患者及家属签署知情同意书。
纳入标准:①符合《外科学》[4]中脑动脉瘤诊断标准;②符合《颅内动脉瘤血管内介入治疗中国专家共识(2013)》[5]中介入治疗的适应证。排除标准:①动脉瘤颈宽,瘤体直径<5 mm;②患有出血性疾病或存在出血倾向;③脑干功能衰竭或合并脑疝;④合并严重糖尿病、高血压疾病或脏器功能衰竭;⑤生命体征不稳定或预计生存期<6 个月。
1.2 方法
1.2.1 检查方法 对照组术前行三维数字减影血管造影(digital subtraction angiography,DSA)检查。嘱患者取平卧位,行Seldinger 穿刺,以股动脉作为穿刺点,穿刺成功后,将6F 导管鞘置入,向颈内动脉、椎动脉分导5F 单弯造影管,使用高压注射器向颈内动脉以5 mL/s 速度注入碘佛醇注射液(江苏恒瑞医药股份有限公司,国药准字H20067895,规格:20 mL)7 mL,向椎动脉以3 mL/s 速度注入碘佛醇注射液5 mL; 注射后使用血管造影机进行正位、侧位片检查,并将C 臂机旋转以40 帧/s 速度采集连续信号; 使用后期工作站对采集到的图片进行重建。观察组术前行三维CTA检查:嘱患者取平卧位,使用双源CT 进行常规平扫,以听眦线为基线,参数设置:管电流200 mA、管电压110 kV,层厚0.6 mm,螺距1.2 mm,矩阵512×512,视野为2 cm; 平扫后将50 mL 碘佛醇注射液经高压注射器注入肘静脉,注射速度为5 mL/s,行延迟扫描;将患者头部固定,将20 mL 生理盐水+80 mL 碘佛醇注射液注入肘静脉,扫描患者主动脉弓至颅顶层面;扫描完成后进行图像重建,重建层厚0.625 mm,层距0.3 mm,进行容积重建、最大密度投影及多平面重建。
1.2.2 手术方法 两组患者检查后,行脑动脉瘤介入栓塞术。在三维DSA/CTA 的引导下,明确动脉瘤形态、位置,选择最佳入路及角度,将微导管缓慢置入动脉瘤内,经三维DSA/CTA 再次明确导管位置、动脉瘤情况后,送入弹簧圈至预定位置,术毕。对照组术后使用压迫器压迫穿刺部位6 h 以上,嘱患者卧床、穿刺侧下肢制动24 h 以上,口服尼莫地平40~60 mg,3 次/d,连续服用4 周。观察组术后按压穿刺部位15~20 min,并加压包扎;术后用药同对照组。
1.3 评价指标
(1)手术相关指标、格拉斯哥预后评分量表(Glasgow outcome scale,GOS)评分:记录患者手术时间;使用辐射剂量率仪测定患者辐射剂量;通过门诊随访至术后3 个月,根据GOS 评分[6]评估患者预后情况,1 分为死亡;2 分为植物状态;3 分为意识清醒、重度残疾;4 分为可独立生活,轻度残疾;5 分为轻度缺陷,可正常生活。(2)并发症、复发情况:记录两组患者术中血栓形成、动脉瘤破裂及术后穿刺点出血发生情况;统计术后3 个月内两组患者动脉瘤复发情况。
1.6 统计学方法
采用SPSS 23.0 统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验;计数资料用率表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术相关指标、GOS 评分的比较
两组手术时间、辐射剂量及术后3 个月GOS 评分比较,差异无统计学意义(P>0.05)(表1)。
表1 两组患者手术相关指标、GOS 评分的比较(±s)
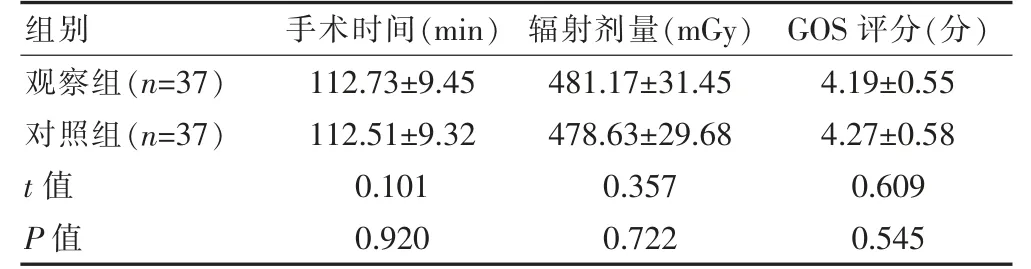
表1 两组患者手术相关指标、GOS 评分的比较(±s)
组别手术时间(min)辐射剂量(mGy)GOS 评分(分)观察组(n=37)对照组(n=37)t 值P 值112.73±9.45 112.51±9.32 0.101 0.920 481.17±31.45 478.63±29.68 0.357 0.722 4.19±0.55 4.27±0.58 0.609 0.545
2.2 两组患者并发症、复发情况的比较
两组的术中血栓、动脉瘤破裂发生率及术后动脉瘤复发率比较,差异无统计学意义(P>0.05);观察组的穿刺点出血发生率低于对照组,差异有统计学意义(P<0.05)(表2)。
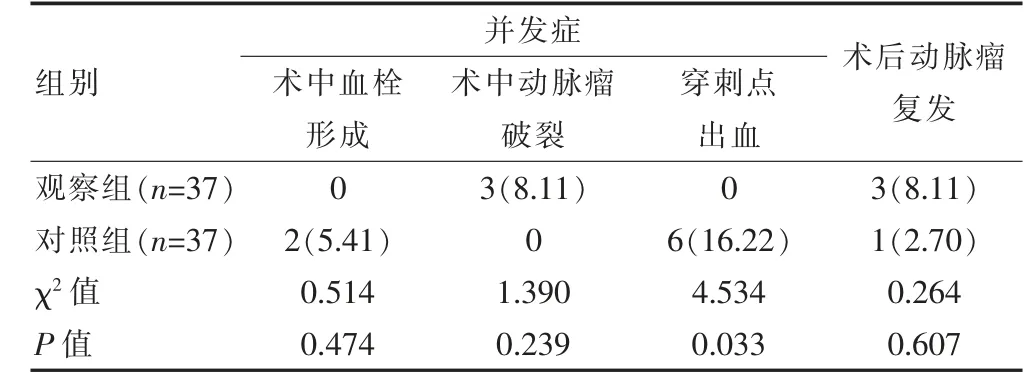
表2 两组患者并发症、复发情况的比较[n(%)]
3 讨论
血管介入栓塞术是临床治疗脑动脉瘤的重要手段之一,通过向瘤体内填充可脱弹簧圈,将动脉瘤进行栓塞,并通过将侧裂池、颈动脉池等部位完全打开,发挥减压的效果,还能清除积血,预防脑积水的发生[7-8]。而血管介入栓塞术中需根据动脉瘤形态学信息进行操作,常需使用影像学技术对脑血管解剖结构进行可视化显影,以往临床主要通过DSA 对脑动脉瘤进行术前诊断,可清晰显示瘤体、瘤颈信息,为手术提供依据;但由于DSA 属于有创检查,相关并发症较多[9-10]。
本研究结果显示,两组患者的手术时间、辐射剂量及术后3 个月GOS 评分比较,术中血栓、动脉瘤破裂发生率及术后动脉瘤复发率比较,差异无统计学意义(P>0.05),提示与头颅DSA 辅助脑动脉瘤介入术比较,使用CTA 三维可视化辅助治疗,手术时间、辐射剂量及预后相当,未增加术中血栓形成、动脉瘤破裂发生率及术后动脉瘤复发率。分析其原因可能在于,通过CTA 三维可视化显影,能够对脑动脉瘤进行任意角度旋转,与内镜显影相似,可从不同平面显示载瘤动脉、邻近血管,为介入途径、手术操作等提供有效参考[11-12]。同时通过观察瘤体、瘤颈形态,精确测量其直径,有利于选择大小适合的可脱弹簧圈,增加动脉瘤填塞的致密性,尤其对于伴有分叶、小囊的动脉瘤,其瘤壁薄弱,通过CTA 三维可视化辅助,可避免栓塞过程中动脉瘤壁被撑破,手术效果、术中并发症发生率与三维DSA 效果相当[13-14]。
本研究结果显示,观察组患者的穿刺点出血发生率低于对照组,差异有统计学意义(P<0.05),提示CTA三维可视化辅助治疗脑动脉瘤可降低术后穿刺点出血风险。主要是由于CTA三维可视化技术仅需进行肘静脉穿刺,注入对比剂进行显影,无须动脉穿刺,减少了对机体的创伤。黄文浩等[15-16]研究表明CTA 对颅内动脉瘤进行诊断,压迫止血较为便捷、简单,与三维DSA 比较,可较大程度的预防穿刺点出血,安全性较好,与本研究结果一致。但由于行三维CTA 需静脉注射造影剂,且造影剂需经肾脏排出,对于碘过敏患者及肝肾功能异常患者需慎用,在脑动脉瘤血管介入术的辅助中仍存在一定局限性。
综上所述,与头颅三维DSA 辅助脑动脉瘤介入术比较,使用CTA 三维可视化辅助治疗,可较大程度减少术后穿刺点出血的发生,且手术时间、辐射剂量及预后相当,未增加术中血栓形成、动脉瘤破裂发生率及术后动脉瘤复发率。
