盐胁迫对不同生育时期花生根际土壤细菌群落和产量的影响
2021-11-01戴良香史晓龙张冠初秦斐斐张智猛
戴良香,丁 红,史晓龙,徐 扬,张冠初,秦斐斐,张智猛
(1.山东省花生研究所,山东 青岛 266100;2.沈阳农业大学 农学院,辽宁 沈阳 110866)
根际微生物是紧密附着于根际土壤颗粒中的微生物,其与植物根系相互作用、相互促进,参与并担负着根际重要的生理过程,维系着根际的生态平衡[2],是土壤与植物间物质交换活跃界面的重要成员[3-4],具有多种生物功能[5],在植物生长以及对各种生物和非生物胁迫的适应中起着至关重要的作用[6-8]。关于花生对耐盐胁迫适应性的研究大多集中在品种耐盐性鉴选[9-12]、光合产物积累与光合效能[13-14]、保护酶活性变化[15]、养分吸收积累以及种子际细菌群落变化等方面[16-17],同时,植物生长促进菌的接种,可为植物根系提供抵抗生物和非生物胁迫的缓冲区,产生各种植物生长促进素和生物防治剂,诱导系统抗性并增强养分矿化和有效性[18-19],研究了黄河三角洲不同含盐量盐碱地上花生旺盛生长期0~40 cm根层和旱盐同时胁迫下花生根际土壤细菌群落组成及其多样性[20-21]。目前,关于盐胁迫对不同生育期花生根际微生物群落组成的影响研究较少,针对盐碱土壤花生根际微生物群落结构、优势种群及花生生长阶段之间的关系等研究尚不系统[20-22]。本研究拟通过盐胁迫条件对花生不同生育期根际微生物群落结构变化和产量的影响,旨在发现和选择有益的耐盐微生物,明确非生物胁迫环境对微生物群落及功能的调节作用,发掘新的功能类群,发展盐碱地花生生产。
1 材料和方法
1.1 试验材料
供试土壤采用耕地表层土(0~30 cm),基础肥力:土壤有机质含量14.08 g/kg,全磷(P2O5)0.84 g/kg,全钾(K2O)11.26 g/kg,全氮1.70 g/kg,水解氮(N)102.1 mg/kg,速效磷(P2O5)14.7 mg/kg,速效钾(K2O)113.2 mg/kg,土壤pH值7.1,土壤交换性Na+0.82 cmol/kg,Cl-28.5 mg/kg,土壤含水量9.82%。品种为花育25号(Huayu 25)。
1.2 试验设计
采用盆栽试验,选择底部直径为36 cm、高为26 cm的塑料盆,每盆装土量为18 kg。先将供试土壤风干、过1 cm筛后备用。选取饱满均匀的种子,每盆播6粒,播深均为3 cm,留4株长势一致的幼苗。
设置3个盐胁迫梯度:0.0(Y0),1.5(Y1),3.0 g/kg(Y2),盐胁迫梯度采用分析纯NaCl重量法控制。随机区组排列,6次重复。分别于开花下针期(播后70 d)、收获期(播后125 d)以处理和重复为单位采集根际土壤样本。采用“抖土法”多点混合方法,即以每处理重复为单元,“抖土法”收集紧密附着于根系的土壤,每3个重复根际土壤样品混合为1个生物学样本重复,每处理分别获取2个生物学重复,密封于灭菌后的离心管中,于-80 ℃超低温冰箱中保存备用。于收获期各处理收获实测计产,室内考察花生出米率、百果质量、百仁质量,计算荚果产量。
开花下针期各处理土壤样本分别表示为CK、Y1、Y2,收获期各处理土壤样本分别表示为HCK、HY1、HY2。相关测试由北京诺赛基因公司完成。
1.3 土壤DNA提取
土壤总DNA提取采用OMEGA soil DNA kit试剂盒进行,DNA的纯度和浓度检测采用1.5%琼脂糖凝胶电泳和Nanodrop2000 分光光度计进行。
1.4 16S rRNA文库构建及高通量测序
首先对16S rRNA基因V3-V4区进行扩增,引物340F:CCTACGGGNBGCASCAG以及805R:GACTACNV
游学类教材未能形成系统出版。以在全球范围内传播中华文化的孔子学院为例,包含中华文化艺术因素的立体化教材研发已是一线教学人员首先考虑的问题。如何研发立体化教学系列,也是游学教辅材料目前的短板。秉持对外交流和文化输出的目的,以内容立体化、形式立体化和服务立体化为目标,将符合学习规律、实用有趣、贴近生活的内容融入游学教材中,形成游学类教材的系统出版,研发适合游学体系的立体化教材任重道远。
GGGTATCTAATCC。扩增程序:95 ℃预变性3 min;30个循环包括(95 ℃ 30 s,50 ℃ 30 s,72 ℃ 60 s);72 ℃ 7 min。使用1.5%浓度的琼脂糖凝胶对PCR 产物进行电泳检测,使用0.5×TBE 浓度1.5%的琼脂糖凝胶电泳纯化PCR 产物,回收目标条带。产物纯化试剂盒为QIAGEN公司MinElute胶回收试剂盒。
将纯化的扩增子等摩尔合并,并在Illumina HiSeq2500/NovaSeq 250PE平台(Illumina,美国圣地亚哥)上进行配对末端测序。使用SOAPdenovo对原始数据进行拼接、过滤,将相似性值≥97%的序列定义为同一个OTU进行相关、聚类等分析。
1.5 生物信息学分析
基于有效数据进行OTUs(Operational taxonomic units)聚类和物种分类分析,得到每个样品OTUs 和分类谱系的基本分析结果,再进行其丰度和多样性指数分析,并在门和纲水平上进行群落结构统计分析。最后进行物种组成聚类分析、PCoA和PLS-DA统计比较分析,挖掘样品间的物种组成差异,并结合环境因素进行关联分析。
2 结果与分析
2.1 样本根际细菌群落测序质量分析
表1显示,通过对原始数据拼接、过滤,共获得有效序列(Clean data)893 527条,多数样本序列长度在400~500 bp,平均长度在400~500 bp(图1-A)。各处理花生根际样本共有2 507个OTUs,存在于CK、Y1和HY2中的OTUs数分别为59,36,29个,其余3个处理样本HCK、Y2和HY1中分别为21,16,17个,表明各处理样本微生物组成基本相似(图1-B)。

表1 各处理根际样本测序信息统计Tab.1 The sequencing information statistics of peanut rhizosphere bacterial communities in different treatments
2.1.1 多样性指数 表2所示,花生根际细菌种类丰富度和多样性受盐胁迫强度和生育时期的影响。各样本细菌群落中OTUs个数丰富度的Chao1、Ace和Sobs指数分别为3 308.915 1~3 722.820 3,3 316.230 4~3 684.215 7,2 797.50~3 371.00。反映群落多样性的Shannon和Simpson指数分别为5.606 5~6.979 7,0.002 170~0.027 914。各样本群落覆盖度Coverage指数均大于0.989 4。Y2样本的Chao1、Ace丰富度指数和Sobs指数及HY2的Simpson多样性指数均较高,HY2处理的丰富度指数和多样性指数均表现最低。收获期土壤根际细菌种类丰富度和多样性受盐胁迫强度的影响较大,较高强度的盐胁迫浓度使收获期根际土壤细菌种类丰富度和多样性均降低。
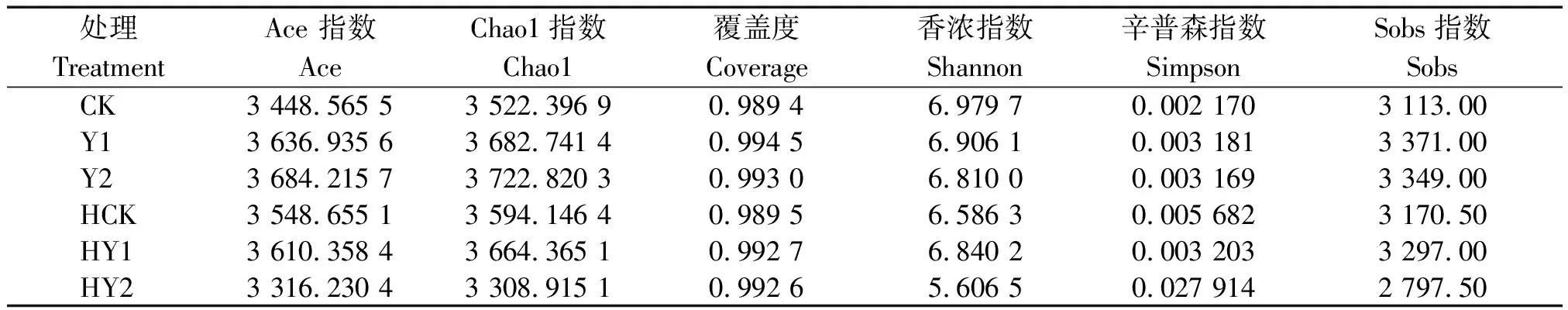
表2 各处理样本Alpha多样性指数Tab.2 Alpha diversity index of rhizosphere soil samples in each treatment
2.1.2 Rank Abundance曲线 各处理下各物种按相对丰度均从高到低依次排列,当OTU数量小于1 000时对应的物种相对丰度较高,曲线下降迅速且不平缓,表明其均匀度较低。当OTU数量大于2 000时,曲线较为平缓,表明其在土壤样本分布较为均匀(图2)。各处理样本间的曲线宽度和平滑程度基本一致,不同样本间物种均匀度无显著差异。
2.1.3 稀释性曲线 稀释曲线可以反映各样本在不同测序数量时的微生物多样性,并间接反映样本中物种的丰富程度。各样本在测序量达到3 500时,曲线均趋于平缓,测序深度足够,其结果可覆盖所测样本内的所有物种,可对微生物群落结构进行深入分析(图3)。花生不同生长期各处理OTU数量基本一致,均无显著差异。
2.2 物种组成及样本间差异比较
2.2.1 门水平全样本菌落结构分析 所有处理样本的29个门水平群落物种组成中,其Top11个门(其他合并<0.025)相对丰度之和达94.87%以上。各处理样本的优势菌门均为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidetes)、Patescibacteria 7种,其相对丰度均在5.73%以上,其中以变形菌门平均相对丰度最高为31.50%,放线菌门相对丰度为15.48%,绿弯菌门和酸杆菌门相对丰度仅分别为9.96%,8.28%(图4)。
盐胁迫明显提高变形菌门、疣微菌门、拟杆菌门和蓝细菌门的相对丰度,尤以开花下针期明显,其中,变形菌门、疣微菌门和拟杆菌门3个优势菌门Y2处理较其CK分别升高27.00%,114.78%,74.57%,非优势菌门蓝细菌门是其CK的4.6倍。盐胁迫明显降低优势菌门放线菌门、酸杆菌门和Patescibacteria的相对丰度,较其相应对照降幅分别为55.58%,26.69%,78.78%。花生根际微生物群落组成受盐胁迫强度和生育时期的影响较大。
2.2.2 纲水平全样本菌落结构分析 所有处理样本的72个纲水平群落物种组成中,其top15(其他合并<0.025)的相对丰度之和平均达86.36%,优势菌纲(相对丰度在5%以上)为放线菌纲(Actinobacteria)、α-变形菌纲(Alphaproteobacteria)、δ-变形菌纲(Deltaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、芽单胞菌纲(Gemmatimonadetes)、拟杆菌纲(Bacteroidia)、疣微菌纲(Verrucomicrobiae)等7个菌纲。相对丰度在10%以上的优势菌纲仅有放线菌纲13.15%、α-变形菌纲12.68%和γ-变形菌纲14.65%(图5)。
盐胁迫显著降低两生育时期放线菌纲和Saccharimonadia的相对丰度,而明显升高γ-变形菌纲的相对丰度,并均随盐胁迫强度的升高而升高。疣微菌纲和拟杆菌纲丰度于开花下针期丰度显著升高但至成熟期显著降低。
2.3 根际微生物群落组成比较分析
2.3.1 Beta多样性分析 基于Unweighted unifrac距离的PCoA(Principal co-ordinates analysis)分析表明,各处理样本分布于除第Ⅰ象限外的第Ⅱ、Ⅲ、Ⅳ象限,表明各处理样本间细菌群落组成存在明显差异,除HY2一重复的样本点距离较大外,其余处理同一样本的两重复间差异均较小,平行间重复性较好。横坐标(PC1)和纵坐标(PC2)分别可解释样品中所有差异的37.3%,24.8%。盐胁迫下开花下针期样品集中分布于第Ⅲ象限,物种组成相似度高;CK与收获期所有处理样本集中分布于第Ⅱ象限,其物种组成相近(图6-A)。样本层级聚类(Hierarchical clustering)结果表明,所有样本划分为4个显著不同的类群,盐胁迫下开花下针期和成熟期样本各聚为一类,两生育时期对CK各聚为一类。表明盐胁迫下花生根际细菌菌群受生长发育时期影响较大,与无盐胁迫根际细菌群落组成有明显不同(图6-B)。盐胁迫处理使根际土壤微生物菌群多样性的差异增大,受花生生育阶段和盐胁迫强度的影响较大。
2.3.2 PLS-DA(Partial least squares discriminant analysis)分析 通过PLS-DA分析,图7-A、B可以看出,各处理样本点离散分布,各样本菌群组成差异较大,且在目水平和属水平上组成差异的影响因素相同,即各样本菌群组成差异受花生生育时期和盐胁迫程度的影响,盐胁迫下受生育时期影响较大。
2.4 细菌群落代谢功能特征
通过PICRUSt2预测了花生根际细菌群落的代谢功能特征(COG)。各处理根际细菌富集的功能主要包括:氨基酸转运与代谢、能量生产和转化、信号转导机制、细胞壁/膜/包膜生物发生、转录和碳水化合物的运输和代谢等。盐胁迫使各功能基因丰度提高,且与生育时期和盐胁迫强度有关,开花下针期以Y1处理各功能基因丰度较高,而至收获期各功能基因丰度则随盐胁迫强度的升高而升高,尤以信号传递(翻译、转录、复制重组和修复)、细胞周期变化(细胞周期控制、细胞分裂、染色体分区、细胞壁/膜/包膜生物发生)和物质能量代谢运输(能源生产与转化、碳
水化合物的运输和代谢、氨基酸转运和代谢和无机离子的运输与代谢等)等功能丰度升幅较大。除未知功能基因外,各处理功能基因总数为71.07×106~105.23×106,Y2处理最大,Y1处理次之(99.68×106个),CK和HCK处理最小,分别为71.07×106和71.12×106个。CK预测功能基因总数比HY2处理降低32.47%,较Y2降低28.71%(图8-A)。
使用热图分析比较了KEGG level 2级种群代谢功能基因(Top15)表明(图8-B),物质能量代谢(碳水化合物代谢、氨基酸代谢、核苷酸代谢、辅助因子和维生素代谢、脂质代谢)、翻译、复制和修复、信号转导及膜运输等为主要代谢功能。其中,所有样本中菌群涉及碳水化合物代谢、氨基酸代谢、能量代谢、辅助因子和维生素的代谢等功能基因丰度增加,而涉及信号转导、脂质代谢、复制和修复、异种生物的生物降解和代谢、其他氨基酸的代谢、折叠,分类和降解等功能的丰度降低。盐胁迫处理使各功能基因丰度明显升高,尤以Y1和HY2处理丰富升高明显,CK和HCK各种功能丰度降低明显。盐胁迫和花生生育时期在细菌种群功能方面起重要作用,有利于优势细菌功能群丰度提高。
2.5 产量性状
表2看出,盐胁迫处理显著影响花生出米率、百果质量、百仁质量和产量,且随盐胁迫程度的提高作用明显。盐胁迫处理的百仁质量较CK分别降低32.74%,37.63%,盐胁迫处理的产量仅为CK处理的50%左右。可见,盐胁迫严重抑制花生籽仁发育和产量形成。

表2 盐胁迫对花生产量及构成因素的影响Tab.2 Effects on peanut yield and its components under salt stress
3 讨论与结论
植物根际和根内微生物群落具有明显的根际效应,根系分泌物影响附近土壤微环境中微生物活性和菌群结构,并对微生物群落结构和功能多样性施加选择性压力[23]。此外,土壤特性、植物种类、生长阶段和其他胁迫因素也会影响微生物群落组成。黄河三角洲滨海盐碱土高含盐量土壤中根际土壤微生物种类、优势种群数量和群落功能多样性更为丰富。盐碱地花生//棉花间作影响二者根层微生物群落的组成,花生//棉花间作使得花生根层土壤变形菌门和放线菌门丰度值降低,花生根际微生物菌群类型与土壤含盐量和根系分布深度有关[21,24-26]。本研究结果表明,盐胁迫和正常条件下,花生根际微生物群落组成无显著差异,但其多样性和丰富度差异受盐胁迫强度和生育阶段的影响。较高强度的盐胁迫使花生开花下针期根际微生物种类丰富度和多样性升高,可能由于花生生长阶段不同,土壤微环境和物理化学性质有差异,在根系分泌物因长势和盐胁迫逆境调节微生物群落组成的同时,也因各种微生物对盐胁迫逆境的耐受性不同而凋亡或存活,随后可能会改善植物的生长和耐盐性。
根系对微生物的“选择招募”过程与微生物自身的移动性、趋化性、多糖降解性等因素有关[20,27-29]。根际环境中纤维弧菌属(Cellvibrio)和假单胞菌(Pseudomonas)的相对丰度远远高于非根际土壤,而二者在降解纤维素和好氧反硝化细菌的过程中发挥着重要作用[30-31]。 芽单胞菌门对盐胁迫环境具有很好的适应能力[32],蓝细菌可在盐碱土中生存,通过转化积累土壤中的碳和氮以改善土壤微环境[33-35]。本试验条件下,盐胁迫导致花生根际微生物群落转移和特定微生物种类富集,变形菌门、拟杆菌门、疣微菌门和蓝细菌等优势菌门的相对丰度明显提高,尤以开花下针期明显。较高的蓝细菌和芽孢杆菌及旺盛的生长阶段,可能有助于花生在盐胁迫下维持各种生理功能,从而增强花生耐盐能力。
土壤微生物群落对于植物在盐胁迫下维持基本功能可能很重要。研究发现盐胁迫条件下,花生根际细菌群落涉及物质和能量代谢、膜运输、翻译、复制和修复以及信号转导等优势细菌功能基因丰度增加,可以推测这些途径可能有助于提高花生的耐盐性。因此,基于植物-微生物互作关系,充分利用和发挥根际微生物资源,调控管理根际微生物群落并保持有益微生物和有害微生物之间的平衡,开发生物肥料和生物防控剂,对改善土壤肥力、提高作物产量、维持农业生态环境健康等具有重要意义。
