运用网络药理学和分子对接探究山药-陈皮治疗孤独症谱系障碍的机制
2021-10-31吴静静王俊宏刘玲佳
吴静静 王俊宏 刘玲佳


摘要 目的:運用网络药理学及分子对接探究山药-陈皮治疗孤独症谱系障碍(ASD)的分子机制。方法:检索中药系统药理学数据库与分析平台(TCMSP)并筛选山药-陈皮活性成分及靶点,检索Genecards、DisGenet、TTD数据库并筛选ASD疾病相关靶点。运用Cytoscape 3.7.2软件建立山药-陈皮靶点基因蛋白质-蛋白质相互作用(PPI)网络及ASD疾病基因PPI网络,提取Hithubs网络,即山药-陈皮治疗ASD的关键靶点。运用DAVID数据库对关键靶点进行基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG)富集分析。运用Autodock软件对山药-陈皮活性成分与关键靶点进行分子对接。结果:筛选山药-陈皮活性成分21个及对应靶点109个,检索ASD相关靶点476个,提取山药-陈皮治疗ASD的关键靶点141个,GO分析结果显示91个生物过程,68个细胞组分和77个分子功能相关过程,KEGG通路富集条目10条(P<0.05)。这些关键靶点涉及rRNA加工、核转录基因分解代谢过程、翻译起始、靶向膜的SRP依赖性共转运蛋白、病毒转录、核糖核酸聚合酶Ⅱ启动子转录正调控、凋亡过程负调控、细胞周期、拼接体、核苷酸切除修复等。分子对接结果显示山药-陈皮活性成分与关键靶点结合构象稳定。结论:山药-陈皮治疗ASD可能通过脑神经网络连接、基因表达、信号转导、炎症反应、病毒转录等途径起效。
关键词 孤独症谱系障碍;山药;陈皮;药对;网络药理学;靶点;信号通路;分子机制
Abstract Objective:To explore the molecular mechanism of Chinese yam and tangerine peel pair in the treatment of autism spectrum disorder on network pharmacology and molecular docking.Methods:TCMSP was used to screen the active components of Chinese yam and tangerine peel pair.Disease targets associated with ASD were retrieved from Genecards、DisGenet and TTD database.The Cytoscape 3.7.2 software was used to construct a drug-compound-target network.Draw Hithubs diagrams for disease targets and drug targets to screen key targets.Further analysis of GO function and KEGG pathway enrichment was conducted by the database for annotation,visualization and integrated discovery(DAVID).Finally,Autodock software was used to conduct molecular docking between drug components and core action targets.Results:A total of 21 active ingredients and 109 potential target genes related to Chinese yam and tangerine peel pair were retrieved from TCMSP.And 476 genes directly related to ASD were obtained from the disease gene database.There were 141 key targets obtained by drawing Hithubs diagrams from component targets and disease targets.GO analysis revealed 91 biological processes,68 cell component expression processes,and 77 molecular function related processes.These genes mainly involved in 10 signaling pathways(P<0.05),such as rRNA processing,nuclear-transcribed mRNA catabolic process,nonsense-mediated decay,translational initiation,SRP-dependent co-translational protein targeting to membrane,viral transcription,positive regulation of transcription from RNA polymerase Ⅱ promoter,negative regulation of apoptotic process,cell cycle,spliceosome and nucleotide excision repair.Conclusion:The active ingredients of Chinese yam and tangerine peel pair has active effects on ASD through multi-pathways,including neural network connection,gene expression,signal transduction,inflammatory reaction and viral transcription.
Keywords Autism spectrum disorder; Chinese yam; Tangerine peel; pair medicinal; Network pharmacology; Target; Signaling pathway; Molecular mechanism
中图分类号:R285;R749文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.18.007
孤独症谱系障碍(Autism Spectrum Disorder,ASD),是以社会交往障碍、语言交流障碍、重复刻板行为及兴趣狭窄为特征的精神发育障碍性疾病[1],多发病于婴幼儿。近年来该病患病率逐年升高,在发达国家,ASD患病率已达1.5%[2]。ASD病因复杂,发病机制尚不明确,可能与环境因素、遗传因素等相关。对本病的治疗,尚无明确有效的治疗方案,以教育干预为主,以对症药物治疗为辅,预后不佳[3]。ASD常伴一种或多种共患病,如智力损害、焦虑障碍、结构性语言障碍、癫痫、注意缺陷多动障碍、睡眠障碍等,此外,有研究显示,61%的ASD患儿合并胃肠道功能紊乱[4],胃肠道症状的变化与患儿临床核心症状存在密切关系,可影响ASD儿童的治疗效果[5],解决胃肠问题可能对ASD患儿合并的感觉与情绪问题有缓解作用[6],西医治疗以饮食干预为主,1979年Mc Carthy和Coleman提出的去麸质去酪蛋白饮食,是治疗ASD广为传播的饮食干预方法[7]。近年来研究表明,此疗法有可能影响到常量营养素、微量营养素和食物群的吸收,可能发生营养缺乏的风险,可能加重肠道微生物成分的不平衡以及原有胃肠问题的恶化[8]。
王俊宏教授多年来运用中医理论,致力于以脾为核心论治ASD,自拟益气运脾方,组成为:陈皮10 g、山药10 g、茯苓10 g、鸡内金10 g、生山楂10 g、法半夏6 g、石菖蒲6 g、生甘草6 g,临床疗效显著,在不进行饮食干预的前提下,使患儿消化系统症状可以得到明显改善。方中山药甘平质润,补脾养胃,既补脾气,又益脾阴,兼收涩止泻。《神农本草经》云:“山药主伤中,补虚羸,除寒热邪气,补中,益气力,长肌肉,久服耳目聪明。”陈皮辛行苦燥性温,有行气健脾,燥湿和中之功。二者相配,补气理气,共奏健脾和胃之效。因此,为更好地推广应用,山药-陈皮起效的机制值得深入挖掘。
中药具有多成分、多靶点、多作用途径的复杂特点,网络药理学成为中药走向现代化的新的研究方法和技术手段,是在系统生物学理论的指导下,衍生出的以药物多成分,多靶点为切入点研究中药治疗疾病作用机制的研究学科[9]。本研究运用网络药理学和分子对接,探究山药-陈皮治疗ASD起效的分子机制,为后续实验研究奠定理论基础。
1 资料与方法
1.1 山药-陈皮活性成分及靶点筛选 利用中药系统药理学数据库与分析平台(TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php),根据口服生物利用度(Oral Bioavailability,OB)≥30%且类药性(Drug Likeness,DL)≥0.18的原则[10],分别筛选山药、陈皮的活性成分,并检索活性成分的对应靶蛋白。运用Uniprot数据库(http://www.uniprot.org/),将山药、陈皮活性成分的靶蛋白逐一输入Uniprot KB进行检索,限定物种为“Human”,限定检索结果为已验证的,选择“Reviewed”,最终得到对应的靶基因信息。
1.2 ASD疾病相关靶点筛选 以“tic disorder”为关键词,分别检索Genecards(https://www.genecards.org/)、DisGenet(http://www.disgenet.org/)、TTD(http://db.idrblab.net/ttd/)数据库,筛选ASD疾病相关靶点。将上述3个数据库的检索结果合并,去除重复值,最终得到ASD疾病相关靶点。
1.3 山药-陈皮治疗ASD关键靶点筛选 运用Cytoscape 3.7.2软件的bisogenet插件,建立山药-陈皮靶点基因蛋白质-蛋白质相互作用(PPI)网络及ASD疾病相关基因PPI网络,运用Merge功能,将药对PPI网络映射至ASD疾病PPI网络上,提取二者的交集网络;运用其中的CytoNCA插件,计算中心中介性(Betweenness Centrality,BC)、最短路径中心性(Closeness Centrality,CC)、度值(Degree)等参数指标,提取Hithubs网络,即山药-陈皮药对治疗ASD的核心靶点。
1.4 山药-陈皮治疗ASD的中药-活性成分-关键靶点网络构建 为明确山药-陈皮活性成分与该药对治疗ASD起效的关键靶点之间的关系,运用Cytoscape 3.7.2软件,将山药-陈皮具有的活性成分及该药对治疗ASD起效的关键靶点导入,行网络图绘制可视化分析,并利用Network Analyzer插件进行网络拓扑属性分析,度值(Degree)越高,与其他节点连线越多,说明该节点起到的作用越为关键。
1.5 山药-陈皮治疗ASD关键靶基因本体(GO)富集分析和京都基因和基因組百科全书(KEGG)富集分析 运用DAVID数据库(http://david.nifcrf.gov/),导入山药-陈皮治疗ASD起效的关键靶点,进行基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,限定物种为“homo sapiens”,筛选P<0.05的条目,最终分析结果包括:生物过程(Biological Process,BP)、细胞组分(Cellular Component,CC)表达、分子功能(Molecular Function,MF)相关过程。运用其中的Merge插件,提取山药-陈皮治疗ASD起效的交集靶点;运用cytoNCA插件,计算出BC、CC、Degree值等参数,提取Hithubs网络。
1.6 山药-陈皮活性成分与关键靶点分子对接 分子对接是一种有效的计算方法,主要用于小分子与靶蛋白的结构对接,并评估其与确定结合位点的结合亲和力[11]。若对接的结合能量为负值,则提示小分子与靶蛋白能够有效的自主结合。一般认为,配体与受体结合的构象稳定时能量越低,发生的作用可能性越大[12]。本研究通过对山药-陈皮药对Degree值排名靠前的活性成分与该药对治疗ASD起效的关键靶点进行分子对接。运用TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php)下载山药-陈皮活性成分的结构图,以mol2格式保存;运用PDB数据库(http://www.rcsb.org/)下载山药-陈皮治疗ASD起效的关键靶点的3D结构图,以pdb格式保存;将二者导入Autodock软件,去水,加氢,进行分子对接。运用PyMol软件将对接结果进行可视化分析。
2 结果
2.1 山药-陈皮活性成分及靶点筛选 共得到山药-陈皮活性成分共21个,其中山药16个,陈皮5个。见表1。检索山药活性成分对应的靶蛋白134个,陈皮活性成分对应的靶蛋白92个。运用Uniprot数据库,将检索到的山药-陈皮靶蛋白逐一转化为对应的靶基因,合并后删去重复值,最终得到山药-陈皮活性成分对应靶点109个。
2.2 ASD疾病相关靶点筛选 共获得ASD疾病相关靶点381个、164个、9个,合并以上检索结果并删去重复值,共得到ASD疾病相关靶点476个。
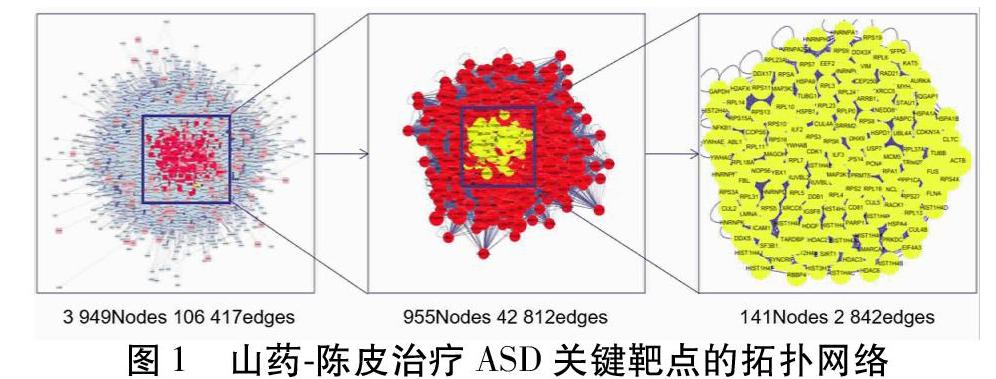
2.3 山药-陈皮治疗ASD关键靶点筛选 构建山药-陈皮药对活性成分的作用靶点PPI网络中节点4 600个,节点之间的相互关系114 179个;构建ASD疾病相关靶点PPI网络,包括节点8 903个,节点之间的相互关系196 670个。运用其中的Merge插件,提取山药-陈皮治疗ASD起效的交集靶点;山药-陈皮治疗ASD的关键靶点,包括HNRNPA1、CUL2、RPA1、CUL5、FUS、STAU1、RPS3、TARDBP、NCL、RPS27A等141个靶点。见图1。
2.4 山药-陈皮治疗ASD的中药-活性成分-关键靶点网络构建 中药-活性成分-关键靶点网络包含132个节点,247条作用关系,中心2个粉色矩形图标分别代表中药陈皮和山药,中间黄色V形图标代表活性成分,外围蓝色菱形图标代表关键靶点。见图2。图中节点越大,与该节点的连线越多,则该节点越为重要,可见其中HNRNPA1、CUL2、RPA1、CUL5、FUS、STAU1、RPS3、TARDBP、NCL、RPS27A可能在陈皮-山药治疗ASD中起着至关重要的作用。
2.5 关键靶点GO分析和KEGG分析结果 GO分析结果显示共有91个生物过程(BP),68个细胞组分(CC)和77个分子功能(MF)相关过程,对富集排名靠前的条目进行可视化展示。见图3。其中涉及BP富集排名靠前的有:rRNA加工、核转录基因分解代谢过程、翻译起始、靶向膜的SRP依赖性共转运蛋白、病毒转录、核糖核酸聚合酶Ⅱ启动子转录正调控、凋亡过程负调控;涉及CC富集排名靠前的有:胞质、细胞核、细胞膜、细胞质、细胞外基质、焦点黏附、核糖体;涉及MF富集排名靠前的有:核糖体、蛋白结合、聚腺苷酸核糖核酸结合、核糖体的结构成分、DNA结合、三磷酸腺苷结合、蛋白质结构域特异性结合、蛋白质异二聚活性、组蛋白结合、泛素蛋白连接酶结合。KEGG分析结果显示P<0.05的富集排名靠前的条目进行可视化展示,包括:核糖体、病毒致癌作用、乙醇中毒、细胞周期、拼接体、卵母细胞减数分裂、核苷酸切除修复、非同源的末端连接。见图4。
2.6 山药-陈皮活性成分与关键靶点分子对接 结果显示与RPA1蛋白结合构象稳定的小分子有:MOL000546(薯蓣皂素),结合能为-5.57 kcal/mol,在TYR-326、GLN-373和LEU-422处形成氢键。与CUL2蛋白结合构象稳定的小分子有:MOL000546(薯蓣皂素),结合能为-6.05 kcal/mol,在HIS-110、TRP-117和ARG-69处形成氢键;MOL000953(CLR),结合能为-5.31 kcal/mol,在PRO-99、ARG-107、ARG-108和HIS-115处形成氢键。运用PyMol软件对上述分子对接结果进行可视化分析,对接空间图中相应对接的氨基酸残基以文字形式进行了标示。见图5。
3 讨论
ASD是严重影响儿童健康的精神发育障碍之一,近年来发病率逐年上升,对患儿家庭及社会造成了沉重负担。本病病因复杂,遗传度高,目前15%的ASD案例与基因突变有关,高生育年龄、产前感染及药物的使用不当、低出生体质量或胎儿期接触丙戊酸钠、毒素暴露及辐射污染等均可能是ASD的风险因素[13-14]。此外,近年来研究发现,消化道微生物组失调可能与ASD的发生、发展及症状严重程度密切相关[15]。目前,本病发病机制尚不明确,临床上无针对ASD核心症状的有效治疗方案,以改善患儿胃肠道症状、情绪控制及睡眠障碍等对症治疗为主。西医常用抗精神病药、抗抑郁药等,如利培酮、阿立哌唑,在快速缓解患儿精神症状的同时,不良反应多,中药可以调节脏腑,扶正祛邪,利于ASD患兒远期康复和回归,同时能减轻西药的不良反应[16]。王俊宏教授以脾为核心论治ASD疗效显著,本课题组既往对益气运脾方治疗ASD的临床疗效观察研究表明:益气运脾方可以改善患儿的胃肠道症状、情绪及睡眠,孤独症症状也有逐步减轻[17]。本研究探究本方山药-陈皮起效的分子机制,为中药以脾为核心论治ASD提供一定的理论依据,也为下一步实验研究提供新的思路。
本研究通过运用网络药理学,筛选山药-陈皮活性成分21个,包括(-)-taxifolin(花旗松素)、Hancinone C(山蒟酮C)、Campesterol(菜油甾醇)、Sitosterol(豆甾醇)、Diosgenin(薯蓣皂素)、Naringenin(柚皮素)、5,7-dihydroxy-2-(3-hydroxy-4-methoxyphenyl) chroman-4-one(橙皮素)、Nobiletin(川陈皮素)等,分属黄酮类、萜类、木脂素、植物甾醇等。有研究表明花旗松素可以减少细胞内线粒体产生自由基,具有抗氧化活性[18],还具有良好的抗炎活性[19]。柚皮素具有高抗氧化、抗炎活性和神经保护作用[20-23]。已有研究证实,柚皮素能够降低6-羟多巴胺(6-OHDA)诱导的氧化应激生物标志物水平,改善6-OHDA诱导的线粒体膜电位降低状态,对6-OHDA诱导的神经毒性和神经变性具有神经保护作用[24]。此外,有研究表明,柚皮素通过减少大脑中Aβ的产生、Tau蛋白过度磷酸化、氧化应激和神经炎症,能够显著改善衰老小鼠空间学习和记忆能力[25]。橙皮素是一种天然黄酮类化合物,有研究表明,橙皮素早期干预可改善APPswe/PS1dE9小鼠学习记忆能力,降低TLR2和Aβ以减轻海马CA1区神经元损伤[26],还可通过增加海马脑源性神经营养因子的水平来提高小鼠学习和记忆能力[27-28]。有研究在自闭症患者的大脑和脑脊液中检测到小胶质细胞活化以及炎症介质和趋化因子增加的迹象[29-31]。薯蓣皂素的药理作用在抗氧化、抗炎、调节免疫、抗病毒等方面得到了深入研究[32]。最近有研究表明,ASD患者体内高水平的活性氧,可导致氧化应激。氧化应激、炎症和免疫系统功能障碍可能与ASD的发病机制和(或)严重程度有关[33]。由此推测花旗松素、薯蓣皂素、柚皮素和橙皮素可能通过抗炎、抗氧化作用达到治疗ASD的疗效。
本研究提取山药-陈皮治疗ASD的关键靶点,包括HNRNPA1、CUL2、RPA1、CUL5、FUS、STAU1、RPS3、TARDBP、NCL、RPS27等。这些关键靶点涉及:rRNA加工、核转录基因分解代谢过程、翻译起始、靶向膜的SRP依賴性共转运蛋白、病毒转录、核糖核酸聚合酶Ⅱ启动子转录正调控、凋亡过程的负调控、细胞周期、拼接体、卵母细胞减数分裂、核苷酸切除修复等,主要与脑神经网络连接、基因表达、信号转导、炎症反应、病毒转录等有关。其中HNRNPA1是一种核糖核酸结合蛋白,在许多病毒的生命周期中起着重要的功能和调节作用,在转录、转录后、翻译和翻译后水平上影响宿主中许多关键基因的表达,这些基因负责控制宿主中的关键代谢途径[34]。遗传学研究表明,编码突触蛋白的基因突变,如SHANK3,NLGN3,NLGN4X,CNTNAP2和GARB都与ASD有关。8个编码参与活性氧代谢的关键蛋白的基因(GCLM、SOD2、NCF2、PRNP、PTGS2、TXN和FTH1)在自闭症患者中下调。在自闭症障碍患者中差异表达的2种基因SOD2和GPX3的水平也降低[35-37]。分子对接结果显示,山药-陈皮活性成分薯蓣皂素、橙皮素、柚皮素与关键靶点RPA1、CUL2、CLR结合构象稳定,提示山药-陈皮可能作用于上述靶点对ASD起到治疗作用。
中药网络药理学以中医药基本理论为指导来研究疾病的发生机制,为治疗复杂疾病提供新的方法和思路[38-39],体现了中药单个成分对应多靶点、多信号通路以及多种成分作用同一靶点或信号通路协同作用的特点[40],能够为中医学从基于经验的医学迈向基于证据的医学提供新的途径,并能加速中药药物发现的进程,同时改进当前的药物研究策略[41]。本研究运用网络药理学和分子对接,预测了陈皮-山药具有多个成分,为通过多靶点、多信号通路的协同作用治疗ASD提供了客观依据,为实验研究提供了理论基础。通过预测,后续实验研究可重点研究花旗松素、薯蓣皂素、橙皮素和柚皮素在ASD治疗中的起效的关键作用。
参考文献
[1]Taghizadeh N,Davidson A,Williams K,et al.Autism spectrum disorder(ASD) and its perioperative management[J].Paediatr Anaesth,2015,25(11):1076-1084.
[2]Lyall K,Croen L,Daniels J,et al.The Changing Epidemiology of Autism Spectrum Disorders[J].Annu Rev Public Health,2017,38:81-102.
[3]随广红,孙凌.儿童孤独症谱系障碍治疗的研究进展[J].中国妇幼保健,2020,35(11):2148-2150.
[4]Mazefsky CA,Schreiber DR,Olino TM,et al.The association between emotional and behavioral problems and gastrointestinal symptoms among children with high-functioning autism[J].Autism,2014,18(5):493-501.
[5]路晴,牟英峰,吴慧丽,等.孤独症谱系障碍儿童胃肠问题与核心症状及预后的相关分析[J].国际精神病学杂志,2019,46(3):474-476,480.
[6]李珂,季忆婷,江晓东,等.孤独症谱系障碍患儿胃肠问题与症状表现关联研究[J].中华实用儿科临床杂志,2019,34(10):768-772.
[7]柯晓燕.儿童孤独症谱系障碍治疗新进展[J].中国实用儿科杂志,2013,28(8):563-567.
[8]张丽华,李素水,张翠芳,等.孤独症谱系障碍的饮食干预研究进展[J].河北医药,2019,41(22):3478-3481.
[9]董培良,李慧,韩华.中药网络药理学的应用与思考[J].中国实验方剂学杂志,2020,26(17):204-211.
[10]Liu H,Wang J,Zhou W,et al.Systems approaches and polypharmacology for drug discovery from herbal medicines:an example using licorice[J].J Ethnopharmacol,2013,146(3):773-793.
[11]Hsin KY,Ghosh S,Kitano H.Combining machine learning systems and multiple docking simulation packages to improve docking prediction reliability for network pharmacology[J].PLoS One,2013,8(12):e83922.
[12]宗阳,丁美林,贾可可,等.基于网络药理学和分子对接法探寻达原饮治疗新型冠状病毒肺炎(COVID-19)活性化合物的研究[J].中草药,2020,51(4):836-844.
[13]American Psychiatric Association.The diagnostic and statistical manual of mental disorders:DSM-V[M].Washington DC:American Psychiatric Publishing Inc,2013.
[14]Bjorklund G.The role of zinc and copper in autism spectrum disorders[J].Acta Neurobiol Exp(Wars),2013,73(2):225-236.
[15]Luna RA,Savidge TC,Williams KC.The Brain-Gut-Microbiome Axis:What Role Does It Play in Autism Spectrum Disorder?[J].Curr Dev Disord Rep,2016,3(1):75-81.
[16]程艳然,熊振芳,卢金清,等.中西医结合干预自闭症的研究现状[J].湖北中医杂志,2017,39(5):63-66.
[17]周志杰.基于“肠脑轴”理论应用运脾法治疗儿童孤独症谱系障碍临床研究[D].北京:北京中医药大学,2019.
[18]Khlupova ME,Vasil′eva IS,Shumakovich GP,et al.Enzymatic polymerization of dihydroquercetin using bilirubin oxidase[J].Biochemistry(Mosc),2015,80(2):233-241.
[19]赵鑫,杨冰,周福军,等.花旗松素在Caco-2细胞模型中吸收转运机制及其抗炎活性研究[J].中草药,2020,51(16):4266-4271.
[20]Caglayan C,Temel Y,Kandemir FM,et al.Naringin protects against cyclophosphamide-induced hepatotoxicity and nephrotoxicity through modulation of oxidative stress,inflammation,apoptosis,autophagy,and DNA damage[J].Environ Sci Pollut Res Int,2018,25(21):20968-20984.
[21]Khodayar MJ,Kalantari H,Mahdavinia M,et al.Protective effect of naringin against BPA-induced cardiotoxicity through prevention of oxidative stress in male Wistar rats[J].Drug Chem Toxicol,2020,43(1):85-95.
[22]Ahmed S,Khan H,Aschner M,et al.Therapeutic potential of naringin in neurological disorders[J].Food Chem Toxicol,2019,132:110646.
[23]Rani N,Bharti S,Krishnamurthy B,et al.Pharmacological Properties and Therapeutic Potential of Naringenin:A Citrus Flavonoid of Pharmaceutical Promise[J].Curr Pharm Des,2016,22(28):4341-4359.
[24]Kesh S,Kannan RR,Balakrishnan A.Naringenin alleviates 6-hydroxydopamine induced Parkinsonism in SHSY5Y cells and zebrafish model[J].Comp Biochem Physiol C Toxicol Pharmacol,2021,239:108893.
[25]Zhou T,Liu L,Wang Q,et al.Naringenin alleviates cognition deficits in high-fat diet-fed SAMP8 mice[J].J Food Biochem,2020,44(9):e13375.
[26]張子龙,王志成,董一峰,等.橙皮素早期干预对APPswe/PS1dE9小鼠学习记忆能力及TLR2、NF-κB表达水平的影响[J].承德医学院学报,2020,37(3):188-191.
[27]Donato F,de Gomes MG,Goes AT,et al.Hesperidin exerts antidepressant-like effects in acute and chronic treatments in mice:possible role of l-arginine-NO-cGMP pathway and BDNF levels[J].Brain Res Bull,2014,104:19-26.
[28]Gaur V,Kumar A.Hesperidin pre-treatment attenuates NO-mediated cerebral ischemic reperfusion injury and memory dysfunction[J].Pharmacol Rep,2010,62(4):635-648.
[29]Li X,Chauhan A,Sheikh AM,et al.Elevated immune response in the brain of autistic patients[J].J Neuroimmunol,2009,207(1-2):111-116.
[30]Morgan JT,Chana G,Pardo CA,et al.Microglial activation and increased microglial density observed in the dorsolateral prefrontal cortex in autism[J].Biol Psychiatry,2010,68(4):368-376.
[31]Vargas DL,Nascinbene C,Krishnan C,et al.Neuroglial activation and neuroinflammation in the brain of patients with autism[J].Ann Neurol,2005,57(1):67-81.
[32]吴雷涛.薯蓣皂素调控ESR及其ERK/Akt信号通路促进SCs增殖的机制研究[D].西安:第四军医大学,2015.
[33]Pangrazzi L,Balasco L,Bozzi Y.Oxidative Stress and Immune System Dysfunction in Autism Spectrum Disorders[J].Int J Mol Sci,2020,21(9):3293.
[34]Scott TM,Guo H,Eichler EE,et al.BAZ2B haploinsufficiency as a cause of developmental delay,intellectual disability,and autism spectrum disorder[J].Hum Mutat,2020,41(5):921-925.
[35]Moessner R,Marshall CR,Sutcliffe JS,et al.Contribution of SHANK3 mutations to autism spectrum disorder[J].Am J Hum Genet,2007,81(6):1289-1297.
[36]Jamain S,Quach H,Betancur C,et al.Mutations of the X-linked genes encoding neuroligins NLGN3 and NLGN4 are associated with autism[J].Nat Genet,2003,34(1):27-29.
[37]Zhang T,Zhang J,Wang Z,et al.Association between CNTNAP2 polymorphisms and autism:A family-based study in the chinese han population and a meta-analysis combined with GWAS data of psychiatric genomics consortium[J].Autism Res,2019,12(4):553-561.
[38]世界中醫药学会联合会.网络药理学评价方法指南[J].世界中医药,2021,16(4):527-532.
[39]任艳,邓燕君,马焓彬,等.网络药理学在中药领域的研究进展及面临的挑战[J].中草药,2020,51(18):4789-4797.
[40]王子怡,王鑫,张岱岩,等.中医药网络药理学:《指南》引领下的新时代发展[J/OL].中国中药杂志:1-12[2021-09-28].https://doi.org/10.19540/j.cnki.cjcmm.20210914.702.
[41]Li S,Zhang B.Traditional Chinese medicine network pharmacology:theory,methodology and application[J].Chin J Nat Med,2013,11(2):110-120.
(2020-11-21收稿 责任编辑:杨觉雄)
