一种表达eGFP的rAAV-SaCas9系统的构建及应用
2021-10-30赵忆甜李秀青王晓帆张坤朋翁少亭河南农业大学动物医学院河南郑州450046安阳工学院生命与食品工程学院河南安阳455000
赵忆甜,李秀青,王晓帆,高 峰,张坤朋,翁少亭,* (.河南农业大学 动物医学院,河南 郑州 450046;.安阳工学院 生命与食品工程学院,河南 安阳 455000)
CRISPR/Cas9技术是一种相对成熟,并且简便易行的基因组定点编辑技术,是分子生物学研究和改善生物特性的常用技术[1-2],该技术可用于制备转基因动物[3-4]。ZHOU等[5]利用CRISPR/Cas9技术建立了敲除Park2和Pink1基因的细胞系,并用体细胞核移植的方法培育出了双基因突变猪。HEO等[6]利用CRISPR/Cas9技术将eGFP序列通过同源重组的方法插入到牛多功能干细胞的Nanog基因中,使胚胎能表达出eGFP荧光蛋白。KIMURA等[7]利用CRISPR/Cas9技术对斑马鱼的基因进行了基因组定点编辑,通过显微注射的方法将外源基因整合到胚胎的Evx2基因和Englb基因中。然而,转基因动物有抗病能力弱、易癌变、繁殖障碍的缺点,不能被畜牧生产广泛应用。因此需要一种既能改变家畜成体生产性能,又不影响家畜稳定遗传的方法推进畜牧业产能的提升。利用CRISPR/Cas9技术对组织的基因组进行定点编辑是理想的方法,但是,在组织内进行基因组编辑受到多种因素的影响,包括载体的选择、Cas9蛋白的编辑效率以及内部环境的影响等。CRISPR/Cas9的体内表达是通过流体动力学传递或病毒转导实现的,其中病毒转导常用腺病毒(Ad)或腺相关病毒(AAV)载体。以AAV作为Cas9的载体是一种很有潜力的基因组定点编辑工具[8]。CRUDELE等[9]利用该技术对遗传性肌营养不良疾病的特定肌肉区域进行了基因编辑,改善了肌肉萎缩症状。然而,许多CRISPR/Cas9相关元件太大,超过AAV的容量限制(包括两个ITR,约4.85 kb)。值得注意的是常用的化脓性链球菌Cas9(SpCas9)约为4.3 kb,与组合必需的基因调控元件结合后超过AAV的容量。克服这一障碍的一个方法是利用来自不同原核物种的较小的Cas9同源核酸酶,如嗜热链球菌Cas9(St1Cas9)、脑膜炎奈瑟菌Cas9(NmCas9)和金黄色葡萄球菌Cas9(SaCas9)的核酸酶,都具有与SpCas9相似的酶切能力,由于它们都比SpCas9短约1 kb[10-12],更有利于AAV的包装。这一障碍也可以通过优化调控元件克服。MEFFERD等[13]报道,可以由小的tRNA启动子(约70 bp)驱动sgRNAs的表达,其大小约为带有U6启动子的sgRNA表达盒的一半。TABEBORDBAR等[14]重建了一个新的AAV-SaCas9载体,由EF1α启动子驱动SaCas9的表达。还有研究人员构建了pX601-miniCMV-SaCas9-U6-sgRNA载体,由只有39 bp的miniCMV启动子驱动SaCas9的表达。改进的rAAV系统能够容纳Cas9蛋白、sgRNA以及其他可以提高rAAV组织嗜性、靶向性或进行荧光标记的调控元件[15]。
肌肉生长抑制素(myostatin,简写MSTN,又称GDF8)是转化生长因子β(TGF-β)信号蛋白超家族成员,是脊椎动物肌肉质量的重要调节因子,能抑制肌肉细胞的增殖和分化。MSTN功能障碍可促进肌肉生长,引发动物超级肌肉表型[16-17]。世界著名的比利时兰牛和皮埃蒙特牛就是由于Mstn基因突变导致的“双肌牛”。KIRK等[18]发现MSTN与成年动物肌肉萎缩和肌肉再生有关,它是次级肌纤维萎缩因子,再生的肌管部分MSTN含量极低。一系列研究表明,MSTN缺乏的家畜有背膘厚、生长快、饲料转化率和瘦肉率高等优良生产性能。本研究构建了一个针对特定组织的rAAV-SaCas9-eGFP基因编辑系统,该系统能通过eGFP在体内的表达间接了解rAAV-SaCas9-eGFP的存在时间以及在组织中的分布。此外,通过该系统敲除小鼠肌肉中的Mstn基因,可以有效地增加肌肉细胞的数量和体积,为培养高产肉用型家畜提供参考。
1 材料与方法
1.1 质粒、感受态细胞、细胞和实验动物pX601(pX601-CMV:SaCas9-U6:sgRNA)、pLentiCRISPR V2、th-P2A-eGFP、pAAV9-RC和pHelper由河南农业大学动物分子生物技术实验室保存;TOP10感受态细胞由河南农业大学动物分子生物技术实验室制备;HEK293T细胞由河南农业大学动物分子生物技术实验室提供;8周龄C57BL/10雄性小鼠由河南农业大学动物分子生物技术实验室饲养。
1.2 试剂ClonExpressⅡ一步克隆试剂盒为南京诺唯赞生物科技有限公司产品;KpnⅠ、NotⅠ、XhoⅠ、AgeⅠ、BamHⅠ、BbsⅠ、T7核酸内切酶Ⅰ为NEB(北京)有限公司产品;胎牛血清(FBS)、DMEM培养基、磷酸盐缓冲液(PBS)、RIPA裂解缓冲液为赛默飞世尔科技(中国)有限公司产品;PEI转染试剂为Sigma试剂公司产品;PEG8000、氯化铯、透析袋为源叶生物科技有限公司产品;组织和细胞基因组DNA提取试剂盒为天根生化科技(北京)有限公司产品;SYBR Green 染色液为庄盟生物科技有限公司产品;兔多克隆抗MSTN、GAPDH抗体、辣根过氧化物酶(HRP)标记山羊抗兔抗体为北京博奥森生物技术有限公司产品。
1.3 psgMstn载体的构建所有质粒均采用标准重组DNA克隆技术构建。tRNAGLN和sgRNA骨架序列(5′-GGTTCCATGGTGTAATGGTTAGCAC-TCTGGACTCTGAATCCAGCGATCCGAGTTC-AAATCTCGGTGGAACCT-GAAACACCGGAG-ACCACGGCAGGTCTCAGTTTTAGTACTCTG-GAAACAGAATCTACTAAAACAAGGCAAAA-TGCCGTGTTTATCTCGTCAACTTGTTGGCG-AGA-3′)由生工生物工程(上海)股份有限公司合成。用引物tRNAGLN-F:5′-AGGCATGCTGGGGAGGTACCGGTTCCATGGTGTAATGGTT-3′,Scaf-R:5′-CTAGGGGTTCCTGCGGCCGCAAAA-ATCTCGCCAACAAGTTG-3′扩增合成序列,用ClonExpressⅡ一步克隆试剂盒将其克隆至被KpnⅠ和NotⅠ酶切后的pX601-CMV:SaCas9-U6:sgRNA中。将构建的载体转化进TOP10感受态细胞,通过测序鉴定筛选出含有质粒pX601-CMV:SaCas9-tRNA:sgRNA的菌株,扩大培养并提取质粒。用引物EF1α-F:5′-CCTGCGGCCTCTAGAC-TCGAGGTGGGCAGAGCGCACATCGC-3′,EF1-α-R:5′-TGGGGCCATGGTGGCACCGGTCCTGTGTTCTGGCGGCAAAC-3′从pLentiCRISPR V2载体中扩增出EF1α启动子,然后,在紧邻pX601-CMV:SaCas9-tRNA:sgRNA SaCas9基因的XhoⅠ和AgeⅠ位点酶切,并用ClonExpressⅡ一步克隆试剂盒将EF1α启动子插入其中,获得pX601-EF1α:SaCas9-tRNA:sgRNA。利用引物P2A-eGFP-F:5′-CCGGCCAGGCAAAAAAGAAAAAGGCTACTAATTTCTCCT-3′,P2A-eGFP-R:5′-ATCTG-GAACATCGTATGGGTCTTGTACAGCTCGTC-3′从th-P2A-eGFP供体中扩增出P2A-eGFP基因,用ClonExpressⅡ一步克隆试剂盒将P2A-eGFP基因克隆到BamHⅠ酶切后的pX601-EF1α:SaCas9-tRNA:sgRNA载体,获得pX601-EF1α:SaCas9-eGFP-tRNA:sgRNA,其结构如图1所示。寡核苷酸sgMstn-F:5′-CACCGAAACAATCATTACCATGCCTA-3′,sgMstn-R:5′-AAACTAGGCATGGTAATGATTGTT-TC-3′经退火反应形成双链,将之插入到pX601-EF1α:SaCas9-eGFP-tRNA:sgRNA的BbsⅠ位点,构建出质粒pX601-EF1α:SaCas9-eGFP-tRNA:sgMstn(缩写为psgMstn)。
1.4 rAAV9-eGFP-sgMstn病毒的包装与纯化为了包装rAAV9-eGFP-sgMstn病毒,将HEK293T细胞以5×106个/皿密度接种于100 mm细胞培养皿,添加含10%FBS的DMEM培养基,37℃、5% CO2条件下培养。细胞长至50%~60%融合后,按照PEI转染试剂说明书,将psgMstn、pAAV9-RC和pHelper 3个质粒共转染细胞,转染后8 h更换新鲜DMEM培养基,转染后96 h,将细胞刮入培养基后统一收集到50 mL离心管中, 1 000×g离心10 min,收集上清到另一50 mL 离心管,将细胞重悬于5 mL的PBS中,在-80℃和37℃下对细胞悬浮液反复冻融3次,释放细胞内病毒。离心后取上清用0.22 μm过滤器过滤,收集细胞过滤液与之前的上清混匀,用PEG8000浓缩,通过氯化铯密度梯度柱进行纯化。经过两轮超速离心,分离并收集高密度病毒,通过透析袋脱盐后置于-80℃备用。将质粒pX601从1×1011拷贝/μL稀释至1×104拷贝/μL 作为标准品溶液,利用引物ITR-QPCR-F:5′-CGGCCTCAGTGAGCGA-3′,ITR-Q-PCR-R:5′-AGGAACCCCTAGTGATG-3′,通过RT-PCR方法测定纯化的rAAV9-eGFP-sgMstn的病毒滴度[19]。
1.5 rAAV9-eGFP-sgMstn在肌肉组织特定位点的表达AAV9对肌细胞具有嗜性强,有利于细胞内的基因编辑,常被应用于肌肉组织。将15只C57BL/10雄性小鼠分为3组,5只/组,在第1试验组小鼠左侧大腿股四头肌注射50 μL(5×1010vg)rAAV9-eGFP-sgMstn;在第2试验组小鼠左侧大腿内收肌注射50 μL(5×1010vg)rAAV9-eGFP-sgMstn;对照组小鼠的左侧大腿两处肌肉各注射50 μL PBS。在第8周处死小鼠,观察大腿肌肉中eGFP荧光的表达与分布。
1.6 肌肉组织注射rAAV9-eGFP-sgMstn对小鼠大腿肌肉质量的影响将30只C57BL/10雄性小鼠分为2组, 15只/组,试验组小鼠左侧大腿肌肉分3个点注射100 μL(1×1011vg)rAAV9-eGFP-sgMstn,对照组小鼠左侧大腿肌肉分3个点注射100 μL PBS。在第6,8,10周,每周处死5只小鼠,用荧光成像系统检测组织荧光的表达。取肌肉分别进行基因组DNA提取、总蛋白提取和肌肉组织固定。
1.7 T7核酸内切酶1(T7E1)裂解分析根据组织和细胞DNA提取剂盒说明书提取肌肉组织基因组DNA。以纯化的基因组DNA为模板,用特异性引物Mstn-Test-F:5′-CGCCTGGAAACAGCTCCT-AA-3′,Mstn-Test-R:5′-TCTCA TGCTTTAACACTGCCT-3′扩增Mstn基因片段,拟扩增片段大小为521 bp。PCR产物用T7E1裂解,裂解产物经1.5%琼脂糖凝胶电泳分离,用SYBR Green 染色液孵育1 h,用凝胶成像系统拍照。用 Imge J 定量软件计算 Indel 率,公式为:indel(%)=100%×(1-√1-f(cut)),f(cut)=(a+b)/(a+b+c),a 和 b 表示切割产生的新条带的灰度值,c 表示未被切割条带的灰度值。
1.8 蛋白免疫印迹分析将部分股四头肌组织匀浆后加入500 μL RIPA裂解缓冲液(50 mmol/L TrisHCl,pH8.0,150 mmol/L NaCl,1% TritonX-100,1%脱氧胆酸钠,0.1%十二烷基硫酸钠和2 mmol/L MgCl2),在冰上用注射器对混合物吸吹30次以上,4℃ 10 000×g离心20 min去除细胞碎片,收集上清液。用BCA法测定蛋白浓度,在样品中加入6 ×上样缓冲液(2.7 mol/L尿素、3.3%十二烷基硫酸钠和0.167 mol/L Tris,pH6.7)在100℃下加热10 min。用10% SDS-PAGE凝胶分离30 μg 蛋白样品,然后转移到PVDF膜上。在5%脱脂牛奶中孵育1 h后,将膜与兔抗MSTN、兔抗GAPDH多克隆抗体(1∶1 000)在4℃下孵育过夜,洗净一抗后,加入HRP标记的山羊抗兔抗体(1∶2 000),于室温下孵育1 h。目的蛋白用Luminata Crescento免疫印迹HRP底物检测。
1.9 组织学分析用10%多聚甲醛固定分离的股四头肌和内收肌,石蜡包埋后做成组织切片,用苏木精和伊红染色切片[20]。每组分别在放大倍数为40×,200×的视野下分析至少5个位点,计算出单个肌细胞的平均横截面积(μm2)。所有数据均用Image Proplus 6.0软件进行分析。
1.10 小鼠肌肉质量注射rAAV9-eGFP-sgMstn后10周,分别取各组小鼠左侧大腿的股四头肌和内收肌,测其质量并记录。
2 结果
2.1 CRISPR/SaCas9载体的构建重点构建了pX601-EF1α:SaCas9-eGFP-tRNA:sgRNA载体用于包装rAAV9-eGFP-sgMstn,该载体通过EF1α启动子控制SaCas9和eGFP的表达,SaCas9通过自切割序列P2A与eGFP相连,通过tRNA启动子控制sgRNA表达。P2A序列使SaCas9和eGFP能够从同一顺反子中产生两个独立的具有功能的蛋白,可通过eGFP蛋白的表达间接了解rAAV的转导效率和SaCas9介导的基因编辑(图1)。
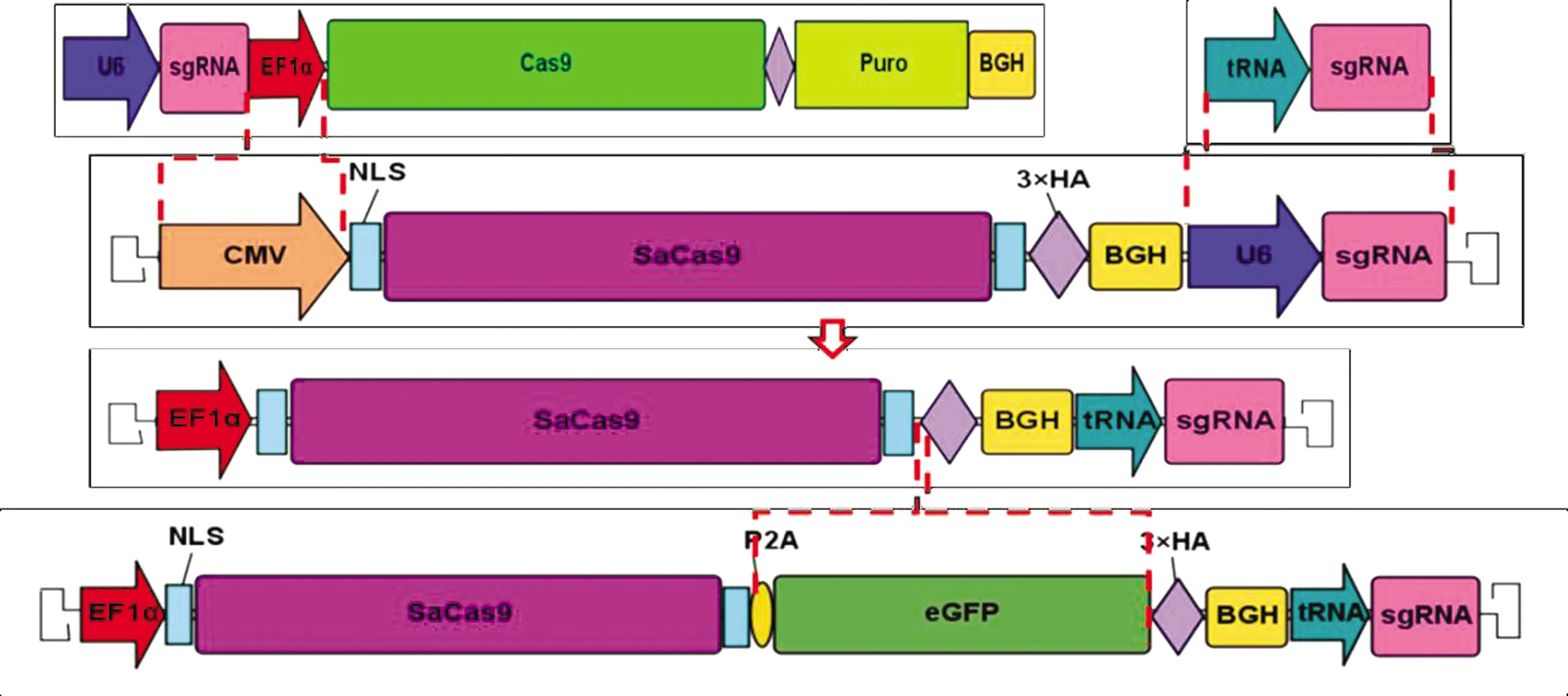
图1 包含EF1α:SaCas9-eGFP-tRNA:sgRNA的SaCas9/CRISPR系统构建示意图
2.2 rAAV9-eGFP-sgMstn在肌肉组织特定位点高效表达eGFP,通过eGFP评估rAAV9-eGFP-sgMstn在肌肉组织特定位点是否表达。结果发现,在试验1组和试验2组中,分别在小鼠左侧的股四头肌和内收肌中可见明显的绿色荧光,在周围组织中未见荧光。在对照组小鼠左侧的对应肌肉中未观察到绿色荧光(图2),表明rAAV9-eGFP-sgMstn在体内肌肉细胞中成功表达,并且只存在于注射的特定部位,没有扩散至其他组织。这一结果为后续肌肉组织细胞的基因编辑试验做好了rAAV有效性及安全性验证。

CN.注射PBS的对照组;EG-1.股四头肌注射rAAV9-eGFP-sgMstn的试验1组;EG-2.内收肌注射rAAV9-eGFP-sgMstn的试验2组图2 小鼠肌肉特定位点的eGFP表达
2.3 rAAV9-eGFP-sgMstn在小鼠大腿肌肉中长期稳定表达通过荧光成像系统观察到,从第6周开始,在试验组小鼠大腿肌肉能检测到明显的绿色荧光,并且一直持续至第10周,绿色荧光随着时长的增加呈现递增的趋势,而对照组小鼠大腿肌肉始终没有荧光表达(图3),说明试验组中rAAV9-eGFP-sgMstn可在小鼠肌细胞中持续稳定表达,并且在一定时间范围内该重组病毒的表达量随着时间的增加而增加。

注:图像范围为2×1010~5×1010 photons/(s·cm2);采取背侧位置进行荧光成像;CN为对照组图3 eGFP在小鼠肌细胞中持续稳定表达
2.4 rAAV9-eGFP-sgMstn对小鼠肌细胞的基因编辑通过T7酶切鉴定法检测对Mstn基因片段的编辑效率,结果显示,Mstn基因片段的大小为521 bp,试验组中目的片段下有长度分别为181,340 bp的2个条带,而对照组中则没有这两条带(图4A)。通过对条带的灰度分析得出试验组的正常Mstn片段的相对含量为79.17%,其基因编辑效率为20.83%(图4B)。此外,Western blot结果显示,与对照组相比,试验组小鼠肌肉中MSTN蛋白水平明显降低(图4C),对蛋白条带的灰度进一步分析得出试验组MSTN蛋白相对表达量为47.95%(图4D)。结果表明,rAAV9-eGFP-sgMstn对小鼠肌细胞中的Mstn基因进行了有效地编辑并影响了MSTN蛋白的表达。
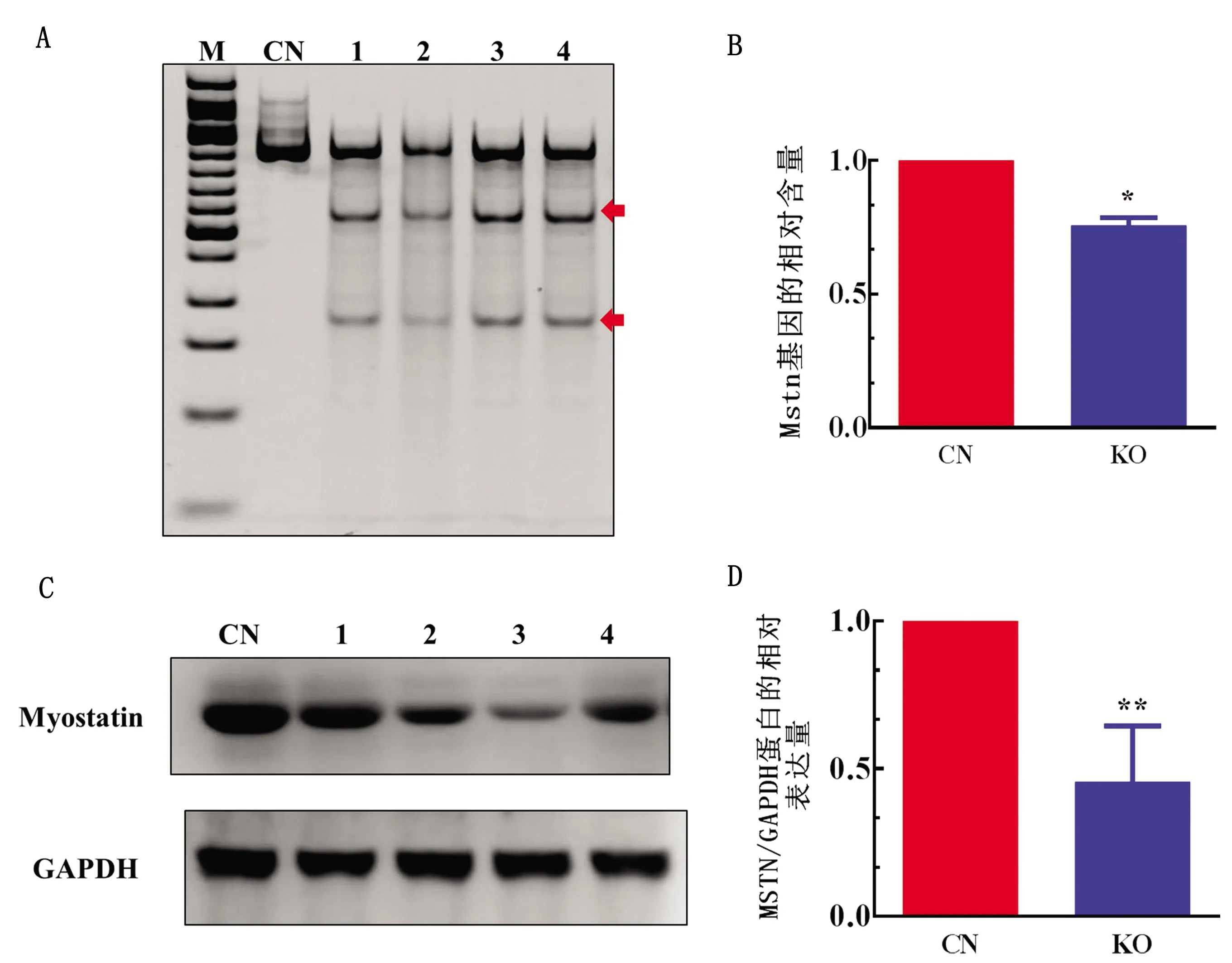
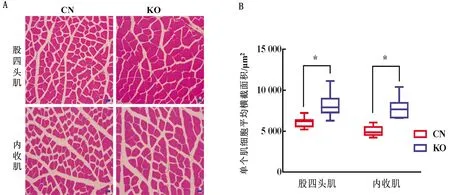
A.T7酶切鉴定法检测基因编辑(M.50 bp DNA Marker;CN.对照组;1~4.试验组);B.Mstn基因的相对表达量(CN.对照组;KO.试验组); C.MSTN蛋白免疫印迹分析(CN.对照组;1~4.试验组);D.MSTN蛋白的相对表达量(CN.对照组;KO.试验组)。*.0.01 2.5 rAAV9-eGFP-sgMstn对小鼠肌肉性状的影响观察小鼠肌肉组织切片发现,与对照组相比,试验组小鼠股四头肌和内收肌显著增大,肌细胞数量也明显增加(图5A)。此外,通过对每组小鼠的股四头肌和内收肌测定质量,发现试验组小鼠股四头肌和内收肌的平均质量明显高于对照组(图5B)。这些结果表明,肌肉组织注射rAAV9-eGFP-sgMstn可使单位面积内肌细胞数量增多,并且使肌肉质量增加。 A.股四头肌和内收肌切片苏木精和伊红染色(HE)结果(CN.对照组;KO.试验组;比例尺.200 μm);B.10周时各组小鼠股四头肌和内收肌的质量(CN.对照组;KO.试验组)图5 rAAV9-eGFP-sgMstn对小鼠肌肉性状的影响 2.6 rAAV9-eGFP-sgMstn对小鼠肌肉质量的影响小鼠肌细胞切片发现,试验组小鼠股四头肌和内收肌细胞横截面积比对照组明显增大(图6A)。其中试验组小鼠股四头肌细胞的平均横截面积为7 806 μm2,内收肌细胞的平均横截面积为7 315 μm2。而对照组小鼠股四头肌细胞的平均横截面积为5 882 μm2,内收肌细胞的平均横截面积为4 985 μm2,表明rAAV9-eGFP-sgMstn使小鼠肌细胞横截面积增大(图6B)。 A.股四头肌和内收肌切片苏木精和伊红染色(HE)显示肌细胞的横截面(CN.对照组;KO.试验组;比例尺.50 μm);B.各组小鼠股四头肌和内收肌细胞的横截面积(CN.对照组;KO.试验组。数据用单因素方差分析进行分析)图6 rAAV9-eGFP-sgMstn对小鼠肌细胞的影响 目前rAAV-SaCas9系统已被证实能在体内进行定点基因编辑[12],而且该系统有与SpCas9系统类似的编辑效率。因此,rAAV-SaCas9系统可能被用来编辑特定部位的基因,以改善组织特性和治疗慢性病[21-22]。本研究构建了一个具有不同sgRNA启动子(tRNA promoter,72 bp)和SaCas9启动子(EF1α promoter,212 bp)的SaCas9系统,该系统可以仅通过一种rAAV传递到细胞中介导基因组编辑。 由于AAV血清型、病毒滴度和注射方法的不同,AAV在组织中介导的基因编辑效率是不同的[23]。本试验选用9型AAV进行肌肉注射是因为9型AAV对肌肉组织有高度嗜性,病毒利用度更高,因此对特定位点的基因编辑效果更好。在试验中发现,将rAAV9-eGFP-sgMstn系统注入小鼠大腿肌肉后,eGFP的表达仅限于该区域内,没有发生病毒在周围组织的扩散。而且在一定时间内,rAAV9-eGFP-sgMstn作用时间越长,eGFP的荧光强度越高。因此,通过eGFP表达能间接得知病毒的感染量和SaCas9的基因编辑效果。 越来越多的研究证实,成肌细胞增殖随MSTN水平的升高而降低,通过降低或抑制MSTN活性能加速细胞周期,促进成肌细胞的增殖。THOMAS等[24]和JOULIA等[25]发现MSTN上调细胞周期蛋白依赖激酶抑制剂的活性和水平,从而阻止细胞由G1期向S期的转变,抑制肌肉细胞的增殖,并减少肌肉纤维的数量。MCPHERROR等[26]通过基因敲除技术构建了Mstn基因突变纯合体小鼠,发现在Mstn突变小鼠中,肌肉纤维的数量比野生型小鼠多86%,表明Mstn基因敲除导致肌肉纤维增殖和肥大。JI等[27]将Mstn基因敲除鼠与野生型进行比较,发现Mstn基因敲除后小鼠脂肪含量减少。所以,对家畜的Mstn基因进行敲除能提高家畜产肉性能和瘦肉率。本研究通过核酸及蛋白分析证明,构建的rAAV9-eGFP-sgMstn系统可对大腿肌肉细胞Mstn进行有效编辑。此外,该系统通过敲除Mstn基因显著改善肌肉质量和体积,为该系统应用于畜牧业生产奠定了基础。 综上所述,本研究构建的rAAV9-eGFP-sgMstn系统可在体内稳定表达,而且只在注射的特定位点进行表达并对Mstn基因进行编辑,导致肌肉质量和肌细胞体积显著增大,表明rAAV9-eGFP-sgMstn系统在提高家畜生产性能方面具有巨大的潜力。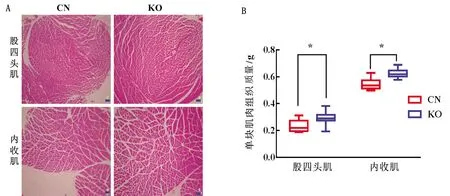
3 讨论
