林麝源大肠埃希菌的分离、鉴定及耐药性与致病性分析
2021-10-30赵学亮王晨骁王兴龙党如意杨增岐西北农林科技大学动物医学院陕西杨凌712100
赵学亮,李 哲,王晨骁,王 娟,王兴龙,党如意,杨增岐 (西北农林科技大学 动物医学院,陕西 杨凌 712100)
林麝(Moschusberezovskii)属于偶蹄目、麝科(Moschidae)、麝属(Moschus),是亚洲特有野生动物,也是我国一级重点保护动物[1]。麝香是雄性成年林麝分泌物,因其广泛的经济和药用价值,被列为我国传统4大名贵药材[2]。由于人们长期以来过度捕猎以及环境破坏,野生林麝已濒临灭绝[3-4],因此人工饲养繁殖林麝,不仅可以实现野生林麝资源保护,同时也可以解决麝香供需问题。在饲养条件下,大肠杆菌等细菌病感染已成为制约林麝养殖业发展的重要因素,尤其是幼麝感染大肠杆菌后容易导致继发感染,在临床上很难治愈[4-5]。
大肠杆菌(Escherichiacoli,E.coli)又称为大肠埃希菌,属肠杆菌科(Enterobacteriaceae)肠杆菌属(Escherichia),是临床上最常见的革兰阴性短杆菌病原菌之一,也是近年来动物传染病学及流行病学领域重要的研究对象之一[6-7]。一般情况下,大肠埃希菌不具有致病性,但近年来越来越多的致病性大肠埃希菌被报道,这些菌常携带毒力基因和耐药基因,威胁人类及动物健康。根据生物学特性将致病性大肠埃希菌分为5大类:肠出血性大肠埃希菌(enterohemorrhagicE.coli,EHEC)、肠致病性大肠埃希菌(enteropathogenicE.coli,EPEC)、肠黏附性大肠埃希菌(enteroaggregativeE.coil,EAEC)、肠侵袭性大肠埃希菌(enteroinvasiveE.coli,EIEC)和肠产毒性大肠埃希菌(enterotoxigenicE.coli,ETEC)[8]。目前在临床上针对大肠埃希菌引起的感染仍以抗生素治疗为主,然而随着抗生素长期的广泛使用,导致耐药菌株不断出现,并且呈现多重耐药和交叉耐药严重的发展态势[9]。李怡瑾等[10]对我国陕西省、四川省林麝的肠源大肠埃希菌进行研究发现,该菌对青霉素、庆大霉素、链霉素、四环素、氯霉素都具有较强的耐药性。质粒和接合转座子介导的耐药基因传递是大多数大肠埃希菌耐药性传播的方式,这些基因可通过接合或转化转移至其他菌中表达并稳定传代[11]。目前,关于林麝肺源大肠埃希菌耐药性和致病性的研究鲜有报道。2020年陕西省安康市某林麝场林麝出现严重腹泻、脱水,1个月内连续死亡6只,剖检后可见心包腔积液、皱胃、小肠和大肠内容物呈灰黄色半液体状并伴鼓气,黏膜充血,淋巴结肿胀发黑。从病死林麝肺脏分离出1株病原菌,结合多种方法确定其为大肠埃希菌,对其进行耐药性和致病性检测,并设计16对引物对该菌株进行毒力基因检测,以期为林麝养殖过程中大肠埃希菌病的防制、用药及控制耐药性传播提供科学依据。
1 材料与方法
1.1 试验样品无菌采集陕西省安康市某林麝养殖场病死林麝肺脏样本,由西北农林科技大学动物医学院进行病原菌的分离、鉴定。
1.2 主要试剂Luria-Bertani(LB)培养基、麦康凯培养基、伊红美蓝培养基、Mueller-Hinton(MH)培养基、大肠杆菌显色培养基等均购自海博生物技术有限公司;细菌微量生化鉴定管及药敏纸片等购自杭州滨和微生物试剂有限公司;革兰染色液试剂盒购自北京索莱宝科技有限公司;DL2000 DNA Marker、2×Taq PCR Master Mix均购自上海基星生物科技有限公司;细菌基因组提取试剂盒购自天根生化试剂(北京)有限公司;PCR反应引物合成及产物测序均由西安擎科生物科技有限公司完成。
1.3 主要仪器光学显微镜购自上海光学公司;PCR仪及移液枪购自Eppendorf公司;电泳仪购自北京六一仪器厂;凝胶成像仪购自Kodak公司。
1.4 引物合成16S rDNA通用引物(16S-27F:5′-AGAGTTTGATCMTGGCTCAG-3′,16S-1492R:5′-TACGGYTACCTTACGACTT-3′)、phoA鉴定引物(phoA-F:5′-GGCAATACACTCACTATGCGCTG-3′,phoA-R:5′-AGGATTCGCAGCATGATCCTG-3′)、分子分群所需的ChuA、YjaA、TspE4C2和arpA等4对引物[12]及毒力基因鉴定所需的sfa、cnf1、papC、hlyA、rfc、sepA、etrA、aer、faeG、fasA、eltA、estA、eaeA、exhA、stx1和stx2等16对引物[13-17]均由西安擎科生物科技有限公司合成。
1.5 细菌的分离纯化用接种环无菌穿刺采集林麝样本,分别接种于麦康凯培养基和伊红美蓝培养基,于37℃温箱中培养12~16 h。挑取单菌落重复培养纯化,最后在显色培养基上划线,过夜培养,根据细菌形态特征将培养菌落进行革兰染色后镜检。
1.6 分离菌株鉴定根据《伯杰氏细菌鉴定手册》进行细菌生化鉴定,具体步骤按杭州滨和微生物试剂有限公司生化鉴定管操作说明进行。phoA基因鉴定扩增反应体系25 μL:2×Taq PCR Master Mix 12.5 μL,27F和1492R引物各1 μL,DNA模板2 μL,加ddH2O补足至25 μL。反应条件:95℃ 5 min;95℃ 15 s,50℃ 20 s,72℃ 40 s,35个循环;72℃ 10 min。PCR产物通过1.5%的琼脂糖凝胶电泳进行检测。
1.7 分离菌株16S rDNA扩增与序列分析以细菌DNA为模板,以16S rRNA基因的27F和1495R为通用引物进行PCR扩增,反应体系25 μL:2×Taq PCR Master Mix 12.5 μL,27F和1492R引物各1 μL,DNA模板1 μL,加ddH2O补足至25 μL。PCR反应条件:95℃ 5 min;95℃ 1 min,50℃ 1 min,72℃ 2 min,30个循环;72℃ 8 min。PCR产物经1.5%的琼脂糖凝胶电泳进行检测后送测序,将菌株命名为LS202010。测序结果在NCBI数据库中进行同源性比对,利用MEGA X软件构建遗传进化树。
1.8 药敏试验将菌株接种于LB培养基,在37℃过夜振荡培养,用0.5麦氏浊度的麦氏管进行比对。将菌液浓度调至1.5×107CFU/mL,均匀涂布于MH培养基表面,采用Kirby-Barer纸片法,将19种药敏纸片贴在培养基上,30℃倒置培养24 h,根据抑菌圈直径大小,参照2020中文版《M100抗微生物药物敏感性试验执行标准》评定敏感、中介及耐药。
1.9 分子分群及毒力基因检测分子分群4重PCR反应体系25 μL:2×Taq PCR Master Mix 12.5 μL,ChuA(279 bp)、YjaA(211 bp)、TspE4C2(152 bp)和arpA(400 bp)等4对引物各1 μL,DNA模板2 μL,用ddH2O补足至25 μL。PCR反应条件:94℃ 4 min;94℃ 4 s,59℃ 20 s,30次循环;72℃ 5 min。毒力基因检测根据文献[18]进行操作。
1.10 小鼠致病性试验将9只21日龄昆明小鼠随机分为3组,每组3只。第1,2组灌服未过滤的LS202010培养物,分别按0.2 mL/只(2×109CFU/mL)、0.5 mL/只(5×109CFU/mL)接菌,第3组灌服生理盐水,0.5 mL/只,作为阴性对照,接菌后分开饲养小鼠,观察小鼠健康状态。
2 结果
2.1 大肠埃希菌的分离及生化鉴定LS202010在麦康凯培养基上呈光滑的桃红色菌落,在伊红美蓝培养基上呈黑色金属光泽菌落,在大肠埃希菌显色培养基上呈蓝色菌落,革兰染色镜检呈阴性。生化鉴定结果显示,LS202010对乳糖、葡萄糖、麦芽糖、三糖铁、吲哚试验、蛋白胨、木糖、赖氨酸脱羧酶、甘露醇和木糖试验均呈阳性;VP试验、枸橼酸盐、硫化氢、氧化酶、山梨醇和尿素酶试验均呈阴性;符合大肠埃希菌的生化特征。对大肠埃希菌特异性基因phoA进行PCR扩增,用1.5%的琼脂糖凝胶电泳检测LS202010的PCR扩增产物,在761 bp处可见特异性扩增条带(图1)。

M.DL2000 DNA Marker;1~3.分离菌株LS202010图1 分离菌株LS202010 phoA基因PCR扩增
2.2 大肠埃希菌16S rRNA基因的测序分析以16S rRNA基因通用引物对LS202010的 DNA进行PCR扩增,通过1.5%的琼脂糖凝胶电泳检测扩增产物,结果如图2所示,在1 450 bp处可见特异性扩增条带。将测序结果与GeneBank数据库比对并构建遗传进化树,结果如图3所示,LS202010株与挪威分离株LR883965.1同源性最高,表明该菌株是大肠埃希菌。

M.DL2000 DNA Marker;1~3.分离菌株LS202010图2 分离菌株LS202010 16S rRNA PCR扩增

图3 分离菌株LS202010 16S rRNA 基因序列遗传进化树
2.3 药敏检测结果显示,分离菌株LS202010对阿莫西林、复方阿莫西林、泰万菌素、氨苄西林、泰乐菌素、氨苄青霉素、头孢噻呋钠、金霉素、新霉素、复方磺胺氯达嗪钠、安普霉素耐药,表明分离株LS202010具有多重耐药性。
2.4 分子分群及毒力基因检测分子分群结果显示,分离菌株LS202010经4重PCR扩增(图4),可以特异性扩增出arpA(400 bp)和TspE4C2(152 bp)基因,表明此菌株属于A、B1、B2、C、D、E和F中的B1群。

M.DL750 DNA Marker;1.arpA;2.TspE4c2;3.ChuA;4.YjaA;5.4重PCR图4 菌株LS202010的分群鉴定
毒力基因检测结果显示,分离菌株LS202010经PCR反应,可以扩增出毒力基因etrA,且片段大小与预期一致(图5),表明此菌株属于致病性大肠埃希菌中的EAEC。
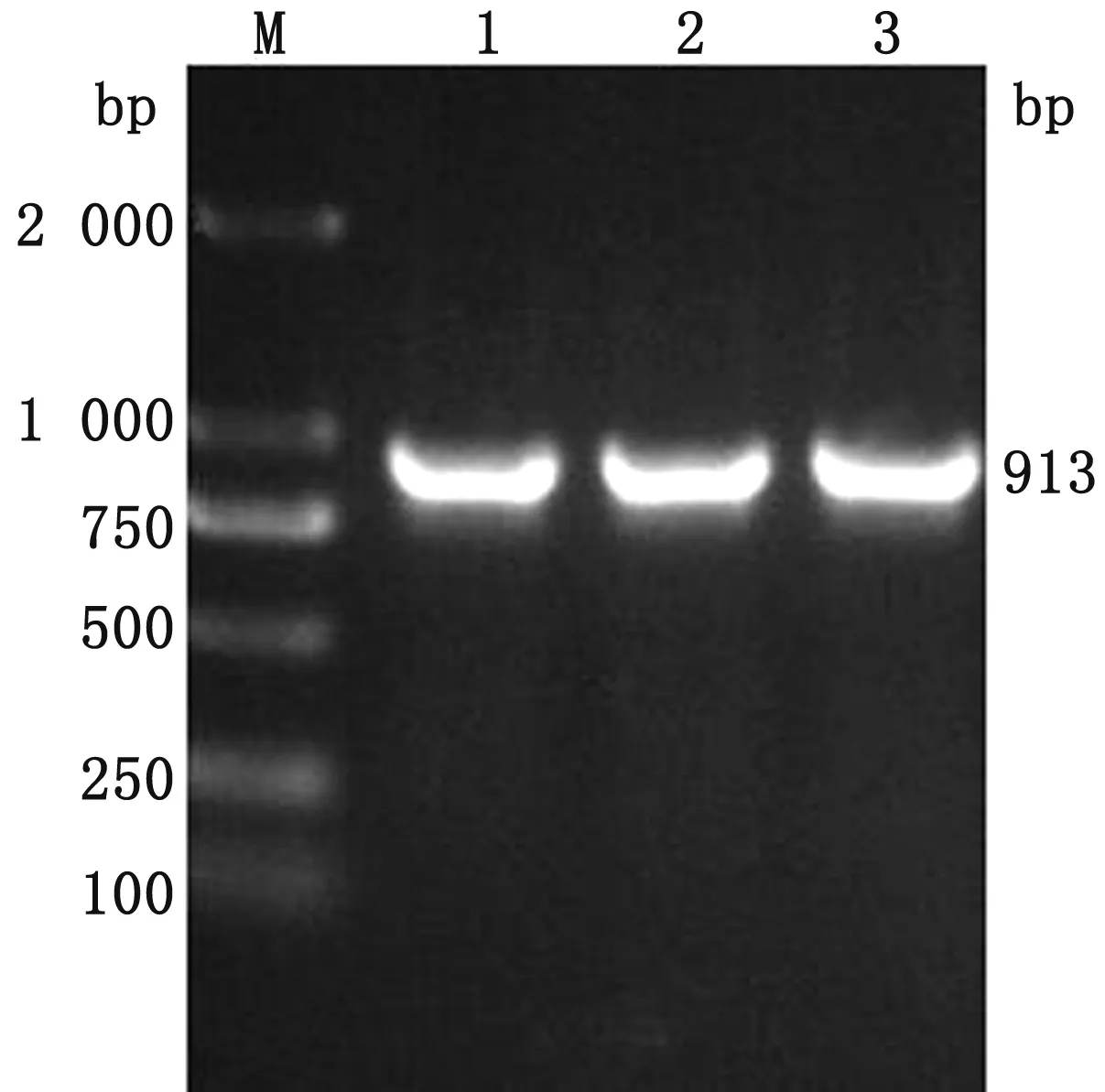
M.DL2000 DNA Marker;1~3. etrA基因扩增结果图5 分离菌株etrA毒力基因PCR扩增
2.5 小鼠致病性试验用不同浓度的菌液腹腔接种昆明小鼠,结果显示,菌液浓度为2×109CFU/mL组的3只小鼠均发生严重腹泻,精神沉郁;菌液浓度为5×109CFU/mL组的3只小鼠均发生严重腹泻,48 h后死亡2只;而生理盐水对照组小鼠未发生腹泻。对腹泻小鼠粪便和死亡小鼠肺脏进行细菌分离、培养和鉴定,结果分离出和原始菌相同的大肠埃希菌。
3 讨论
林麝作为一种珍稀的保护动物,目前虽然已经在陕西、四川等多个地方规模化养殖,但林麝数量一直无法稳定增长,除外界环境的变化外,细菌病感染也是制约林麝数量发展的重要原因之一[19-20]。当动物免疫力低下或身患创伤时,易感染大肠埃希菌,出现腹泻、肠炎等一系列症状,严重会导致死亡,使林麝养殖遭受巨大经济损失。大肠杆菌还会通过动物传播给人类,导致腹泻,肠炎等症状[21]。
近年来,国内外有关致泻大肠埃希菌的研究逐渐增多,EAEC作为重要的致病菌之一,已成为腹泻病研究的重点[22]。大肠埃希菌作为一种条件致病菌,可感染人、牛、羊、猪、鸡等多种动物。本试验首次从安康市林麝中分离纯化出优势菌株LS202010,经过综合分析,证明此菌株为致泻性大肠埃希菌中的EAEC。秦思等[23]对江苏省2018-2019年食源性疾病中致泻大肠埃希菌的流行特征及耐药性进行分析,结果显示EAEC型占36.48%,多重耐药率为64.81%。李怡瑾等[10]对林麝肠源和圈舍土源大肠埃希菌分离鉴定及耐药基因检测,结果显示,2种来源的大肠埃希菌均对青霉素、庆大霉素、链霉素、四环素、氯霉素等常用抗生素具有较强耐药性。本试验中大肠埃希菌分离株LS202010对阿莫西林、复方阿莫西林、泰万菌素、氨苄西林、泰乐菌素、氨苄青霉素、头孢噻呋钠、金霉素、新霉素、复方磺胺氯达嗪钠、安普霉素等抗生素耐药,而对恩诺沙星、链霉素敏感,因此当林麝患致泻大肠埃希菌病时,可用恩诺沙星和链霉素交替联合用药。耐药现象严重的原因,除了人们对抗菌药物盲目使用和监管缺失外,现代生产、生活方式对生态环境的破坏也是驱动耐药性进化和传播的重要原因。而随着耐药“基因池”的不断增大,将有更多耐药细菌的出现,长此以往,人类未来如何赢得与细菌感染性疾病之间的“战役”值得深思[24-27]。
由于菌株来源不同,携带毒力基因不同,其致病能力也不同,因此,检测分离菌株携带的毒力基因对研究大肠埃希菌的致病性具有指导意义。本试验中毒力基因鉴定和小鼠致病性试验结果显示,LS202010属于致泻大肠埃希菌,除含有毒力基因etrA外,该菌株是否还含有其他毒力基因还需进一步测序分析。另外,根据分子分群结果,LS202010属于B1群,而不同分型之间大肠埃希菌的致病性与耐药性是否有关系,值得深入探索。
本试验从患病林麝体内分离出1株优势菌LS202010,通过解剖观察、细菌分离、培养、革兰染色镜检、生化鉴定、16S rRNA基因测序及分析等试验,表明此菌株为大肠埃希菌,药敏试验和毒力基因检测结果表明该菌具有较强的耐药性和毒力基因。
