载药微球经动脉化疗栓塞术与常规经动脉化疗栓塞术治疗中晚期肝癌效果及安全性的meta 分析
2021-10-30张光文
曹 博 张光文
1.新乡医学院第一临床学院,河南新乡 453000;2.新乡医学院第一附属医院感染疾病科,河南新乡 453000
肝细胞癌(hepatocellular carcinoma,HCC)是常见的消化系统恶性肿瘤,在全世界范围内,HCC 是第六大常见癌症,也是第三大癌症死因[1-2]。肝炎病毒感染是引发HCC 的主要因素,糖尿病、肥胖和代谢紊乱也与HCC 有关[3]。HCC 恶性程度高,进展迅速,大多数患者在最初诊断时已经处于中晚期,失去手术机会。经动脉化疗栓塞术(transarterial chemoembolization,TACE)是HCC 常用的非手术治疗方法,可以提高患者的整体生存率[4]。目前TACE 主要有两种,分别为常规经动脉化疗栓塞(conventional transarterial chemoembolization,cTACE)与载药微球经动脉化疗栓塞(drug-eluting beads transarterial chemoembolization,DEB-TACE)。DEB-TACE 基于载药微球的使用,在目标病变内缓慢释放细胞毒性药物,可以减少全身药物循环产生的相关毒性,研究[5-6]显示,DEB-TACE 能提高肿瘤缓解率、减少并发症,但是目前两种治疗方法的临床效果还存在争论。本研究将评估DEB-TACE 和cTACE治疗中晚期肝癌的有效性及安全性,为临床决策提供支持。
1 资料与方法
1.1 检索策略
检索PubMed、EMbase、Cochrane library 和中国知网、万方、维普数据库中有关cTACE 和DEB-TACE治疗中晚期肝癌的文献,检索时间为建库至2020 年6 月,文献语种为中英文,主题词与自由词结合。英文检索词:hepatocellular carcinoma、liver cancer、HCC、transarterial chemoembolization、TACE、drug-elutingbeads transcatheter arterial chemoembolization、DEB-TACE;中文检索词:肝癌、肝细胞癌、肝动脉化疗栓塞、载药微球、药物洗脱微球、微球栓塞。
1.2 纳入与排除标准
纳入标准:①研究类型为随机对照试验(randomized controlled trial,RCT);②经放射学、病理学确诊的中晚期肝癌患者,失去手术机会或不愿手术;③根据是否采用DEB-TACE 治疗分为对照组和观察组,其他治疗一致;④研究结果包含疾病控制率、生存率、不良反应率指标之一。
排除标准:①综述、荟萃分析、病例报告、会议摘要、动物研究;②不满足结局观察指标;③重复发表或数据雷同的文献。
1.3 资料提取与文献质量评估
由2 名研究者独立检索数据库,提取文献资料,如有争议则与第三方协商解决。提取的信息包括:文献作者及发表时间、样本量、Child-Pugh 分级、干预措施、结局指标、质量评价情况等。使用Cochrane 偏倚风险图评估文献质量。
1.4 统计学方法
meta 分析的指标为治疗后的疾病控制率、1 年生存率、2 年生存率及不良反应发生率。依据改良实体瘤疗效评价标准[7]分析疾病控制率(disease control rate,DCR),包括治疗后的完全缓解率、部分缓解率、疾病稳定率之和。
Stata 15.1(Stata Corporation,USA)软件分析,计数资料选用OR 值表示并给出95%CI,采用I2和χ2评价异质性,以P <0.05 时认为差异有统计学意义。当I2<50%,认为文献异质性小,应用固定效应模型分析;当I2≥50%,认为文献异质性大,应用随机效应模型分析。应用森林图评估治疗效果,采用漏斗图评估偏倚风险。
2 结果
2.1 文献检索及筛选结果
共检出文献1395 篇,最终纳入13 项[8-20]RCT 研究,文献筛选流程见图1。
图1 文献筛选流程
2.2 纳入文献特征及文献质量评价
13 项[8-20]RCT 研究共纳入1478 例患者,其中DEB-TACE 组727 例,cTACE 组751 例,见表1。对纳入的研究应用Cochrane 偏倚风险评估工具进行文献质量评价,结果显示文献整体质量较高,见图2。

图2 偏倚风险评估图
2.3 meta 分析结果
2.3.1 两组治疗后DCR 比较 6 项[8,10,12,14-15,20]研究比较DCR,其中I2=0.0%,P=0.510,提示文献无明显异质性,采用固定效应模型分析。结果显示DEB-TACE 组治疗后DCR 高于cTACE 组,差异有统计学意义(OR=2.18,95%CI:1.49~3.19,P <0.001)。见图3。
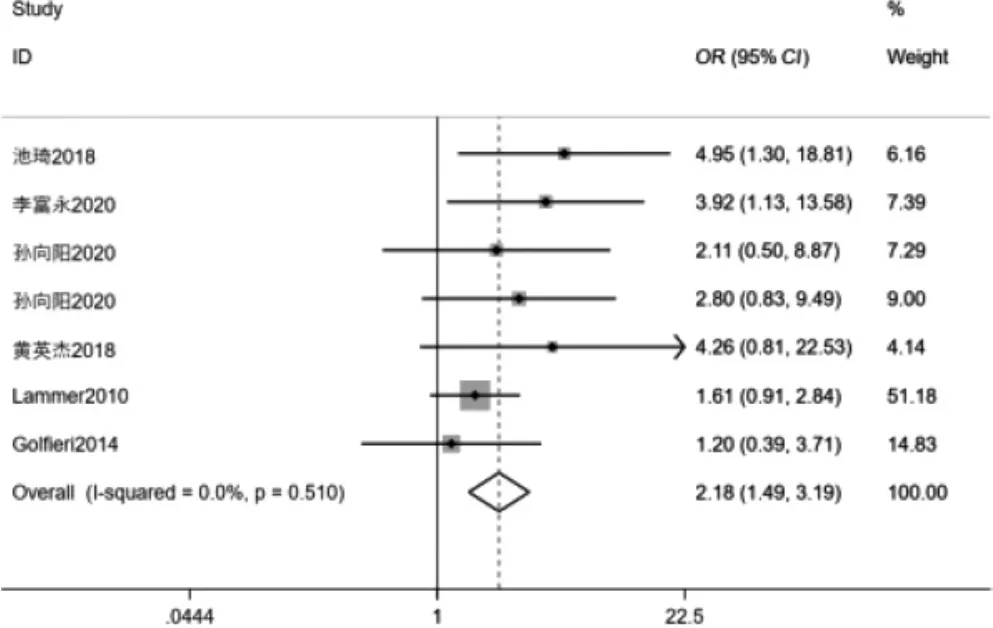
图3 两组治疗后疾病控制率比较森林图
2.3.2 两组1 年生存率比较 6 项[10,12-13,15,18-19]研究比较1 年生存率,其中I2=0.0%,P=0.889,提示文献无明显异质性,采用固定效应模型分析。结果显示DEBTACE 组1 年生存率高于cTACE 组,差异有统计学意义(OR=1.91,95%CI:1.32~2.75,P=0.001)。见图4。
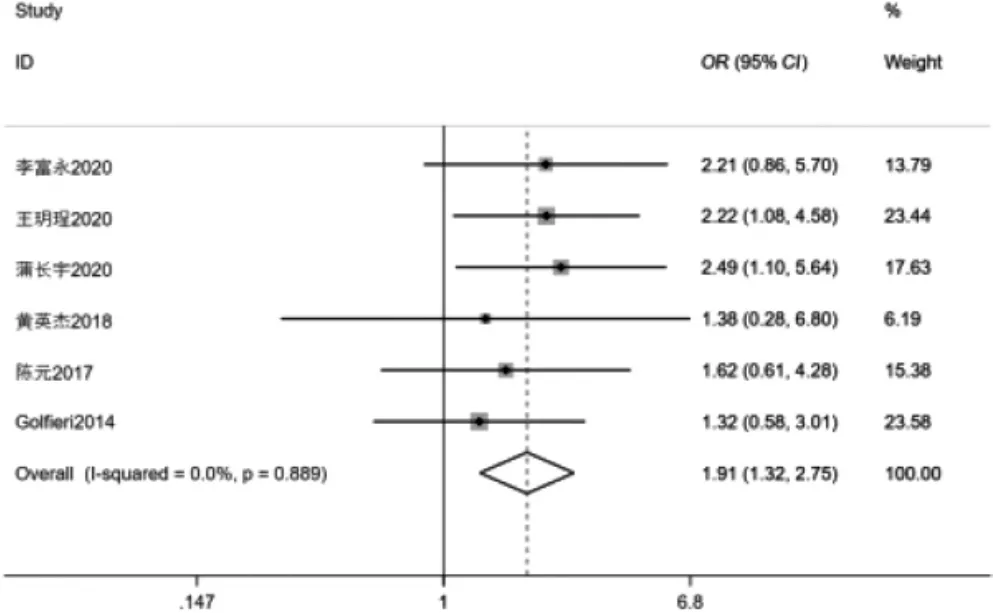
图4 两组1 年生存率比较森林图
2.3.3 两组2 年生存率比较 5 项[9-11,16,18]研究比较2 年生存率,其中I2=19.1%,P=0.293,提示文献无明显异质性,采用固定效应模型分析。结果显示DEBTACE 组2 年生存率高于cTACE 组,差异有统计学意义(OR=1.70,95%CI:1.16~2.50,P=0.006)。见图5。
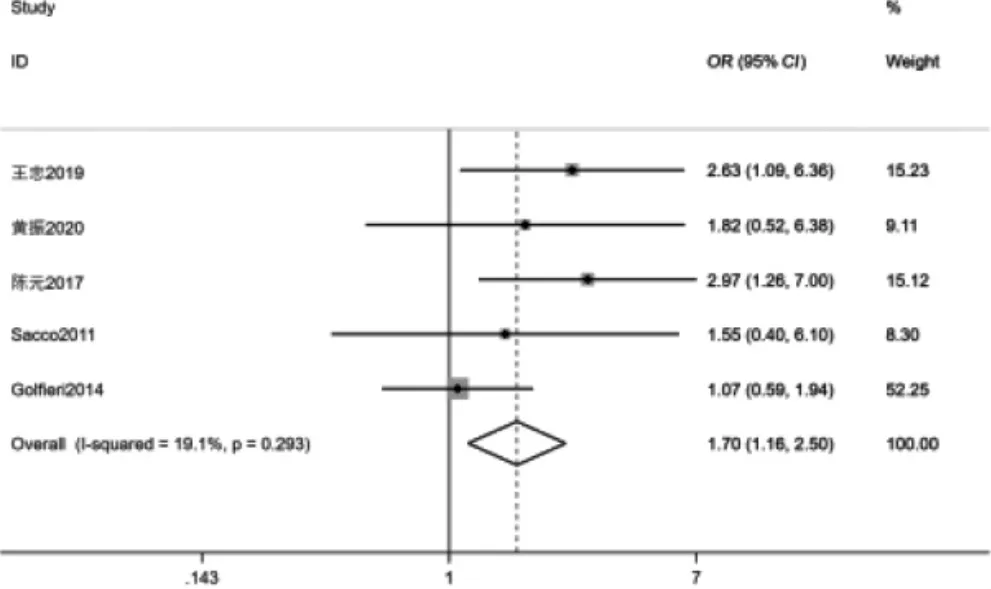
图5 两组2 年生存率比较森林图
2.3.4 两组不良反应发生率比较 7 项[8-9,11,13-14,17-18]研究比较不良反应发生率,其中I2=47.4%,P=0.077,提示文献无明显异质性,采用固定效应模型分析。结果显示两组不良反应率比较,差异无统计学意义(OR=0.74,95%CI:0.53~1.02,P=0.068)。见图6。

图6 两组不良反应发生率比较森林图
2.4 偏倚风险评估
使用漏斗图评估偏倚风险,选取DCR 数据进行评估,结果显示图像左右两侧基本对称,提示各文献无显著的发表偏倚(P >0.05)。见图7。
图7 发表偏倚漏斗图
3 讨论
目前DEB-TACE 与cTACE 两种方法治疗中晚期肝癌的效果及安全性仍存在争议,Yang 等[21]meta分析结果显示,接受DEB-TACE 治疗的患者DCR、无进展生存期与cTACE 治疗的患者比较,差异无统计学意义(P >0.05),但DEB-TACE 治疗的患者明显降低了乏力、感染、发热等不良事件的发生率。Han 等[22]的研究结果显示经DEB-TACE 治疗的患者有更高的DCR 和3 年生存率,DEB-TACE 比cTACE 有更好的生存获益,而两者之间的安全性比较,差异无统计学意义(P >0.05)。本研究共纳入13 项[8-20]RCT 研究,比较两种方法治疗中晚期肝癌的效果及安全性,结果显示DEB-TACE 治疗中晚期肝癌的效果优于cTACE,安全性不劣于cTACE。
栓塞后综合征(postembolization syndrome,PES)是DEB-TACE 最常见的不良反应,包括转氨酶异常、发热、消化道症状等[23],与术后组织缺血缺氧及坏死物质吸收有关。Huppert 等[24]指出PES 的程度和持续时间取决于TACE 影响的范围以及应用栓塞材料的数量。目前已经应用直径40 μm 的微球进行DEBTACE,可以进入更小的肿瘤供血血管,促进靶组织的坏死,减少副作用[25]。研究显示,采用40 μm 载药微球行DEB-TACE 的严重不良事件发生率为10.64%,其中PES 发生率为8.51%,使用较小尺寸的微球可以降低并发症的发生率[26]。DEB-TACE 和cTACE 诱发的局部组织缺血缺氧作用可引起促血管生长因子高表达,其对肿瘤复发和生长具有潜在影响,Schicho 等[27]研究显示DEB-TACE 造成血浆血管内皮生长因子(vascular endothelial growth factor,VEGF)水平上升的程度小于cTACE,可能因为cTACE 使用的碘油无法完全栓塞血管,会引起缺血再灌注,导致VEGF 高表达,而DEB-TACE 能完全栓塞血管,不会促进缺血组织的再灌注。
本研究分析了两种治疗方式的肿瘤控制率、生存率及不良反应发生率,但各项研究评估肿瘤反应及随访终点的时间不一致,可能造成分析结果差异。考虑多数研究随访时间过短,未提供足够的远期生存率结果,未能分析两种治疗方式的远期生存率差异。本研究中DEB-TACE 组载药微球直径大小不等,装载药物不一致,cTACE 组在药物使用上也存在差异,可能存在未知的混杂因素。本研究结果显示DEB-TACE 的治疗效果优于cTACE,治疗安全性不劣于cTACE。未来需要纳入更高质量的研究,对两种治疗方法的效果及安全性进行进一步评估。
