细胞损伤微环境多核巨细胞的形成与分裂观察
2021-10-30叶冬梅袁小林
王 佳 叶冬梅 袁小林
大连大学附属中山医院中心实验室,辽宁大连 116001
多核巨细胞(multinucleated giant cells,MGC)是与肉芽肿相关的同型巨噬细胞合胞体[1],其种类繁多,如破骨细胞、朗汉斯巨细胞、异物巨细胞等。其中破骨细胞的研究最多,为MGC 融合机制提供了更深入研究[2-3]。MGC 的形成始于单核前体细胞,通过促融合细胞因子获得融合能力,扩展富含肌动蛋白的丝状投射,细胞相互迁移,并通过丝状突起或融合足发生黏附。在相应位置,融合剂使质膜靠近,去除中间膜实现细胞质共享形成MGC,但其作用及生理功能尚不清楚[4]。本课题组在研究中观察到巨噬细胞与其他细胞系体外共培养,当细胞受到损伤或发生坏死时或有巨大细胞及典型MGC 出现。本研究对细胞损伤微环境中MGC 的形成进行动态观察,为MGC 的形成机制及其功能的研究提供实验资料。
1 材料与方法
1.1 实验材料
小鼠RAW 264.7 巨噬细胞购自中科院;HL-1 小鼠心房肌细胞购自武汉菲恩生物科技有限公司。
1.2 试剂与仪器
RPMI-1640 培养基(天津灏洋华科生物科技有限公司,HY1640);DMEM/HIGH GLUCOSE 培养基(沃卡威生物技术有限公司,SH30022.01);优级胎牛血清(天津灏洋华科生物科技有限公司,11011-8611);青链霉素混合液(Hyclone,S110JV);0.25%乙二胺四乙酸(ethylene diaminetetraacetic acid,EDTA)胰蛋白酶(Hyclone,KGY0012);Type 120c 普通光学显微镜(尼康仪器有限公司);Nikon-ECLIPSE-Ti 活细胞工作站(上海衡浩仪器有限公司);DiO 荧光染料(北京博奥森生物技术有限公司,D-9102);Hoechst 33342 荧光染料(北京博奥森生物技术有限公司,D-9105);Hitachi 扫描电镜(相确精密仪器有限公司);4%多聚甲醛(北京索莱宝科技有限公司,C2055)。
1.3 巨噬细胞和心肌细胞共培养方法
巨噬细胞和心肌细胞分别单独培养,待培养瓶中细胞密度达到80%以上,分别用0.25% EDTA 胰蛋白酶进行消化,离心力179×g,离心5 min,弃上清,完全培养基清洗两次,备用。收集巨噬细胞和心肌细胞,按照1∶3 比例混合,调整细胞浓度为1×106/ml 接种于普通培养皿内,37℃、5%CO2条件下共培养,分别于停止换液的第9~15 天拍照,观察MGC 形成现象。对照采用单独培养心肌细胞至第9 天进行拍照。
1.4 MGC 形成的动态观察
共培养方法同上,接种于普通和共聚焦培养皿内,前者设置实验组(不换液不传代)和对照组(定期换液),37℃、5%CO2条件下共培养,使用普通光学显微镜于第0~15 天拍照,计数第6、9、12 天实验组多核巨细胞的数量;同条件再设置实验组和对照组,放到活细胞工作站中,动态观察MGC 形成及分裂的全过程。
1.5 MGC 形成过程中巨噬细胞与心肌细胞的相互作用
收集巨噬细胞和心肌细胞,用培养基重悬,分别加入DiO 荧光染料(1 mmol/ml)、Hoechst33342 荧光染料(1 μg/ml)混匀。37℃避光孵育20 min,离心力179×g,离心5 min,去上清,重复洗涤2 次,按照1∶3比例共培养,调整细胞浓度为1×106/ml 接种于共聚焦培养皿内,不换液不传代,置于活细胞工作站中,绿、蓝二色荧光通道定时摄片,动态观察MGC 形成。
1.6 扫描电镜观察MGC 形成
将巨噬细胞和心肌细胞按照1∶3 比例接种到内置玻片的培养皿中,37℃,5%CO2条件下等待细胞爬片,待出现MGC 后,取出培养皿,用1×PBS 漂洗3 次,然后用4%多聚甲醛固定30 min,再进行乙醇梯度脱水,通风干燥。使用扫描电镜观察,拍摄MGC 及其超微结构。
1.7 统计学方法
采用SPSS 20.0 统计学软件对所得数据进行分析,计量资料采用均数±标准差()表示,重复测量数据采用重复测量方差分析。以P <0.05 为差异有统计学意义。
2 结果
2.1 细胞损伤微环境MGC 形成现象
细胞停止换液传代,会出现一些体积巨大的细胞,而且细胞的数量随着停止换液时间的延长而增多。停止换液初期与后期出现巨大细胞的形态有明显差异,初期形态规则,多呈圆形或椭圆形,而后期形态不规则、伪足多。这些巨细胞在共培养体系中出现,而单纯培养的正常心肌细胞不出现。见图1。
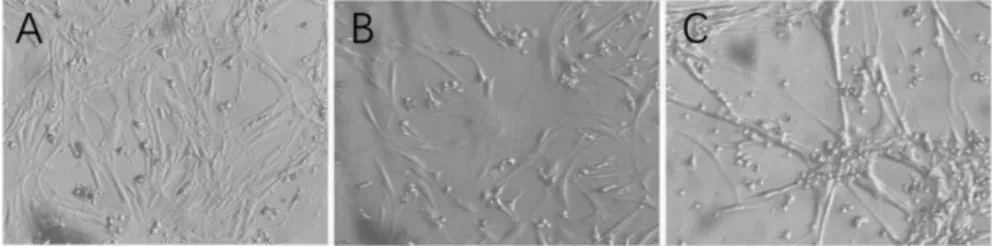
图1 心肌细胞、巨噬细胞和心肌细胞共培养(100×)
2.2 细胞损伤微环境与MGC 形成的动态观察
根据每天观察MGC 是否形成,设置如下图2 时间点,观察MGC 形成动态过程。结果显示,在光学显微镜下观察到MGC 形成动态过程。第6 天,实验组的心肌细胞开始出现损伤和坏死,巨噬细胞吞噬或融合受损心肌细胞形成巨大细胞,巨大细胞多为多个细胞形成的合胞体,合胞体内的多个细胞核大小均一、形态规则。第12 天出现的巨细胞,形态不规则呈多形性,有多伪足,吞噬能力较强。MGC 数量随损伤因素作用的时间延长而增加(P <0.05)。对照组定期换液,使得心肌细胞没有受损,没有MGC 形成。见图2~3。

图2 光学显微镜观察多核巨细胞形成的动态过程(200×)

图3 实验组多核巨细胞数量与损伤因素作用时间的关系
活细胞工作站观察到MGC 形成分裂的全过程。第6~9 天巨噬细胞与受损心肌细胞开始融合形成MGC,内含多个核的合胞体,其形成的合胞体可进一步分裂增殖,并且分裂的子细胞具有较强的运动功能,见图4。

图4 活细胞工作站观察多核巨细胞形成分裂全过程(200×)
2.3 染色(未染色)细胞融合形成MGC
为进一步证实巨细胞类型,采用活细胞工作站和扫描电镜,结果显示染色细胞融合形成MGC,第6~9 天开始出现巨大细胞多为巨噬细胞与受损心肌细胞融合而成,而后期出现的巨细胞为巨噬细胞吞噬破碎的心肌细胞。见图5(封三)。未染色细胞融合形成MGC,多个细胞膜融合,内含多个核,见图6。
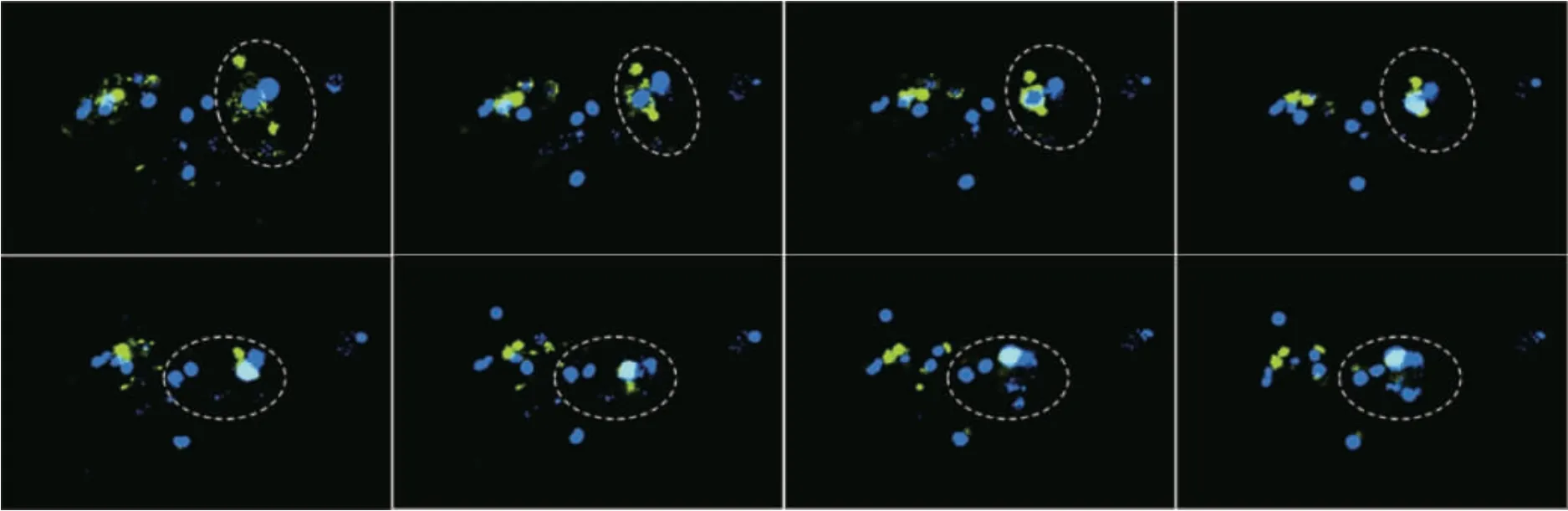
图5 活细胞工作站观察染色细胞融合形成多核巨细胞(200×)
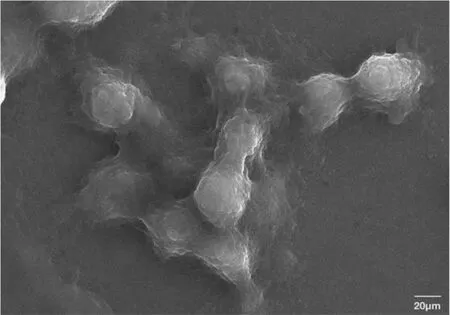
图6 扫描电镜观察未染色细胞融合形成多核巨细胞(2500×)
3 讨论
停止换液后,细胞培养微环境中糖、营养成分耗竭,代谢产物增多,使心肌细胞发生损伤甚至坏死;而巨噬细胞能量代谢有特殊性,对酸性环境及糖、营养缺乏有较强的耐受能力,以糖的无氧酵解为主要能量,所以停止换液后共培养中的巨噬细胞不会受到损伤[5-8]。坏死细胞可被巨噬细胞吞噬,部分受损伤的细胞可与巨噬细胞融合形成MGC。本研究结果显示,巨噬细胞与心肌细胞共培养停止换液6 d 后开始出现MGC[9],且MGC 的数量随停止换液时间的延长而增多,当大量死亡破碎心肌细胞出现后,巨噬细胞吞噬坏死心肌细胞形成吞噬型巨大细胞。而常规换液传代的共培养体系内无MGC 及吞噬型巨大细胞出现,提示细胞损伤后可导致MGC 形成。MGC 为巨噬细胞与巨噬细胞或与其他类型细胞融合而成,MGC 在体内多见,如破骨细胞、肿瘤组织、结核、皮肤,MGC 形成的机制及其生理功能尚不十分清楚[10]。从本研究结果看,当心肌细胞受到损伤的初期易于与巨噬细胞融合形成合胞体,合胞体分裂的子细胞会有巨噬细胞线粒体及其他成分,使损伤的组织细胞得到一定程度的修复[11]。
心肌梗死发病率与死亡率较高,尽管支架技术能够恢复血供,但坏死组织纤维化,影响心肌功能,并为进一步发展留下隐患[12-13]。急性期后坏死组织若能被修复或再生将能够恢复组织器官功能,对于降低死亡率及延长生存期具有重要意义[14]。巨噬细胞分布于全身组织,其主要来源:一是血液中单核细胞进入组织并分化为巨噬细胞[15];二是来源于卵黄囊,细胞示踪实验结果证实卵黄囊中的巨噬细胞在胚胎发育的早期就迁移并停留在组织中,成为组织驻留巨噬细胞[16]。其在器官形成、发育及损伤组织的修复再生中起关键作用[17],而巨噬细胞与受损心肌细胞融合形成合胞体并分裂出具有双重特性的杂交细胞很可能是巨噬细胞促进损伤组织修复再生的机制之一。细胞损伤多由病理原因导致,巨噬细胞可诱发一系列反应,促进损伤组织修复再生以恢复功能[18-21]。而且细胞损伤微环境中巨噬细胞的数量、活化与极化状态直接影响修复方式和程度[18]。在肿瘤坏死区域大量巨噬细胞浸润,出现大量吞噬坏死细胞的巨噬细胞(可递呈肿瘤抗原诱发抗肿瘤特异免疫反应)和少量MGC[22],而肿瘤细胞与巨噬细胞融合的合胞体分裂后形成的杂交细胞比非融合癌细胞生成的肿瘤生长速度更快[23-24]。MGC 的存活期长,同时MGC 及其分裂后的杂交细胞对不良微环境耐受性极强,具有抗化疗药物、射线的能力[25-26]。
本研究结果提示,细胞损伤微环境中巨噬细胞可与受损心肌细胞融合形成MGC,而且合胞体可进一步分裂增殖,其融合作用可能有助于心肌梗死损伤组织修复再生,为研究治疗心肌梗死的方法提供科学依据。为进一步研究损伤微环境中异体MGC 形成的机制及其杂交子细胞生物学特性具有重要意义。
