PvEG261对普通菜豆镰孢菌枯萎病抗性和抗旱性的影响
2021-10-30薛仁风丰明黄宇宁MatthewBlairWalterMessier葛维德
薛仁风,丰明,黄宇宁,Matthew Blair,Walter Messier,葛维德
对普通菜豆镰孢菌枯萎病抗性和抗旱性的影响
薛仁风1,丰明1,黄宇宁1,Matthew Blair2,Walter Messier3*,葛维德1*
1辽宁省农业科学院作物研究所,中国沈阳 110161;2田纳西州立大学农业与环境科学系,美国田纳西州纳什维尔 37209;3进化基因组学公司,美国路易斯安那州拉斐特 80501
【目的】分析普通菜豆的序列及表达模式特征,并研究其抗枯萎病和抗旱功能,为普通菜豆镰孢菌枯萎病抗病和抗旱信号调控网络解析及分子育种奠定基础。【方法】对开放读码框(open reading frame,ORF)进行生物信息学分析,预测该基因编码蛋白质的理化性质、二级结构、信号肽序列,在NCBI中通过Blastp检索高同源性蛋白序列进行序列比对并构建系统发育进化树;利用qRT-PCR技术分析组织表达特异性及响应枯萎病原菌、干旱胁迫的表达模式;构建过表达载体,转化发根农杆菌K599菌株,诱导普通菜豆产生转基因不定根系,同时构建沉默载体,其体外转录产物接种普通菜豆,干扰的表达,通过接种镰孢菌枯萎病原菌和干旱处理,观察对照、过表达和基因沉默菜豆植株的表型,进行抗病性和抗旱性鉴定,并测定过氧化氢(H2O2)含量、丙二醛(MDA)含量、超氧化物歧化酶(SOD)和过氧化物酶(POD)活性等生理生化指标。【结果】的cDNA序列长471 bp,编码156个氨基酸组成的蛋白质。结构预测其含有10个strand结构,基因编码产物预测分子质量为38.89 kD,理论为5.21。属于Dirigent超家族成员,包含10个氨基酸的信号肽序列,属于外分泌蛋白。PvEG261与豇豆DIR22蛋白亲缘关系最近,达到91.61%。qRT-PCR结果显示,接种枯萎病原菌和干旱胁迫后,该基因的在菜豆根组织中表达量明显上升,而且该基因具有明显的组织表达特异性,在根中的表达量最高。接种病原菌和干旱胁迫后,与对照相比,过表达植株的抗病性和抗旱性水平明显提高,植株枯萎病发病程度及缺水造成的萎蔫程度均显著降低,根中H2O2含量、POD活性、SOD活性均显著高于对照植株,而MDA含量显著低于对照植株,而基因沉默植株发病程度及萎蔫程度均显著升高,根中H2O2含量、POD活性、SOD活性均显著低于对照植株,MDA含量则显著高于对照植株。【结论】响应枯萎病原菌侵染和干旱胁迫,并且正向调控普通菜豆镰孢菌枯萎病抗性和抗旱性水平。
普通菜豆;;镰孢菌枯萎病;干旱胁迫;响应机制
0 引言
【研究意义】普通菜豆(L.)产量约占全球食用豆类总产量的50%,仅次于大豆和花生,是世界上种植面积最大的食用豆类[1-3]。真菌性土传病害是造成普通菜豆严重减产的重要原因,其中以尖镰孢菌菜豆专化型(f.sp.,Fop)引起的普通菜豆镰孢菌枯萎病(Fusarium wilt)最为严重[4]。因此,发掘并利用普通菜豆优异抗病基因资源,能够为普通菜豆抗枯萎病新品种培育奠定基础,对于理解普通菜豆枯萎病的抗病分子机制,提升中国普通菜豆抗病育种水平有重要意义。【前人研究进展】Dirigent超家族基因是植物重要的抗病响应基因,植物寄主通过激活包括Dirigent基因在内的多种基因应对生物和非生物挑战,在增强不同农作物的抗逆性中发挥潜在作用[5]。Dirigent蛋白参与介导植物中单木酚植物酚的自由基偶联,从而产生木脂素和木质素[6-11],研究表明,木脂素和木质素均属于植物抵御害虫和微生物的重要化合物,参与寄主防御系统相关反应[12-15]。Dirigent基因在许多植物中都存在多个基因家族成员,包括地衣、蕨类、裸子植物和被子植物[5,16-17]。许多Dirigent基因可被不同类型的非生物和生物胁迫因素诱导,包括损伤[16]、干旱、低温、脱落酸(abscisic acid,ABA)[17]、H2O2、NaCl、聚乙二醇[18]、真菌侵染[19-20]和昆虫取食[5]等。BURLAT等[6]研究表明Dirigent蛋白被免疫定位在形成层和细胞壁区域。在挪威云杉树皮和形成层接种树皮甲虫共生真菌病原体几周后,接种部位周围的细胞被部分或完全木质化[21-22]。木质化能够增加寄主细胞壁强度,从而阻止真菌病原体的传播,该过程可能是通过诱导Dirigent基因活性引起的[5]。WANG等[23]研究表明,在油菜籽中Dirigent基因组成型表达条件下,寄主表现出对多种病原真菌抗性的显著增加。此外,旋蒴苣苔Dirigent基因可以响应多种非生物胁迫,包括干旱、CaCl2、ABA、H2O2和乙二醇双四乙酸(ethylene glycol tetraacetic acid,EGTA),并在非生物胁迫响应机制中发挥重要作用[17]。【本研究切入点】普通菜豆是世界上重要的食用豆类粮食作物,但生产中真菌性土传病害和干旱胁迫严重危害普通菜豆的产量和品质。Dirigent基因是响应植物生物和非生物胁迫的重要基因,然而,目前关于普通菜豆Dirigent基因的研究成果依然不多,其表达特征和生物学功能更是少有报道。【拟解决的关键问题】本研究通过分析的序列、组织特异性表达特征及其在枯萎病原菌侵染、干旱胁迫下的表达模式,并采用过量表达和基因沉默技术验证其生物学功能,明确其在枯萎病抗性和抗旱中的作用,为普通菜豆抗病与抗旱机制解析及分子育种奠定基础。
1 材料与方法
1.1 试验材料及处理
的cDNA序列由美国进化基因组学公司Walter Messier教授提供[24]。供试普通菜豆(L.)品种BRB130、普通菜豆镰孢菌枯萎病原菌FOP-DM01菌株(f.sp.isolate FOP-DM01)由辽宁省农业科学院保存,病原菌的接种参考XUE等[25]方法;植物过表达载体p35SGFPGUS+、基因沉默表达载体pG7R2V和pGHopR1均由美国田纳西州立大学农业与环境科学系Matthew Blair教授惠赠;发根农杆菌()K599菌株感受态细胞购自上海唯地生物技术有限公司,限制性内切酶、T4-DNA连接酶均购自NEB公司;体外转录试剂盒(RiboMAXTMLarge Scale RNA Production Systems Kit)购自Promega公司;RNA提取试剂盒、DNA聚合酶、反转录试剂盒、荧光定量PCR试剂盒购自天根生化科技(北京)有限公司;T载体克隆试剂盒购自宝生物工程(大连)有限公司;PCR引物均由生工生物工程(上海)股份有限公司合成(表1)。
1.2 PvEG261的序列分析
利用ProtParam(https://web.expasy.org/protparam/)在线分析编码蛋白质的理化性质,利用SignalP软件在线预测信号肽序列,利用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)在线预测蛋白质二级结构,利用Blastp在线分析软件(http://blast.ncbi.nlm.nih.gov/Blast.cgi)寻找的同源序列,并分析序列保守结构域。利用MEGA7.0(http://www.megasoftware.net/)构建同源进化树。
1.3 PvEG261的表达模式分析
在未经处理的野生型普通菜豆根、茎、叶、花、荚等不同器官中取样,检测的组织表达特异性;将10日龄普通菜豆幼苗接种FOP-DM01菌株后0、24、48、72、96和120 h于根部取样,以未接种病原菌的普通菜豆根组织作为对照;将10日龄的普通菜豆幼苗浸入含有16.1% PEG6000中处理0、0.5、1、3、6和12 h后于根部取样,以清水处理为对照,提取总RNA,反转录获得cDNA,用于检测的表达量。通过qTOWER 2.2实时定量PCR仪(Analytikjena,Germany)分析的相对表达量。试验数据采用2−ΔΔCT法分析,确定基因的相对表达量,每个取样点设3个重复。定量PCR引物EG261-F/R根据的cDNA序列设计,以普通菜豆的作为内参,设计引物ACT-F/R[26]。
1.4 PvEG261的过量表达与基因沉默载体的构建
通过设计引物OE-F/OE-R,在上游和下游分别引入Ⅰ和Ⅰ内切酶位点。用Ⅰ和Ⅰ双酶切的cDNA,然后与经过相同双酶切的p35SGFPGUS+载体连接,构建的过表达载体,命名为p35S-。
通过病毒诱导基因沉默(virus induced gene silencing,VIGS)技术构建的沉默体系,利用引物GS-F/GS-R扩增的ORF中412 bp片段,并在上游和下游引入HⅠ和Ⅰ酶切位点,将扩增片段导入pG7R2V载体,命名为pG7R2V-412。将pG7R2V质粒经过Ⅰ酶切、连接后,用作空载体对照,命名为pG7R2V-CK。
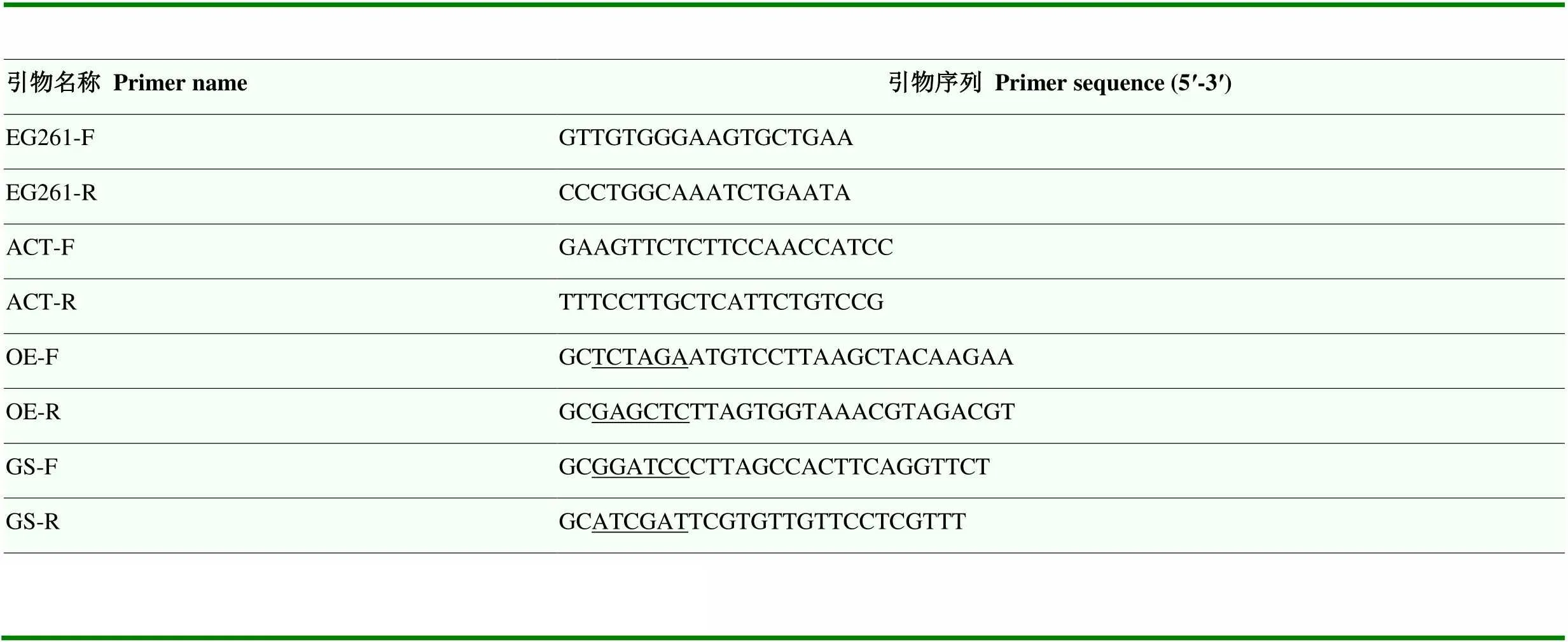
表1 本试验所用引物
下划线序列代表限制性内切酶位点
The underlined sequence represents the restriction endonuclease site
1.5 转基因不定根的遗传转化
参考ESTRADA-NAVARRETE等[27]方法进行转基因不定根的诱导。将p35S-载体转化发根农杆菌K599菌株感受态细胞,接种普通菜豆7日龄幼苗作为处理,以转化p35SGFPGUS+载体和无载体转化的K599菌株诱导产生不定根的菜豆植株作为对照。不定根的诱导在90%湿度条件下进行,当不定根长至3—4 cm时将植株移栽至新盆中,使其稳定生长,28℃光照16 h/25℃黑暗8 h条件下培养3周。
1.6 基因沉默表达植株的构建
参考Díaz-Camino等[28]方法构建基因沉默植株。将pG7R2V-412载体与pGHopR1载体的体外转录产物等量混合后接种普通菜豆植株首片三出复叶作为处理,以pG7R2V-CK载体与pGHopR1载体体外转录产物混合物接种的菜豆植株和野生型植株作为对照。培养条件为28℃光照16 h/25℃黑暗8 h。
1.7 抗病性、抗旱性鉴定
参考XUE等[25]和CHEN等[26]方法对过表达和沉默表达的菜豆植株进行抗病性和抗旱性鉴定,每个对照或处理调查株数均为9。普通菜豆植株均培养于28℃光照16 h/25℃黑暗8 h条件下温室,观察植株生长状态。
1.8 抗病和抗旱相关生理指标检测
测定过表达和基因沉默的菜豆植株根组织及相关生理生化指标。参考SAGISAKA[29]方法测定H2O2含量,参考ZHANG等[30]方法测定丙二醛(malondialdehyde,MDA)含量和超氧化物歧化酶(superoxide dismutase,SOD)活性,参考DO等[31]方法测定过氧化物酶(peroxidase,POD)活性。一个酶活性单位定义为每分钟将1 μmol底物转化为产物的酶量。
1.9 数据处理
采用SPSS 19.0和Excel 2007进行数据统计分析。
2 结果
2.1 普通菜豆PvEG261的序列分析
编码的蛋白质含有10个strand结构,其他为coil结构。PvEG261预测分子质量为38.89 kD,理论为5.21。PvEG261属于Dirigent超家族成员(图1-A)。蛋白质结构预测结果表明,该蛋白质包含10个氨基酸的信号肽序列,属于外分泌蛋白。PvEG261的氨基酸序列与豇豆(XP_027906892.1)、红小豆(XP_017441835.1)、绿豆(XP_014492698.1)等多种作物的Dirigent基因所编码的氨基酸序列具有很高的同源性。系统进化树分析结果表明,PvEG261与豇豆的DIR22蛋白亲缘关系最近,蛋白序列相似性达到91.61%(图1-B和图1-C)。
2.2 普通菜豆PvEG261的表达模式
采用qRT-PCR技术分析在普通菜豆各个组织中的相对表达量。结果表明,在普通菜豆各个组织中均有不同程度表达,其中在根中的表达丰度最高,茎中次之,在叶中表达丰度最低(图2-A)。接种普通菜豆镰孢菌枯萎病原菌FOP-DM01菌株后,在普通菜豆品种BRB130根中的表达水平显著高于接种前(图2-B),接种病原菌72 h后,基因表达量显著提升,在96和120 h达到最高,分别为接种前表达水平的4.5和3.8倍。当用PEG6000处理菜豆植株时,根中表达水平受到强烈诱导,表达量在处理6 h后达到最大值,约为处理0 h表达水平的6.2倍(图2-C)。
2.3 PvEG261过表达和基因沉默菜豆植株的获得
利用EG261-F/EG261-R引物组合对过表达和基因沉默菜豆植株进行qRT-PCR检测,结果表明,过表达菜豆植株不定根中目标基因的表达量显著高于空载体转化和非转化不定根(图3-A);沉默植株根中目标基因的表达量显著低于接种空载体病毒菜豆植株和野生型植株根组织(图3-B)。
2.4 PvEG261过表达和基因沉默菜豆植株抗病性和抗旱性鉴定
接种枯萎病病原菌2周后,过表达菜豆植株发病级数显著低于空载体转化和非转化不定根植株(图4-A)。接种病原菌2周后,2组对照植株发病级数分别达到8.6和8.8,而过表达不定根的菜豆植株发病级数仅为6.1(图4-B);接种病原菌后,沉默菜豆植株发病级数显著高于接种空载体病毒菜豆植株和野生型植株(图4-C)。接种病原菌2周后,2组对照植株发病级数仅为分别达到4.8和4.1,而沉默的菜豆植株发病级数高达8.9(图4-D)。以上结果表明,在调控普通菜豆枯萎病抗病反应中发挥重要作用。
通过2周的干旱处理,发现对照组植株叶片严重萎蔫失水下垂,而过表达不定根的菜豆植株生长状态明显要好于对照(图5-A),过表达不定根长度显著高于对照植株,达到19.6 cm(图5-B)。此外,干旱胁迫处理后,过表达菜豆植株的不定根系更加发达,根系鲜重达到5.7 g,比较非转化、空载体对照均显著提高(图5-C);而沉默植株经过2周干旱处理后,整株严重枯萎(图5-D),沉默植株根长度仅为12.7 cm,显著低于对照植株(图5-E),此外基因沉默植株根系鲜重也仅为2.7 g,也均明显低于野生型、空载体2组对照(图5-F)。以上结果表明,对普通菜豆植株的抗旱性起到正向调控作用。
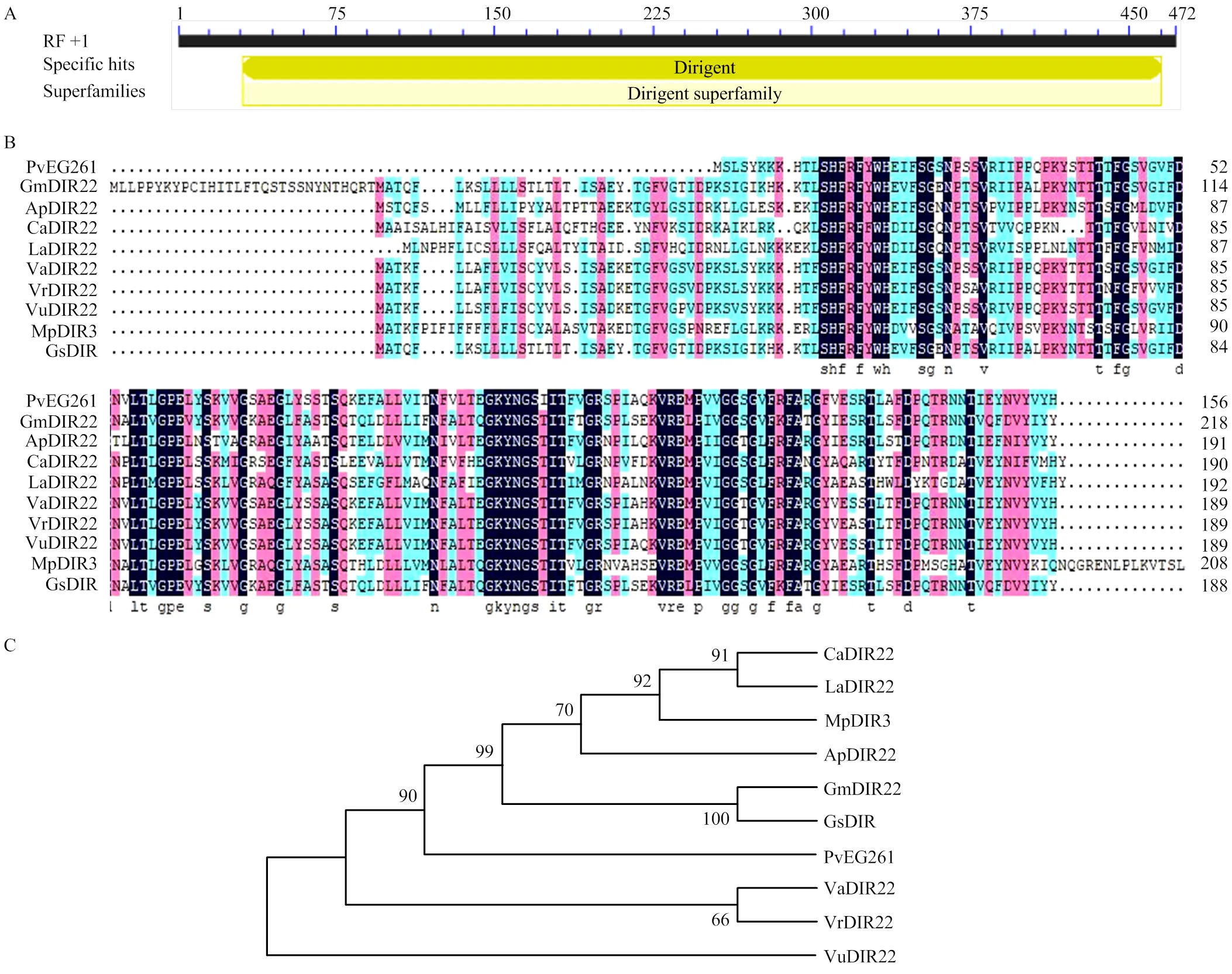
A:PvEG261蛋白序列分析;B:PvEG261蛋白和其他植物中的Dirigent蛋白序列比对。绿色代表相似性达50%以上;粉色代表相似性达75%以上;黑色代表相似性达100%;C:PvEG261蛋白和其他植物中的Dirigent蛋白的同源进化树分析。CaDIR22:咖啡,XP_027102329.1;LaDIR22:羽扇豆,XP_019462472.1;MpDIR3:刺毛黧豆,RDX73385.1;ApDIR22:相思子,XP_027337739.1;GmDIR22:大豆,XP_006576480.1;GsDIR:野生大豆,KHN26491.1;VaDIR22:红豆,XP_017441835.1;VrDIR22:绿豆,XP_014492698.1;VuDIR22:豇豆,XP_027906892.1
2.5 普通菜豆植株抗病和抗旱生理指标检测
在病原菌侵染和干旱胁迫条件下,过表达植株根组织H2O2含量、POD活性、SOD活性均显著高于对照植株(图6-A—图6-C),而MDA含量显著低于对照植株(图6-D)。基因沉默植株根组织H2O2含量、POD活性、SOD活性均显著低于对照植株(图6-E—图6-G),而MDA含量显著高于对照植株(图6-H)。以上结果表明,对普通菜豆枯萎病抗病性和抗旱性的提升具有促进作用。
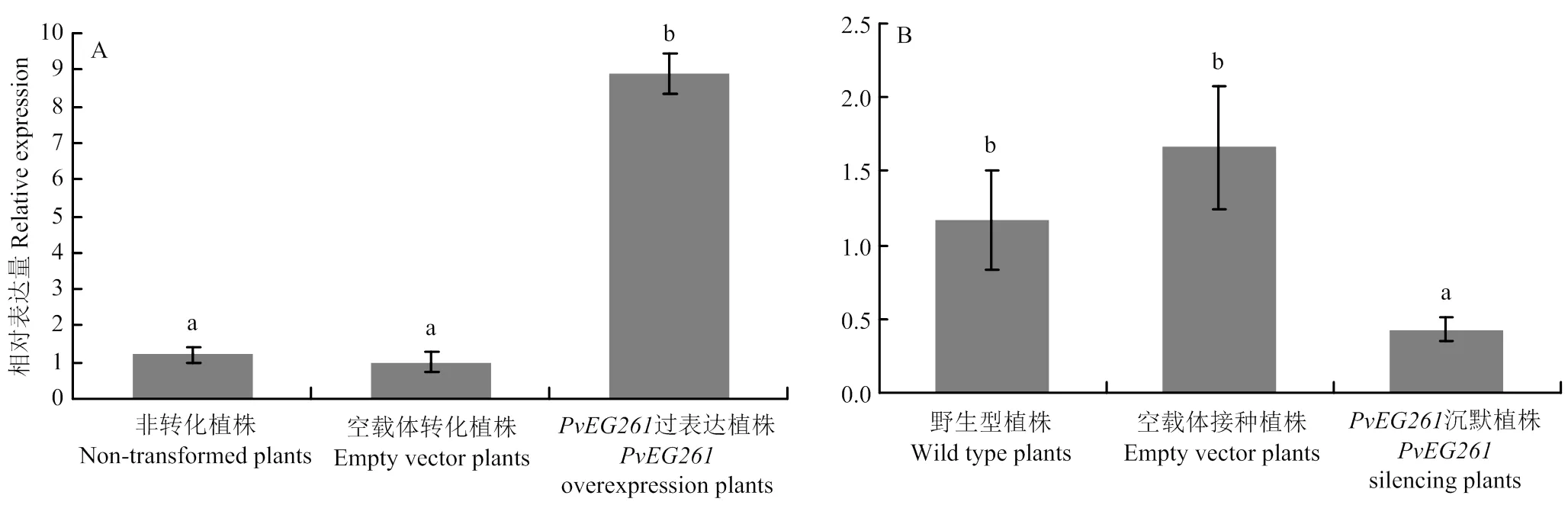
A:PvEG261过表达植株的qRT-PCR检测;B:PvEG261沉默植株的qRT-PCR检测
3 讨论
普通菜豆(L.)是世界范围内重要的食用豆类作物之一,而食用豆类,尤其在发展中国家是人类摄取蛋白质(约22%),维生素(叶酸)和矿物质(钙、铜、铁、镁、锰、锌)的重要来源[32]。在生产效率低下和种植经验匮乏的国家和地区,普通菜豆在生产中更容易受到病虫害及干旱、土地贫瘠等
生物或非生物胁迫的影响。
植物Dirigent蛋白首先在连翘中被分离并鉴定出来[33],其主要参与木脂素和木质素合成中的相关酶促反应,并且在水生植物逐渐适应陆生环境过程中逐渐进化[34]。木质素或木脂素类物质积累量的提高,都可以增强植物的抗性,许多研究表明Dirigent基因参与植物的防御系统,增强植物的抗逆性[35-36]。本研究中PvEG261蛋白序列具有其他植物Dirigent蛋白序列的保守结构域,而且通过构建系统进化树,发现PvEG261与豇豆、绿豆、小豆的Dirigent蛋白亲缘关系都很近,说明该基因应该编码普通菜豆Dirigent蛋白。PvEG261蛋白N端具有明显的信号肽序列,属于分泌蛋白,而且在根组织中该基因表达量最高,这些结果均与前人研究结果一致[37-39]。
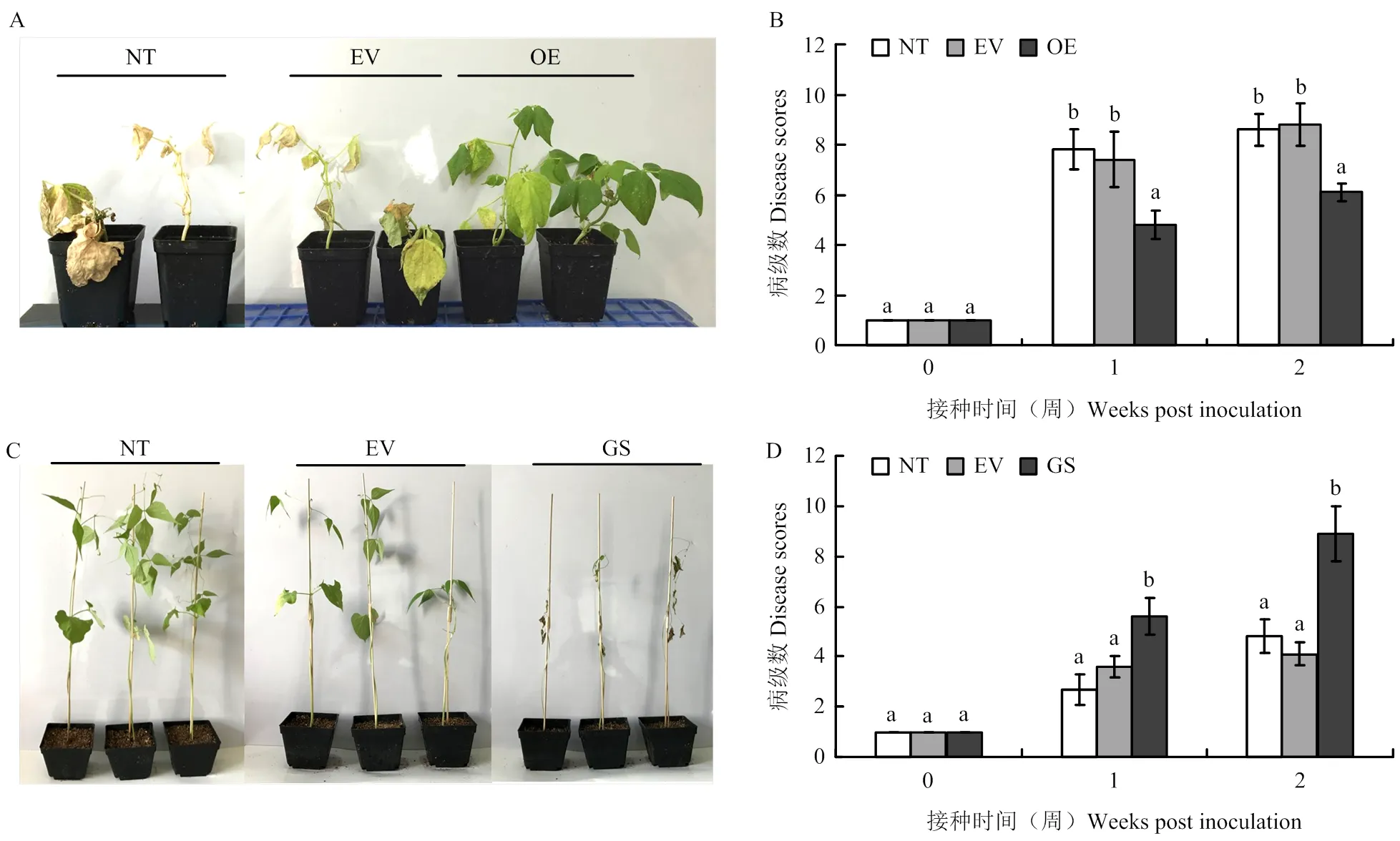
A:PvEG261过表达植株2周后病情特征;B:PvEG261过表达植株病级分析;C:PvEG261沉默植株2周后病情特征;D:PvEG261沉默植株病级分析。NT:非转化植株;EV:空载体转化植株;OE:PvEG261转基因不定根植株;GS:PvEG261沉默植株。下同
Dirigent蛋白是一类植物病原应答诱导蛋白,许多农作物受病原菌侵染时,Dirigent基因都被快速诱导表达,这些研究表明Dirigent蛋白基因在植物病害防御过程中具有非常重要作用[35-39]。前人研究表明,三七()中克隆到的7个DIR基因(—)都响应茄腐镰刀菌()的侵染,基因表达量均显著上调,并且过表达的转基因烟草木质素和木脂素生物合成相关基因的表达量显著升高,从而提高了木质素、木脂素的积累量并增强烟草对茄腐镰刀菌的抗性[37]。白菜()在尖孢镰刀菌()侵染后,表达量显著提升,接种24 h后,基因表达量比未侵染植株提升约5倍[40]。本研究发现普通菜豆受镰孢菌枯萎病原菌侵染后,根中的表达水平同样显著升高,过表达的转基因菜豆植株对枯萎病原菌的抗性明显增强,而的沉默植株对枯萎病原菌的抗性却显著降低,这说明该基因在普通菜豆防御系统中发挥着重要作用。
植物Dirigent基因在响应非生物胁迫方面同样发挥了重要作用。在PEG6000诱导条件下,菜豆根中表达水平也受到强烈诱导,表达量快速提升,这与甘蔗()经PEG处理后,的表达水平变化规律一致,同时在大肠杆菌()中过表达也可以显著提高大肠杆菌对PEG的耐受力[41]。因此,Dirigent基因作为植物木质素合成中的重要调控基因,在响应干旱胁迫方面发挥重要作用。本研究中,在干旱胁迫条件下,过表达的转基因植株不定根长度和鲜重显著高于对照,而基因沉默植株根长度和鲜重显著低于对照,这说明对调控普通菜豆的抗旱性具有重要作用。
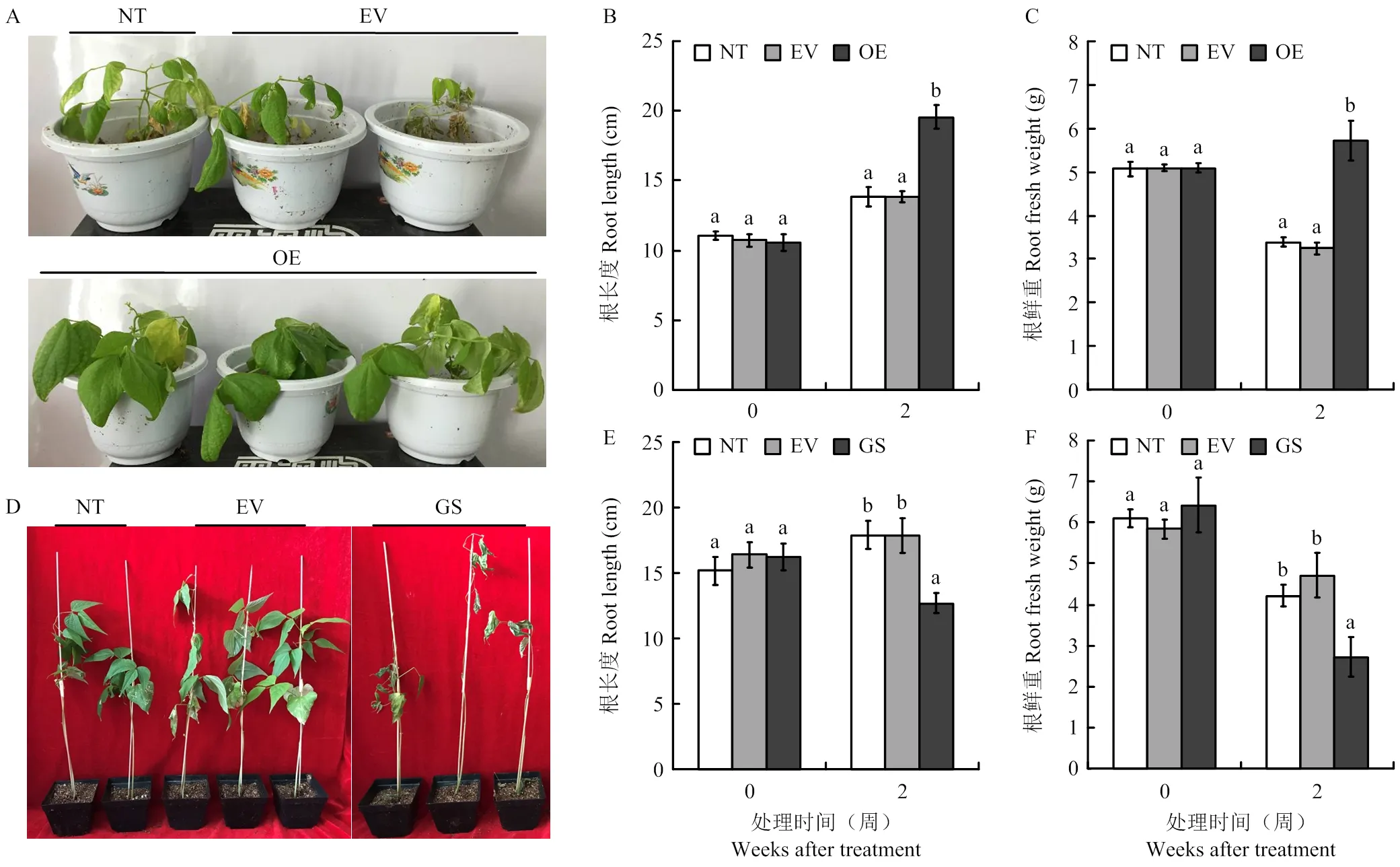
A:PvEG261过表达植株干旱胁迫2周后表型特征;B:PvEG261过表达植株根长度分析;C:PvEG261过表达植株根鲜重分析;D:PvEG261沉默植株干旱胁迫2周后表型特征;E:PvEG261沉默植株根长度分析;F:PvEG261沉默植株根鲜重分析
当植物遭受逆境胁迫时,H2O2等活性氧(reactive oxygen species,ROS)分子迅速积累,协助植物抵御病原菌的侵染,它不仅可以直接杀死病原菌,还参与细胞壁的木质化等过程,同时它还可以作为第二信使调控相关基因的表达,提高植物的抗逆性[42]。然而,大量积累的ROS也一定程度破坏了植物细胞内环境的稳态及各种代谢活动的正常进行,同时伴随ROS的积累,大量MDA的合成也给植物细胞造成了损伤[43]。因此,植物细胞通过增加相关抗氧化防护酶(POD和SOD等)活性来清除逆境胁迫下细胞内积累的大量的ROS,以降低ROS对细胞的破坏[44]。本研究中,在病原菌侵染和干旱胁迫条件下,过表达菜豆植株根组织H2O2含量、POD活性、SOD活性显著高于对照,MDA含量显著低于对照,而基因沉默植株根组织H2O2含量、POD活性、SOD活性显著低于对照,MDA含量显著高于对照。结果说明,能够诱导合成大量ROS,提高菜豆植株的抗病性和抗旱性,并通过调节POD和SOD等抗氧化酶活性,降低了ROS对细胞造成的破坏,降低MDA水平,减轻了病原菌侵染和干旱胁迫对菜豆植株造成的伤害。
Dirigent基因家族在植物应答多种生物与非生物胁迫的防御反应,次生代谢和纤维素的生物合成中都发挥着重要的作用[6,16,45]。然而,关于普通菜豆中Dirigent蛋白及其生物学功能,特别是对镰孢菌枯萎病抗性和抗旱性的影响仍然报道较少。本研究结果表明,普通菜豆的Dirigent基因在菜豆抗枯萎病和抗旱相关反应过程中发挥了重要的作用,伴随着逆境响应因子的表达,正向调控寄主枯萎病抗病性和抗旱性水平,但关于参与普通菜豆镰孢菌枯萎病抗性和抗旱性的分子机制今后还需要进一步深入研究。
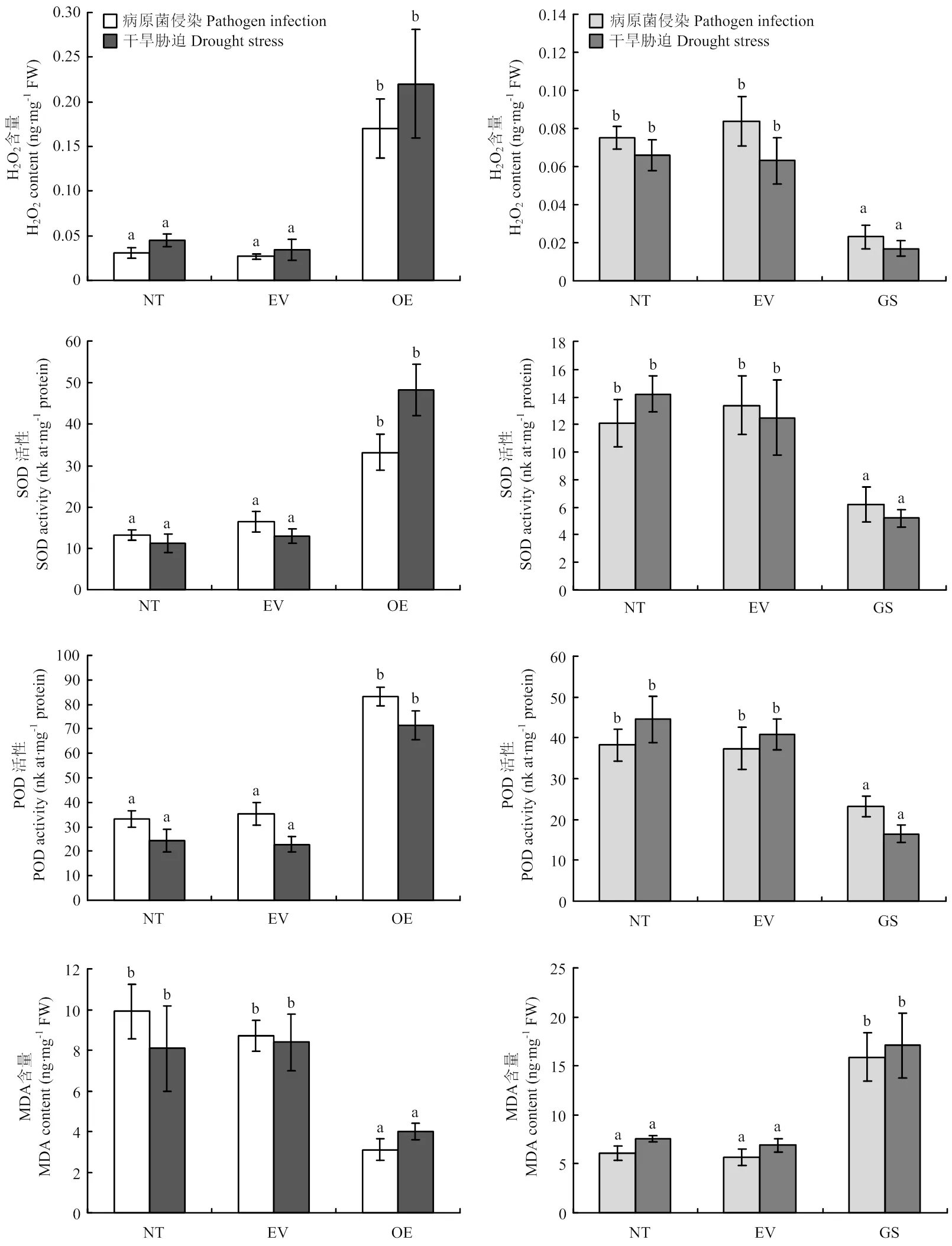
A:PvEG261过表达植株H2O2含量分析;B:PvEG261过表达植株SOD活性分析;C:PvEG261过表达植株POD活性分析;D:PvEG261过表达植株MDA含量分析;E:PvEG261沉默植株H2O2含量分析;F:PvEG261沉默植株SOD活性分析;G:PvEG261沉默植株POD活性分析;H:PvEG261沉默植株MDA含量分析
4 结论
属于典型的普通菜豆Dirigent基因家族成员,其编码蛋白属于外分泌蛋白,在根中表达量最高,具有明显的组织表达特异性;该基因响应枯萎病原菌、干旱的诱导,表达量显著提升,并且正向调控普通菜豆镰孢菌枯萎病抗性和抗旱性水平。
[1] 张赤红, 曹永生, 宗绪晓, 王志刚, 王述民.普通菜豆种质资源形态多样性鉴定与分类研究.中国农业科学, 2005, 38(1): 27-32.
ZHANG C H, CAO Y S, ZONG X X, WANG Z G, WANG S M.Morphological diversity and classification of common bean (L.) germplasm resource in China.Scientia Agricultura Sinica, 2005, 38(1): 27-32.(in Chinese)
[2] Perez-VegaE, PaedaA, RodrIguez-SuArezC, CampaA, GiraldezR, FerreiraJ J.Mapping of QTLs for morpho- agronomic and seed quality traits in a RIL population of common bean (L.).Theoretical and Applied Genetics, 2010, 120: 1367-1380.
[3] Schmutz J, McClean P E, Mamidi S, Wu G A, Cannon S B, Grimwood J, Jenkins J, Shu S q, Song Q j, Chavarro C, Torres-TorresM, Geffroyv, Moghaddam S M, Gaod y, Abernathyb, Barryk, Blair m, Brick m a, Chovatiam, Gepts p, GoodsteinD M, Gonzalesm, Hellstenu, Hyten D L, Jiag F, Kelly J D, Kudrna D, LeeR, Richard M M S, Miklas P N, OsornoJ M, Rodrigues J, ThareauV, UrreaC A, Wang m, Yu Y, ZhangM, Wing R A, Cregan P B, Rokhsar D S, JacksonS A.A reference genome for common bean and genome-wide analysis of dual domestications.Nature Genetics, 2014, 46: 707-713.
[4] HARTER L L.A Fusarium disease of beans.(Abstr.).Phytopathology, 1929, 19: 82.
[5] Ralph S, Park J Y, Bohlmann J, Mansfield S D.Dirigent proteins in conifer defense: gene discovery, phylogeny and differential wound- and insect-induced expression of a family of DIR and DIR-like genes in spruce (spp.), Plant Molecular Biology, 2006, 60: 21-40.
[6] Burlat V, Kwon M, Devin L B, Lewis N G.Dirigent proteins and dirigent sites in lignifying tissues.Phytochemistry, 2001, 57: 883-897.
[7] Davin L B, Wang H B, Crowell A L, Bedgar D L, Martin D M, Sarkanen S, Lewis N G.Stereoselective biomolecular phenoxy radical coupling by an auxiliary (Dirigent) protein without an active center.Science, 1997, 275: 362-366.
[8] Liu J, Stipanovic R D, Bell A A, Puckhaber L S, Magill C W.Stereoselective coupling of hemigossypol to form (+)-gossypol in moco cotton is mediated by a dirigent protein.Phytochemistry, 2008, 69: 3038-3042.
[9] Pickel B, Constantin M A, Pfannstiel J, Conrad J, Beifuss U, Schaller A.An enantiocomplementary dirigent protein for the enantioselective laccase-catalyzed oxidative coupling of phenols.Angewandte Chemie-International Edition, 2010, 49: 202-204.
[10] Dalisay D S, Kim K W, Lee C, Yang H, Rübel O, Bowen B P, DavinL B, LewisN G.Dirigent protein-mediated lignan and cyanogenic glucoside formation in flax seed: integrated omics and MALDI mass spectrometry imaging.Journal of Natural Products, 2015, 78: 1231-1242.
[11] Effenberger I, Zhang B, Li L, Wang Q, Liu Y, Klaiber I, Pfannstiel J, Wang Q M, Schaller A.Dirigent proteins from cotton (sp.) for the atropselective synthesis of gossypol.Angewandte Chemie-International Edition, 2015, 54: 14660-14663.
[12] Lewis N G, Davin L B.Evolution of lignin and neolignan biochemical pathways//Nes W D, (Ed.).Isopentenoids and other natural products evolution, function.Washington DC: ACS Symposium Series, 1994, 562: 202-246.
[13] Lewis N G, Davin L B.Lignans: biosynthesis and function// Barton D H R, Nakanishi K, Meth-Cohn O, (Eds.).Comprehensive Natural Products Chemistry.London: Elsevier, 1999: 639-712.
[14] Boudet A M.Lignins and lignification selected issues.Plant Physiology and Biochemistry, 2000, 38: 81-96.
[15] Zhou J, Lee C, Zhong R, Ye Z H.MYB58 and MYB63 are transcriptional activators of the lignin biosynthetic pathway during secondary cell wall formation in.The Plant Cell, 2009, 21: 248-266.
[16] Ralph S G, Jancsik S, Bohlmann J.Dirigent proteins in conifer defense II: extended gene discovery, phylogeny, and constitutive and stress-induced gene expression in spruce (spp).Phytochemistry, 2007, 68: 1975-1991.
[17] Wu R H, Wang L L, Wang Z, Shang H H, Liu X, Zhu Y, Qi D D, DENG X.Cloning and expression analysis of a dirigent protein gene from the resurrection plant.Progress in Natural Science, 2009, 19: 347-352.
[18] Moura J C M S, Bonine C, Viana J, Dornelas M C, Mazzafera P.Abiotic and biotic stresses and changes in the lignin content and composition in plants.Journal of Integrative Plant Biology, 2010, 52: 360-376.
[19] Zhu L, Zhang X, Tu L, Zeng F, Nie Y, Guo X.Isolation and characterization of two novel dirigent-like genes highly induced in cotton (and) after infection by.Journal of Plant Pathology, 2007, 89: 41-45.
[20] Reboledo G, Del Campo R, Alvarez A, Montesano M, Mara H, Ponce de León I.Physcomitrella patens activates defense responses against the pathogen.International Journal of Molecular Sciences, 2015, 16: 22280-22298.
[21] Franceschi V R, Krokene P, Krekling T, Christiansen E.Phloem parenchyma cells are involved in local and distant defense responses to fungal inoculation or barkbeetle attack in Norway spruce ().American Journal of Botany, 2000, 87: 314-326.
[22] Nagy N E, Franceschi V R, Solheim H, Krekling T, Christiansen E.Wound-induced traumatic resin duct development in stems of Norway spruce (): anatomy and cytochemical traits.American Journal of Botany, 2000, 87: 302-313.
[23] Wang Y, Fristensky B.Transgenic canola lines expressing pea defense gene DRR206 have resistance to aggressive blackleg isolates and to.Molecular Breeding, 2001, 8: 263-271.
[24] Messier W.Dirigent geneand its orthologs and paralogs and their uses for pathogen resistance in plants, US, US 9834783B2, 2017.
[25] XUE R F, WU X B, WANG Y J, ZHUANG Y, CHEN J, WU J, GE W D, WANG L F, WANG S M, BLAIR M WHairy root transgene expression analysis of a secretory peroxidase()from common bean infected by Fusarium wilt.Plant Science, 2017, 260: 1-7.
[26] Chen J B, Wang S M, Jing R L, Mao x g.Cloning thegene from common bean () and its expression patterns under abiotic stresses.Journal of Plant Physiology, 2009, 166(1): 12-19.
[27] Estrada-Navarrete G, Alvarado-Affantranger X, Olivares J E, Guillén G, Díaz-Camino C, Campos F, Quinto C, Gresshoff P M, Sanchez F.Fast, efficient and reproducible genetic transformation ofspp.by.Nature Protocols, 2007, 2(7): 1819-1824.
[28] Díaz-Camino C, Annamalai P, Sanchez F, Kachroo A, Ghabrial S A.An effective virus-based gene silencing method for functional genomics studies in common bean.Plant Methods, 2011, 7(1): 16.
[29] Sagisaka S.The occurrence of peroxide in a perennial plant,.Plant Physiology, 1976, 57: 308-309.
[30] Zhang H, Gao X, Zhi Y, Li X, Zhang Q, Niu J, Wang J, Zhai H, Zhao N, Li J, Liu Q, He S.A non-tandem CCCH-type zinc finger protein, IbC3H18, functions as a nuclear transcriptional activator and enhances abiotic stress tolerance in sweet potato.New Phytologist, 2019, 223: 1918-1936.
[31] Do H M, Hong J K, Jung H W, Kim S H, Ham J H, Hwang B K.Expression of peroxidaselike genes, H2O2production, and peroxidase activity during the hypersensitive response topv.in.Molecular Plant Microbe Interaction, 2003, 16: 196-205.
[32] Broughton W J, Hernandez G, Blair M, Beebe S, Gepts P, Vanderleyden J.Bean (spp.)-model food legumes.Plant Soil, 2003, 252: 55-128.
[33] Davin L B, Wang H B, Crowell A L, Bedgar D L, Martin D M, Sarkanen S, Lewis N G.Stereoselective bimolecular phenoxy radical coupling by an auxiliary (dirigent) protein without an active center.Science, 1997, 275: 362-366.
[34] Kim M K, Jeon J H, Fujita M, Davin L B, Lewis N G.The western red cedar () 8-8’ DIRIGENT family displays diverse expression patterns and conserved monolignol coupling specificity.Plant Molecular Biology, 2002, 49: 199-214.
[35] Li N, Zhao M, Liu T, Dong L, Cheng Q, Wu J, Wang L, Chen X, Zhang C, Lu W, Xu P, Zhang S.A novel soybean dirigent genecontributes to promotion of lignan biosynthesis and enhances resistance to.Frontier in Plant Science, 2017, 8: 1185.
[36] Ma Q H, Liu Y C.TaDIR13, a dirigent protein from wheat, promotes lignan biosynthesis and enhances pathogen resistance.Plant Molecular Biology Reporter, 2015, 33(1): 143-152.
[37] 关瑞攀.Dirigent基因参与三七——茄腐镰刀菌互作的分子机理研究[D].昆明: 昆明理工大学, 2018.
GUAN R P.Molecular mechanism of dirigent genes involved in the interaction of[D].Kunming: Kunming University of Science and Technology, 2018.(in Chinese)
[38] 张洪伟, 李继刚, 郑建坡, 曲占良.马铃薯晚疫病抗性相关基因的克隆与表达.华北农学报, 2012(2): 23-29.
ZHANG H W, LI J G, ZHENG J P, QU Z L.Cloning and expression of a potato dirigent-like gene () responsive to infection by.Acta Agriculturae Boreali-Sinica, 2012(2): 23-29.(in Chinese)
[39] 郭宝生, 师恭曜, 王凯辉, 刘素恩,赵存鹏, 王兆晓, 耿军义, 华金平.黄萎病菌侵染下陆地棉Dirigent-like蛋白基因表达差异分析.中国农业科学, 2014, 47(22): 4349-4359.
GUO B S, SHI G Y, WANG K H, LIU S E, ZHAO C P, WANG Z X, GENG J Y, HUA J P.Expression differences of dirigent-Like protein genes in upland cotton responsed to infection by.Scientia Agricultura Sinica, 2014, 47(22): 4349-4359.(in Chinese)
[40] Thamil Arasan S K, Park J I, Ahmed N U, Jung H J, Hur Y, Kang K K, Lim Y P, Nou I S.Characterization and expression analysis of dirigent family genes related to stresses in.Plant Physiology and Biochemstry, 2013, 67: 144-153.
[41] Guo J L, Xu L P, Fang J P, Su Y C, FU H Y, QUE Y X, XU J S.A novel dirigent protein gene with highly stem-specific expression from sugarcane, response to drought, salt and oxidative stresses.Plant Cell Reports, 2012, 31(10): 1801-1812.
[42] Liu G, Sheng X, Greenshields D L, Ogieglo A, Kaminskyj S, Selvaraj G, Wei Y.Profiling of wheat class III peroxidase genes derived from powdery mildew-attacked epidermis reveals distinct sequence-associated expression patterns.Molecular Plant Microbe Interaction, 2005, 18(7): 730-741.
[43] Majid M, Akbar M, Tomoaki H, Maki K.Drought stress alters water relations and expression of pip-type aquaporin genes inplants.Plant & Cell Physiology, 2008(5): 801-813.
[44] 崔苗苗, 马琳, 张锦锦, 王筱, 庞永珍, 王学敏.紫花苜蓿的表达特性及耐盐性效应.中国农业科学, 2020, 53(18): 27-41.
CUI M M, MA L, ZHANG J J, WANG X, PANG Y Z, WANG X M.Gene expression and salt-tolerance analysis ofgene from Alfalfa.Scientia Agricultura Sinica, 2020, 53(18): 27-41.(in Chinese)
[45] Davin L B, Lewis N G.Dirigent proteins and dirigent sites explain the mystery of specificity of radical precursor coupling in lignan and lignin biosynthesis.Plant Physiology, 2000, 123: 453-462.
Effects ofgene on the Fusarium wilt and drought-resistance in common bean
XUE RenFeng1, FENG Ming1, HUANG YuNing1, Matthew Blair2, Walter Messier3*, GE WeiDe1*
1Crop research institute, Liaoning Academy of Agricultural Sciences, Shenyang 110161, China;2Department of Agricultural and Environmental Sciences, Tennessee State University, Nashville 37209, TN USA;3Evolutionary Genomics, Inc., Lafayette 80501, LA USA
【Objective】By analyzing the sequence and expression pattern characteristics offrom common beans, and studying its resistance to Fusarium wilt and drought, the foundation was laid for the signal regulation network analysis of Fusarium wilt and drought-resistance and molecular breeding in common beans.【Method】 Bioinformatics analysis was performed on the open reading frame (ORF) ofto predict the physical and chemical properties, secondary structure, signal peptide sequence of the protein encoded by the, and search for highly homologous protein sequence in NCBI database through Blastp tool online for sequence alignment and phylogenetic tree construction; the tissue expression specificity ofand the expression pattern in response to Fusarium wilt pathogen and drought stress were analyzed by qRT-PCR;overexpression vector was constructed and transformed intoK599 to induce the generation of hairy transgenic roots in common beans.Meanwhile, thesilencing vector was constructed, and the transcription productwas inoculated on the seedlings of common bean to interfere withexpression.Through inoculation with the pathogen and drought treatment, the phenotypes of control,overexpressed and silenced plants were observed, disease and drought-resistance were both identified, and hydrogen peroxide (H2O2) content, malondialdehyde (MDA) content, superoxide dismutase (SOD) and peroxidase (POD) activity as physiological and biochemical indicators were all assayed.【Result】 The cDNA sequence ofwas 471 bp, which encodes a protein composed of 156 amino acids.The structure prediction indicated that it contained 10 strand structures, the predicted molecular mass of the encoding product was 38.89 kD, and the theoreticalwas 5.21.belonged to the members of dirigent gene superfamily, it contained a signal peptide sequence of 10 amino acids, and belonged to a secreted protein.The relationship between PvEG261 and cowpea DIR22 protein is the closest, which reached 91.61%.The results of qRT-PCR showed that the expression in the root tissues increased significantly after inoculation with Fusarium wilt pathogen and drought treatment, and the gene has obvious tissue expression specificity, with the highest expression level in the roots.After inoculation with pathogen and drought treatment, the disease and drought-resistance of the overexpressed plants were significantly improved in comparison with the control, the plant disease scores and the wilting degree caused by water shortage were significantly reduced, and the H2O2content, POD and SOD activity in the roots were all significantly higher than the control plant, while the MDA content was dramatically lower than the control plant.The disease and wilting degree of the gene silenced plants were significantly increased.The H2O2content, POD and SOD activity in the roots were significantly lower than the control plant, and the MDA content was significantly higher than the control plants.【Conclusion】responded to Fusarium wilt pathogen infection and drought stress, and positively regulated the Fusarium wilt and drought-resistance in common beans.
common bean;; fusarium wilt; drought stress; response mechanism
2021-04-06;
2021-05-27
国家自然科学基金(31972962)、财政部和农业农村部国家现代农业产业技术体系-食用豆(CARS-08)
薛仁风,E-mail:xuerf82@163.com。通信作者Walter Messier,E-mail:wmessier@evolgen.com。通信作者葛维德,E-mail:snowweide@163.com
(责任编辑 李莉)
