两种前处理方法对血培养直接药敏的影响
2021-10-30张灏旻
张灏旻,吴 晶,杨 俊,李 敏
上海交通大学医学院附属仁济医院检验科,上海 200127
血流感染(BSI)是临床非常危重的感染类型,有较高的发病率和死亡率[1]。近年来,随着临床上各种侵入性操作、免疫抑制剂、激素及大剂量广谱抗菌药物的广泛应用,BSI发病率有逐年上升的趋势。据统计,全球范围内每年约有1 900万人发生脓毒血症[2]。依据我国CHINET细菌耐药性监测网数据,2012年我国血流感染分离菌株数较2011年增加了21.4%[3]。及时使用有效的抗菌药物对于血流感染的预后是极其重要的[4-5]。如果能在感染后的1 h内进行正确治疗,脓毒血症的存活率为80.0%;每延迟1 h,死亡率增加7.0%[6]。因此快速、准确地对病原菌进行鉴定并提供药敏结果是正确进行治疗的基础。
随着以蛋白质指纹图谱为基础的基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)技术在临床微生物实验室的广泛使用,病原体的鉴定可以在培养后几分钟内完成。MALDI-TOF-MS技术具有快速、准确、敏感等优点[7-8]。MALDI-TOF-MS也能够用于对血培养阳性样本进行直接鉴定,一些自建方法与sepsityper 试剂盒的鉴定效果类似[9-11],上海在2017年初也发布了相关的检测规范[12],极大地缩短了血培养检测与鉴定的时间。但目前细菌药敏试验方法仍为培养获得菌落后采用仪器法或纸片扩散法进行,一般需要至少48~72 h才能获得药敏试验结果,不能快速指导临床准确地选择敏感抗菌药物进行抗感染治疗[13]。本研究探索血培养阳性样本采用BD分离胶促凝管进行前处理分离出细菌或进一步通过TSB肉汤增菌,随后在自动微生物鉴定药敏分析仪上进行体外药敏检测,并将结果与现有常规药敏自动检测方法进行对比,评估两种快速血培养阳性样本体外药敏前处理方法的作用,从而建立的报阳血培养直接体外药敏试验的新方法。
1 资料与方法
1.1一般资料 上海某三级教学医院2017年9月至2018年5月采集的临床血培养阳性样本,共241例。剔除同一患者因双侧双瓶采血产生的重复阳性样本。241例患者中男138例(57.3%),女103例(42.7%);年龄27~94岁,>60岁者161例(66.8%)。
1.2仪器与试剂 阳性血培养菌种鉴定由Biotyper MALDI-TOF MS(德国布鲁克公司)完成;体外药敏试验由PhoenixTM M50 全自动微生物鉴定药敏分析仪及其配套的药敏检测卡NMIC-413、PMIC-92、SMIC/ID-2及相应配套试剂(美国BD公司)完成。前处理使用分离胶促凝管购自美国BD公司;TSB肉汤干粉购自Oxiod公司。
1.3方法
1.3.1分离胶离心管离心直接药敏分析 从阳性血培养瓶抽取6 mL培养液至BD分离胶促凝管各样本制备3管;离心2 000 r/min,30 min;用一次性无菌吸管小心吸取上清液并弃去,在分离胶表面会出现一层白色细菌沉淀,取第1管的细菌沉淀按照MALDI-TOF MS血培养直接鉴定的流程进行操作,确定细菌菌种;取第2管,用无菌棉签挑取分离胶促凝管中白色沉淀,按BD Phoenix M50标准操作流程配置菌悬液,选择相应药敏板进行检测。
1.3.2分离胶离心管离心增菌后直接药敏分析 前处理方法同上。取第3管,用1 μL一次性接种环挑取分离胶促凝管中白色沉淀至加有1 mL TSB(美国赛默飞世尔公司)的EP管中,置35 ℃摇床200 r/min,孵育2 h。按BD Phoenix M50标准操作流程配置菌悬液,选择相应药敏板进行检测。
1.3.3传统的培养、鉴定和药敏试验 将报阳后的血培养转种血琼脂平板(上海伊华公司),培养并形成单个菌落后,挑取单个菌落采用MALDI-TOF MS进行鉴定,在自动微生物鉴定药敏分析仪(BD Phoenix M50)上进行药敏检测,并作为标准方法。
1.4判定标准 根据美国实验室与标准化研究所(CLSI)2017版对药敏结果进行判定。(1)类别一致性(CA):直接药敏结果和标准方法结果完全一致;(2)非常重大错误(VME):直接药敏结果为敏感(S)而标准方法结果为耐药(R);(3)重大错误(ME):直接药敏结果为R而标准方法结果为S;(4)微小错误(MIE):直接药敏结果为S或R而标准方法结果为中敏(I)或者直接药敏结果为I而标准方法结果为S或R。
1.5统计学处理 采用SPSS20.0统计学软件对两种前处理方法进行直接药敏检测的正确性进行分析,对不同种类抗菌药物药敏结果正确率主要应用χ2检验,对于χ2检验不适用的分析(统计个数小于5)采用费希尔精密验证(Fisher′s exact test)。以P<0.05为差异有统计学意义。
2 结 果
2.1分离胶离心后直接检测与传统转种培养鉴定的一致性 选取的241例中阳性血培养样本中,分离胶离心后直接采用MALDI-TOF MS鉴定出革兰阴性杆菌127例,革兰阳性球菌114例;采用传统的转种培养法鉴定出革兰阴性杆菌127例,革兰阳性球菌114例。两种方法的鉴定结果,革兰阴性菌各菌种鉴定符合率达100.0%,革兰阳性球菌中肺炎链球菌鉴定符合率仅为50.0%,其余菌种鉴定符合率均在90.0%以上比较。见表1。
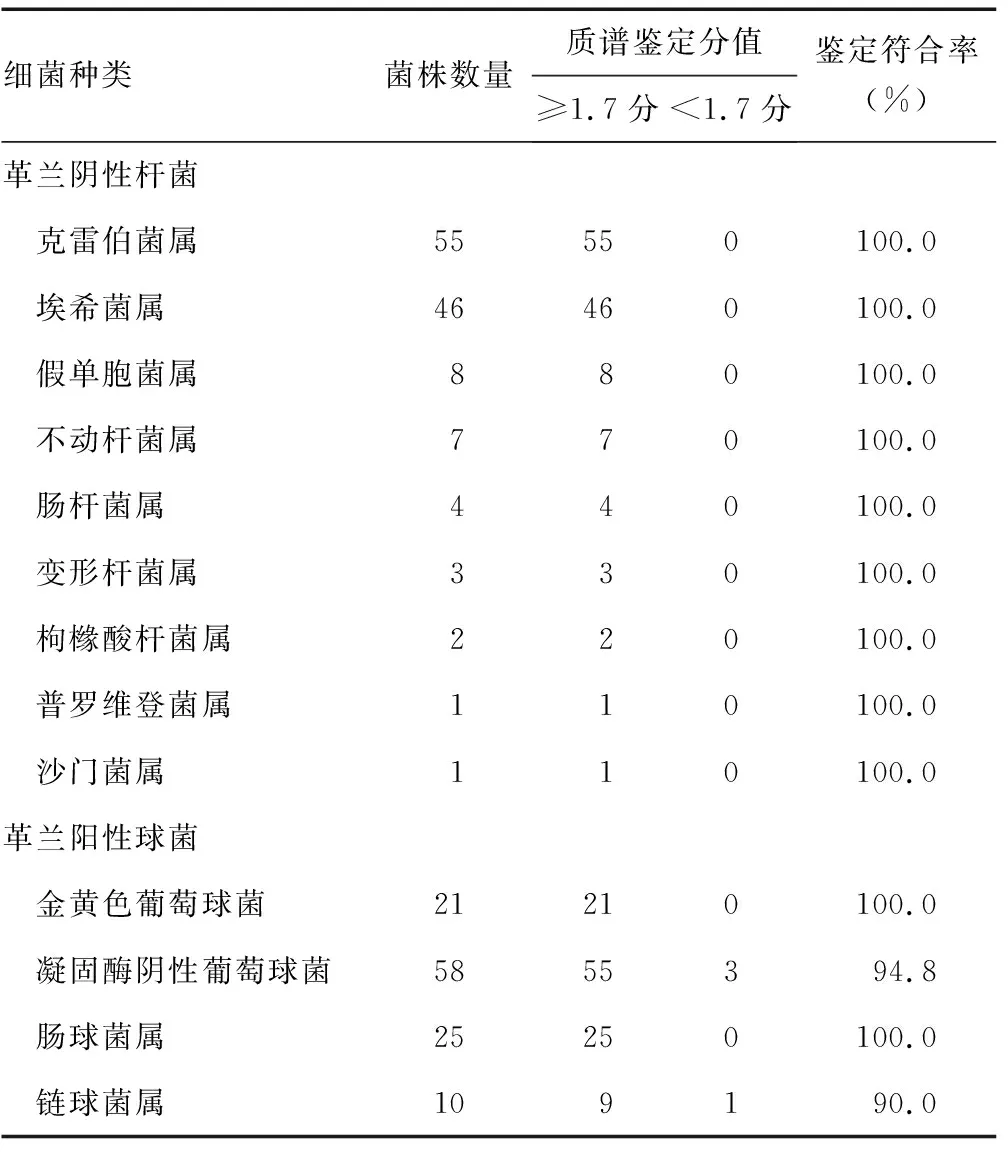
表1 分离胶离心直接鉴定与传统法鉴定结果符合率
2.2革兰阴性菌的分离胶离心后直接药敏分析结果 共127例革兰阴性菌血培养阳性标本进行了药敏试验。将根据CLSI指南不需要报告的药敏结果剔除后,所有的药敏报告可提供22种常见抗菌药物的药敏结果(表2)。直接法及增菌法的药敏结果与标准法相比所有抗菌药物的CA均大于90.0%。其中在8种抗菌药物中两种方法的药敏结果与标准法的结果完全一致。直接法在美罗培南的检测中也与标准法一致。两种方法在环丙沙星、亚胺培南、妥布霉素及复方磺胺甲噁唑上均出现了1~2例VME,这些错误全部发生在克雷伯菌属中。此外,直接法在哌拉西林-他唑巴坦中有一个来自大肠埃希菌的VME。在阿莫西林-克拉维酸、头孢吡肟、厄他培南和复方磺胺甲噁唑中直接法出现了1~2例的ME;与直接法相比,增菌法除了在上述的4种抗菌药物中有ME,在米诺环素上也存在1个来自埃希菌属的ME。在MIE方面,直接法的发生率略高于增菌法的发生率,分别为30例和24例。两种方法在阿莫西林-克拉维酸、氨苄西林-舒巴坦、头孢西丁、环丙沙星、亚胺培南、米诺环素上的错误发生率相同。增菌法在头孢吡肟和美罗培南中出现了1例错误而直接法在厄他培南、复方磺胺甲噁唑有错误出现。在所有被检测的抗菌药物中,用两种方法检测米诺环素的错误率最高,替加环素次之,这些错误主要为MIE,大部分来自克雷伯菌属。米诺环素在临床上不作为治疗克雷伯菌血流感染的一线用药,替加环素因血药浓度低需要与其他抗菌药物联合才能达到治疗效果,所以在克雷伯菌属直接药敏结果中可以删除米诺环素和替加环素结果,同时根据临床需要加做以替加环素为基础的联合药敏实试验以补充直接药敏结果。

表2 革兰阴性菌两种直接药敏检测方法与标准药敏方法检测结果的比较分析[n=127,n(%)]
2.3革兰阳性球菌的分离胶离心后直接药敏分析结果
2.3.1104例革兰阳性球菌(非链球菌)血培养阳性标样本 用PMIC-92药敏卡进行评估,在剔除不需要报告的药敏结果后,对20种常见抗菌药物进行了药敏结果分析(表3)。两种方法在50.0%的抗菌药物上与标准方法保持了100.0%的CA;富集增菌法更是在除利福平外的其他全部抗菌药物的检测中没有出现VME;直接法在诺氟沙星、青霉素 G、利福平、四环素及复方磺胺甲噁唑中出现3例VME;其中青霉素 G的错误来自肠球菌,复方磺胺甲噁唑来自金色葡萄球菌,其他全部来自凝固酶阴性葡萄球菌。两种方法在克林霉素中出现了1.9% 的VME,来自金色葡萄球菌及凝固酶阴性葡萄球菌。富集增菌法在利奈唑胺和高浓度莫匹罗星中出现1.0%VME而直接法在替考拉宁中也有1.0%ME。直接法在MIE的发生率要高于富集增菌法,在米诺环素及莫西沙星检测中的差异最为明显,主要由肠球菌属造成;提示该两种抗菌药物结果在肠球菌中不可靠,需要复测。两种方法在诺氟沙星的检测中都出现了较多的MIE,诺氟沙星临床很少用于血流感染的治疗,可以考虑删除。此外,两种方法在万古霉素中发生的1例MIE,经复核后确定为离心过程中污染导致。
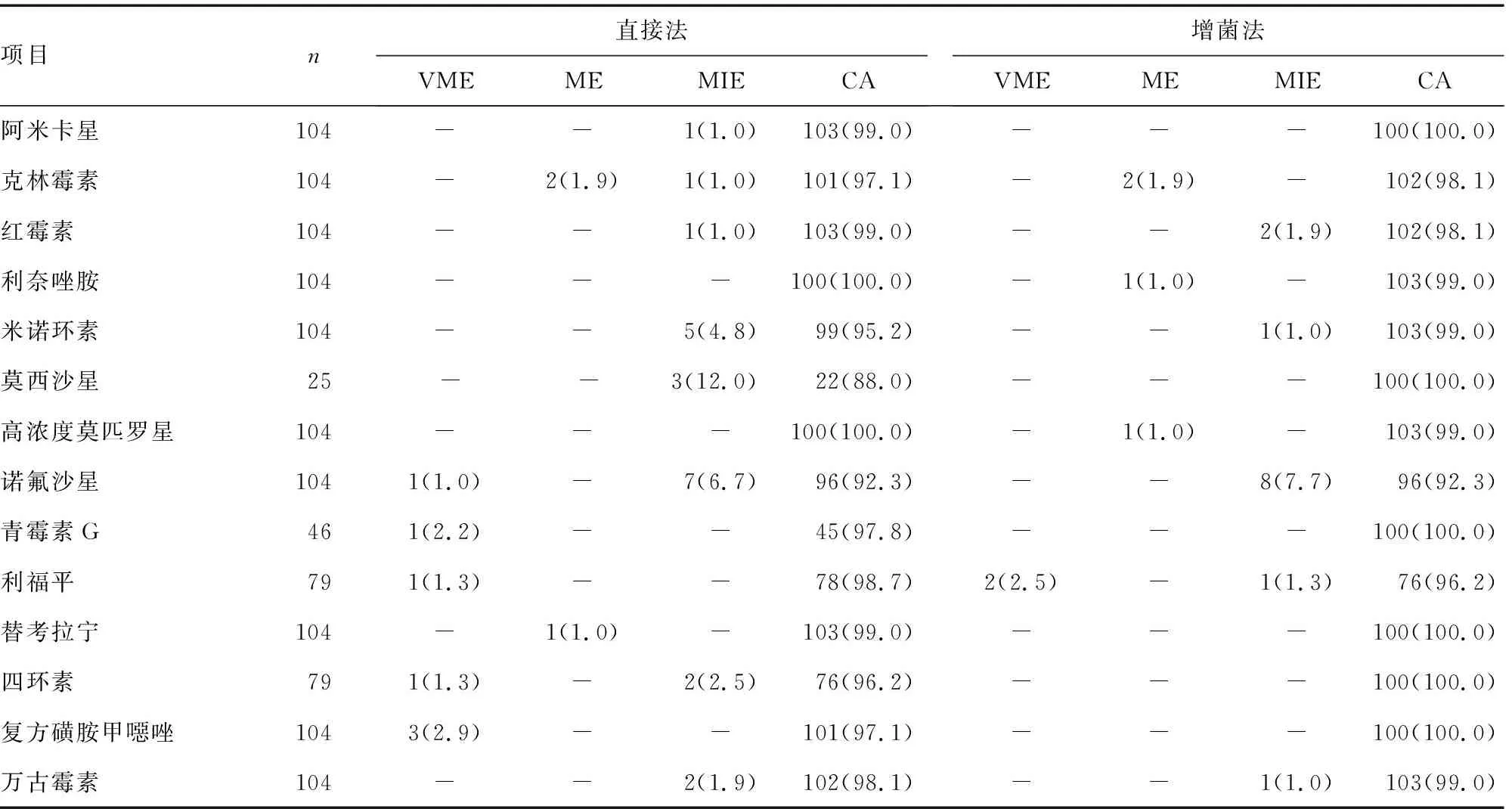
表3 革兰阳性球菌(非链球菌)两种直接药敏检测方法与标准药敏方法检测结果[n(%)]
2.3.210例链球菌属血培养阳性样本使用SMIC/ID-2药敏卡进行评估 此板条覆盖了阿莫西林、头孢吡肟、头孢噻肟、氯霉素、克林霉素、红霉素、左氧氟沙星、利奈唑胺、美罗培南、莫西沙星、青霉素G、替考拉宁和四环素共13种抗菌药物。与标准方法相比直接法和增菌法均表现良好,没有出现任何错误,CA为100.0%。
2.4药敏结果CA分析 综上所述,直接法与增菌法在不同菌株的一些抗菌药物药敏分析结果上有所差异。为了确定两种方法对菌株的所有药敏结果是否存在统计学差异,现根据不同药敏板归类就CA、VME、ME及MIE进行统计分析。经过统计学分析,两种方法在革兰阴性菌和革兰阳性球菌中的CA、VME、ME和MIE比例相近,差异无统计学意义(P>0.05),见表4。
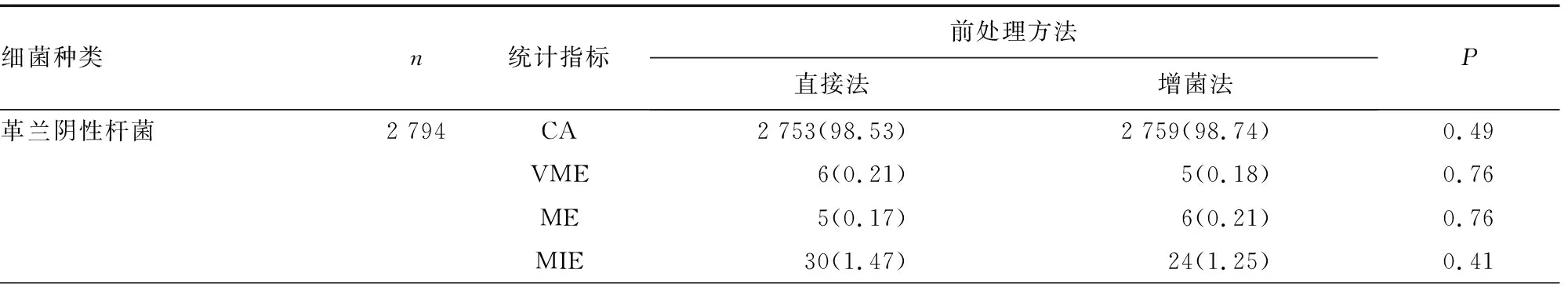
表4 两种直接药敏检测方法与标准药敏方法检测结果的一致性分析[n(%)]
3 讨 论
血培养是临床诊断血流感染的金标准,随着MALDI-TOF MS在阳性血培养直接鉴定中的广泛应用,临床已能够在数小时内获得阳性血培养病原体鉴定结果,但传统的体外药敏试验仍无法提供快速准确的药敏结果。临床医生在获得准确的体外药敏结果以前,仍然被迫采取经验性治疗,不仅无法准确地进行病因治疗,而且因非敏感抗菌药物的治疗增加住院时间和费用,给个人及社会造成负担,还可能诱导耐药菌的产生。因此临床诊疗血流感染的关键不仅在于病原体的快速鉴定,快速准确的药敏结果更是临床迫切需要的。
近期新出现的自动化全药敏板条,为快速地进行药敏检测提供了基础。通过前处理获得标准浓度的菌悬液,在自动微生物鉴定药敏分析仪进行直接药敏试验,不仅可以实现操作的标准化而且药敏结果可以通过实验室信息系统自动传送到医生工作站。单纯药敏板条结合目前已经成熟的血培养直接萃取鉴定技术,快速准确地提供血培养直接鉴定药敏报告,帮助医生尽早确定正确的治疗方案[14-19]。
目前临床微生物室的血培养药敏试验,不论是仪器MIC法还是手工K-B法,均需要转种后获得纯菌落,制备标准浓度的菌悬液,再进行体外药敏试验,需要2~3个工作日,无法满足临床对血流感染及时准确治疗的需求。欧洲临床微生物和感染病学会药敏委员会(EUCAST)在2019年发布了血培养快速药敏实验折点,实验室将阳性血培养液直接涂布在MH琼脂平板上,再贴上药敏纸片经孵育后通过抑菌圈的直径来判断直接药敏的结果有了标准。但该折点仅覆盖大肠埃希菌(8种抗菌药物)、肺炎克雷伯菌(8种抗菌药物)、铜绿假单胞菌(7种抗菌药物)、鲍曼不动杆菌(8种抗菌药物)、金黄色葡萄球菌(4种抗菌药物)、粪肠球菌(5种抗菌药物)、屎肠球菌(5种抗菌药物)和肺炎链球菌(5种抗菌药物),并不能覆盖国内血流感染的病原体,抗菌药物组合也很难满足临床需要。
本研究中探究两种血培养阳性样本前处理方法直接药敏试验的可行性,与有关文献报道不同的是[20],本研究中采用两种血培养阳性样本直接萃取鉴定,通过样本前处理结合单纯药敏板完成药敏检测,避免了使用复合板条所造成的鉴定结果不可靠和成功率低的问题。两种前处理直接药敏结果与标准方法类别一致性均>95.00%,完全符合临床微生物对体外药敏试验的要求。经统计学分析两种方法结果比较差异无统计学意义(P>0.05)。而直接沉淀法与增菌法相比操作简单无需繁琐的增菌过程,能够避免增菌过程中的污染可能,这种简单的前处理方法与标准方法类别一致性>95.00%。
综上所述,直接沉淀法可作为微生物实验室血培养样本传统纸片法的一种方便又可靠的替代方法。
