桃红四物合剂对兔股动脉吻合术后凝血功能及PI3K/AKT/mTOR 通路的影响
2021-10-29谢心军谢先敏邝高艳许晓彤李梓宸安建平岳凯峰东智卓玛
谢心军,谢先敏,邝高艳,许晓彤,李梓宸,安建平,王 哲,周 麒,岳凯峰,东智卓玛
(1.湖南中医药大学第一附属医院,2.湖南中医药大学,湖南 长沙 410007)
随着工业器械的广泛使用,断肢(指)的发生率逐渐增加,而断肢(指)再植术可最大化地保留患者的肢体功能,亦能增加患肢的美观度。但动脉血管危象是影响再植术肢(指)成活率的主要并发症,其多由疼痛、寒冷、吸烟、心理等各种原因引起动脉血管痉挛,脉管内血液流通受阻引发血栓形成,最终导致远端软组织缺血缺氧而坏死[1-3]。因此,术后积极预防血管危象并对其进行实时观察、发现和紧急处理,是断肢(指)再植术能否成功的关键。
目前对于动脉血管危象的处理主要是以抗感染、抗痉挛、抗凝血为主的预防性药物治疗[4,5],常见低分子肝素、罂粟碱、低分子右旋糖酐、肝素、前列地尔等,给药方式多为臀部肌肉注射、局部注射、静脉注射、和自控型镇痛泵等。然而,持续或较大剂量使用传统“三抗”治疗存在多种不良反应,包括注射局部皮肤皮疹、疼痛、硬结,恶心、胸闷,血小板减少、出血[6-8]以及心室纤维颤动、心跳骤停等严重不良反应[9]。而且由于相关的抗凝、抗痉挛药物的药代动力学差异和患者的个体差异,其对血管危象的防治效果不甚稳定[9,10],故探索多途径、多角度、多手段预防血管危象是非常必要的。有学者认为小剂量抗焦虑药物[11]、臭氧自体血治疗[12]和术后应用保温技术、心理护理[13-15]等治疗方案也可降低断肢(指)再植术后血管危象发生率。
而中医药在提高断肢(指)成活率方面效用明确。多项研究表明[16-19],中药可有效防治断肢(指)再植术后动脉血管危象的发生,提高临床疗效。中药复方桃红四物汤的药效研究发现其具有明显抗凝、抑制血小板聚集、改善微循环、止痛、抗炎等作用,且不良反应发生率低。在防治下肢静脉血栓、创伤性骨折、膝骨关节炎、骨质疏松症、疼痛等常见骨科疾病及动脉硬化、脑梗、心绞痛等心血管疾病中疗效显著[20-24],而其活血抗凝、抗感染、止痛等相关药理作用正适应断肢(指)再植术后的治疗需求。但中药汤剂存在煎煮耗时、携带困难等不便,为此,我院以清·吴谦《医宗金鉴》之桃红四物汤为基础方,结合临床实践经验和医典医案,将方中药味药量及配伍加减化裁,利用现代工艺手段制成便于临床运用的桃红四物合剂,其在临床干预骨关节炎、皮瓣移植术后、肢体缺血再灌注等治疗方面的疗效确切[23,25,26];但其对于断肢(指)再植术后的治疗及相关机制尚不明确。
创伤、手术、炎症等能够激活组织细胞内磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)/哺乳动物雷帕霉素靶蛋白(mTOR)通路,此通路通过正性调节缺氧诱导因子-1α(HIF-1α),间接诱导调控血管内皮生长因子(VEGF)、各类趋化因子的释放增强,达到调节细胞增殖生长、血管舒张及血管新生的作用。
故本实验拟通过观察兔股动脉吻合术后予以桃红四物合剂对兔凝血相关指标的影响,明确其是否能够预防血管危象,同时观察其对PI3K/AKT/mTOR 信号通路的影响,探讨其是否能够促进血管新生,并为临床上应用桃红四物合剂预防或改善断肢(指)再植术后血管危象提供科学理论依据。
1 材料与方法
1.1 材料
1.1.1 动物 普通级新西兰大白兔30 只,3 个月龄,均为体质量2.0~2.5 kg,由湖南中医药大学科技创新中心实验动物中心代购[湖南太平生物科技有限公司,许可证号SCXK(湘)2015-0004],动物饲养室温(23±2)℃,相对湿度50%~60%。
本实验获得湖南中医药大学实验动物伦理委员会准许,伦理编号LLBH-201907300002,实验单位使用许可证编号:SYXK(湘)2019-0009。
1.1.2 药物与试剂 桃红四物合剂为湖南中医药大学第一附属医院自制(制剂制备字Z202002299000,生产批号20190408);盐酸罂粟碱氯化钠注射液(江苏恒瑞医药股份有限公司,国药准字H32020967,批号:PH181105);注射用青霉素钠(华北制药股份有限公司,国药准字H13020657,产品批号:F8042104);乌来糖(合肥巴斯夫生物科技有限公司,产品批号:BSF191120);0.9%氯化钠注射液(湖南康源制药有限公司,国药准字H43020169,生产批号C20063001d);PI3K、AKT、mTOR 试剂盒(上海酶联生物科技有限公司,货号分别为ml360578、ml601105、ml250325,批号均为12/2019)。
1.1.3 仪器 台式高速冷冻离心机(湘仪,货号H1650R),全自动酶标洗板机(汇松,货号PW-812),多功能酶标分析仪(汇松,货号MB-530),恒温培养箱(光明,DHP-500),自动平衡离心机(湘仪,货号L530)。
1.2 方法
1.2.1 动物分组及给药 将30 只新西兰大白兔适应性饲养1 周,确认全部健康。采用随机数字表法分为空白对照组、模型对照组、盐酸罂粟碱注射液组以及桃红四物合剂低、中、高剂量组,每组5 只。桃红四物合剂低、中、高剂量组自术后半小时开始予以桃红四物合剂灌胃,给药量以临床人与兔体表面积换算[27],灌胃量分别为2.80、5.61、11.22 mL/kg,中剂量为临床等效剂量,桃红四物合剂低、中剂量组与高剂量组补液差额予以中药灌胃4 h 后差额体积0.9%氯化钠注射液灌胃(分别为8.42、5.61 mL/kg),连续灌胃7 d。空白对照组、模型对照组及盐酸罂粟碱注射液组予以0.9% 氯化钠注射液灌胃11.21 mL/kg。为防止感染,5 组造模实验兔在术后3 d 内连续肌肉注射青霉素40 万U/d[28]。
造模过程中,桃红四物合剂中剂量组及模型对照组内各有1 只实验兔因对麻药不耐受导致死亡,重新取2 只新西兰大白兔适应性饲养1 周后采用随机数字表法分别补充至上述两组。
1.2.2 造模及样本采集 模型对照组、盐酸罂粟碱注射液组以及桃红四物合剂低、中、高剂量组实验兔予以股动脉单纯间断端端缝合模型[29]:实验兔耳缘静脉缓慢推注25%乌来糖1 g/kg 以麻醉,麻醉成功后实验兔取仰卧位,将兔上切牙及四肢固定在解剖台上;均取兔右后大腿脱毛,予以常规消毒、铺巾;大腿内侧根部入路,作一长约3 cm 横切口,逐层分离,游离并保护股静脉及股神经,游离出股动脉后血管夹夹闭,于中段部位切断;切断后在10 倍显微镜下进行显微缝合,用两定点缝合法,以9-0 不可吸收显微缝线进行单纯间断端端缝合;吻合完毕后除掉血管夹,检查吻合口无漏血,股动脉再通良好,证明造模成功;然后关闭切口,无菌敷料包扎后石膏外固定。
样本采集:在造模前30 min,造模后1、2、3、7 d 负压抗凝试管分别采取各组实验兔耳缘静脉血2 mL。
1.2.3 检测APTT,FIB 采血试管对称位置放入高速台式低温离心机,以3×10 r/min 离心10 min,取上层血浆,按试剂盒操作说明运用全自动血凝分析仪,检测APTT、FIB 含量。
1.2.4 ELISA Kit 检测PI3K、AKT、mTOR 蛋白表达浓度 采血试管对称位置放入高速台式低温离心机,4 ℃1 000g离心15 min ,取上清进行分装并-20 ℃保存标本,解冻后的样品再次离心后按试剂盒操作说明检测。
1.3 统计学处理
所有数据采用SPSS22.0 统计软件进行统计分析,6 组实验数据均为计量资料,均采用(±s)表示。各组数据符合正态分布且满足方差齐性时,6组组间差异比较采用单因素方差分析,组间两两比较采用LSD 法;各组数据不符合正态分布或方差不齐,则采用非参数检验。设定检验水平α=0.05,P<0.05 为差异具有统计学意义。
2 结果
2.1 桃红四物合剂对兔股动脉吻合术后APTT 及FIB 的影响
与空白对照组血浆APTT 相比,模型对照组于术后1~7 d 均明显缩短(P<0.05);与模型对照组血浆APTT 相比,桃红四物合剂低、中、高剂量组于术后1~7 d 均明显延长(P<0.05),盐酸罂粟碱注射液组于术后2~7 d 均明显延长(P<0.05);与盐酸罂粟碱注射液组血浆APTT 相比,桃红四物合剂中剂量组于术后2~7 d 均明显延长(P<0.05),桃红四物合剂高剂量组于术后1~7 d 均明显延长(P<0.05)。见表1。
表1 6 组治疗前后APTT 比较(s,n=5,±s)Tab 1 Comparison of APTT before and after treatment in six groups(s,n=5,±s)
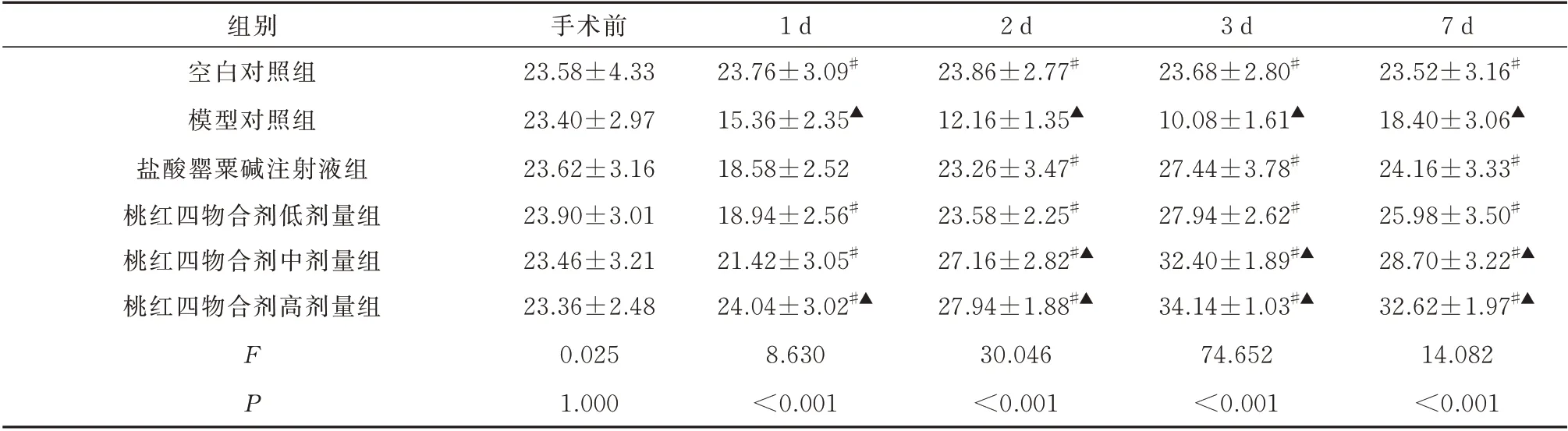
表1 6 组治疗前后APTT 比较(s,n=5,±s)Tab 1 Comparison of APTT before and after treatment in six groups(s,n=5,±s)
注:与模型对照组比较,#P<0.05;与盐酸罂粟碱注射液组比较,▲P<0.05。
7 d 23.52±3.16#18.40±3.06▲24.16±3.33#25.98±3.50#28.70±3.22#▲32.62±1.97#▲14.082<0.001组别空白对照组模型对照组盐酸罂粟碱注射液组桃红四物合剂低剂量组桃红四物合剂中剂量组桃红四物合剂高剂量组FP手术前23.58±4.33 23.40±2.97 23.62±3.16 23.90±3.01 23.46±3.21 23.36±2.48 0.025 1.000 1 d 23.76±3.09#15.36±2.35▲18.58±2.52 18.94±2.56#21.42±3.05#24.04±3.02#▲8.630<0.001 2 d 23.86±2.77#12.16±1.35▲23.26±3.47#23.58±2.25#27.16±2.82#▲27.94±1.88#▲30.046<0.001 3 d 23.68±2.80#10.08±1.61▲27.44±3.78#27.94±2.62#32.40±1.89#▲34.14±1.03#▲74.652<0.001
与空白对照组血浆FIB 值相比,模型对照组于术后1~7 d 均明显增高(P<0.05);与模型对照组血浆FIB 值相比,桃红四物合剂中、高剂量组于术后1~7 d 均明显减小(P<0.05),桃红四物合剂低剂量组于术后2~7 d 均明显减小(P<0.05),盐酸罂粟碱注射液组于术后2~7 d 均明显减小(P<0.05);与盐酸罂粟碱注射液组血浆FIB 值相比,桃红四物合剂中、高剂量组于术后1~7 d 均明显减小(P<0.05)。见表2。
表2 6 组治疗前后FIB 比较(g/L,n=5,±s)Tab 2 Comparison of FIB before and after treatment in six groups(g/L,n=5,±s)
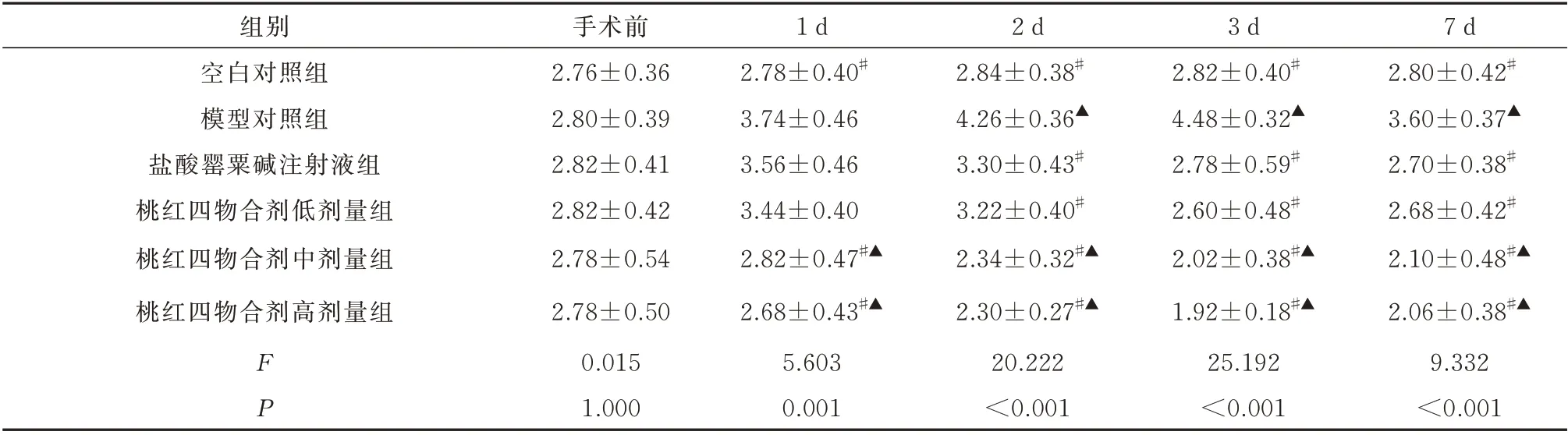
表2 6 组治疗前后FIB 比较(g/L,n=5,±s)Tab 2 Comparison of FIB before and after treatment in six groups(g/L,n=5,±s)
注:与模型对照组比较,#P<0.05;与盐酸罂粟碱注射液组比较,▲P<0.05。
7 d 2.80±0.42#3.60±0.37▲2.70±0.38#2.68±0.42#2.10±0.48#▲2.06±0.38#▲9.332<0.001组别空白对照组模型对照组盐酸罂粟碱注射液组桃红四物合剂低剂量组桃红四物合剂中剂量组桃红四物合剂高剂量组FP手术前2.76±0.36 2.80±0.39 2.82±0.41 2.82±0.42 2.78±0.54 2.78±0.50 0.015 1.000 1 d 2.78±0.40#3.74±0.46 3.56±0.46 3.44±0.40 2.82±0.47#▲2.68±0.43#▲5.603 0.001 2 d 2.84±0.38#4.26±0.36▲3.30±0.43#3.22±0.40#2.34±0.32#▲2.30±0.27#▲20.222<0.001 3 d 2.82±0.40#4.48±0.32▲2.78±0.59#2.60±0.48#2.02±0.38#▲1.92±0.18#▲25.192<0.001
2.2 桃红四物合剂对兔股动脉吻合术后PI3K、AKT、mTOR 表达的影响
与空白对照组相比,模型对照组血清PI3K、AKT、mTOR 的表达浓度在术后1~7 d 均明显增高(P<0.05)。
与模型对照组血清PI3K、AKT、mTOR 表达浓度相比,桃红四物合剂低剂量组、盐酸罂粟碱注射液组均于术后7 d 明显增高(P<0.05),桃红四物合剂高剂量组于术后1~7 d 均明显增高(P<0.05),桃红四物合剂中剂量组PI3K 及AKT 表达浓度于术后2~7 d 均明显增高(P<0.05)、mTOR 表达浓度于术后3~7 d 均明显增高(P<0.05)。
与盐酸罂粟碱注射液组血清PI3K、AKT、mTOR 表达浓度相比,桃红四物合剂中剂量组于术后3~7 d 均明显增高(P<0.05),桃红四物合剂高剂量组PI3K 及mTOR 表达浓度于术后1~7 d 均明显增高(P<0.05)、AKT 表达浓度于术后3~7 d 均明显增高(P<0.05);见表3~5。
表3 6 组治疗前后PI3K 蛋白表达浓度比较(pg/mL,n=5,±s)Tab 3 Comparison of PI3K protein expression concentration of six groups before and after treatment(pg/mL,n=5,±s)
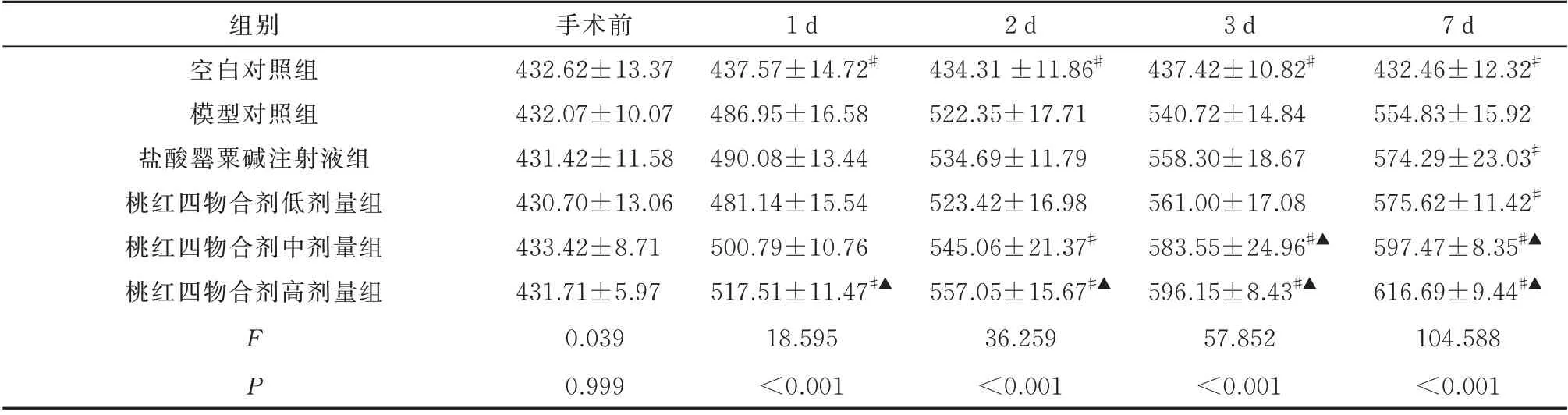
表3 6 组治疗前后PI3K 蛋白表达浓度比较(pg/mL,n=5,±s)Tab 3 Comparison of PI3K protein expression concentration of six groups before and after treatment(pg/mL,n=5,±s)
注:与模型对照组比较,#P<0.05;与盐酸罂粟碱注射液组比较,▲P<0.05。
7 d 432.46±12.32#554.83±15.92 574.29±23.03#575.62±11.42#597.47±8.35#▲616.69±9.44#▲104.588<0.001组别空白对照组模型对照组盐酸罂粟碱注射液组桃红四物合剂低剂量组桃红四物合剂中剂量组桃红四物合剂高剂量组FP手术前432.62±13.37 432.07±10.07 431.42±11.58 430.70±13.06 433.42±8.71 431.71±5.97 0.039 0.999 1 d 437.57±14.72#486.95±16.58 490.08±13.44 481.14±15.54 500.79±10.76 517.51±11.47#▲18.595<0.001 2 d 434.31 ±11.86#522.35±17.71 534.69±11.79 523.42±16.98 545.06±21.37#557.05±15.67#▲36.259<0.001 3 d 437.42±10.82#540.72±14.84 558.30±18.67 561.00±17.08 583.55±24.96#▲596.15±8.43#▲57.852<0.001
表4 6 组治疗前后AKT 蛋白表达浓度比较(ng/mL,n=5,±s)Tab 4 Comparison of AKT protein expression concentration of six groups before and after treatment(ng/mL,n=5,±s)
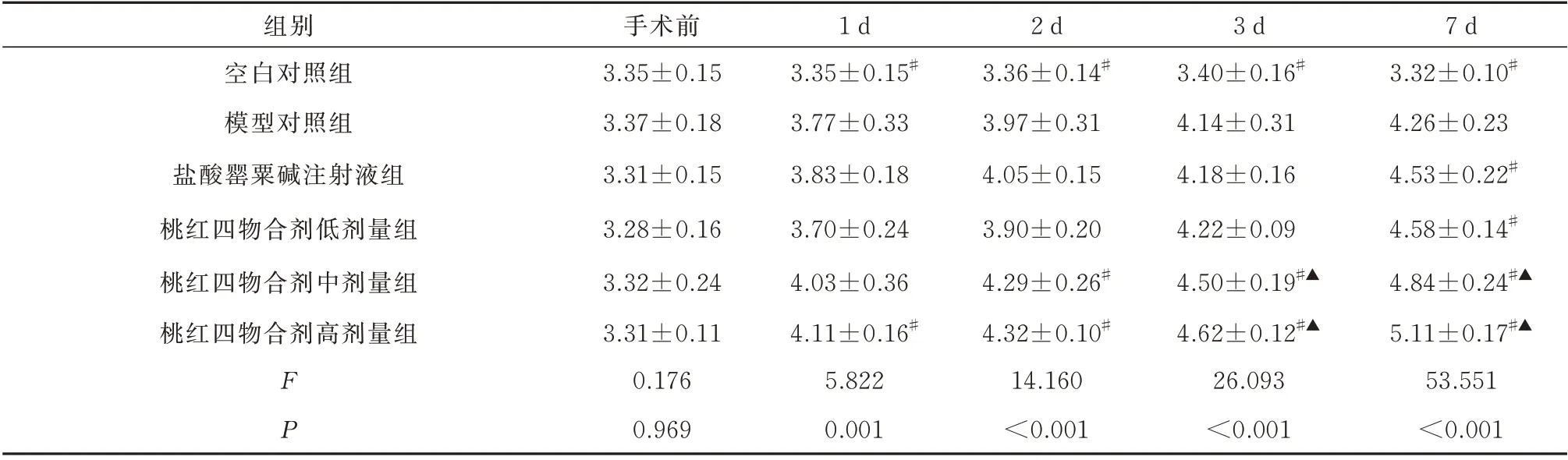
表4 6 组治疗前后AKT 蛋白表达浓度比较(ng/mL,n=5,±s)Tab 4 Comparison of AKT protein expression concentration of six groups before and after treatment(ng/mL,n=5,±s)
注:与模型对照组比较,#P<0.05;与盐酸罂粟碱注射液组比较,▲P<0.05。
7 d 3.32±0.10#4.26±0.23 4.53±0.22#4.58±0.14#4.84±0.24#▲5.11±0.17#▲53.551<0.001组别空白对照组模型对照组盐酸罂粟碱注射液组桃红四物合剂低剂量组桃红四物合剂中剂量组桃红四物合剂高剂量组FP手术前3.35±0.15 3.37±0.18 3.31±0.15 3.28±0.16 3.32±0.24 3.31±0.11 0.176 0.969 1 d 3.35±0.15#3.77±0.33 3.83±0.18 3.70±0.24 4.03±0.36 4.11±0.16#5.822 0.001 2 d 3.36±0.14#3.97±0.31 4.05±0.15 3.90±0.20 4.29±0.26#4.32±0.10#14.160<0.001 3 d 3.40±0.16#4.14±0.31 4.18±0.16 4.22±0.09 4.50±0.19#▲4.62±0.12#▲26.093<0.001
表5 6 组治疗前后mTOR 蛋白表达浓度比较(ng/mL,n=5,±s)Tab 5 Comparison of mTOR protein expression concentration of six groups before and after treatment(ng/mL,n=5,±s)
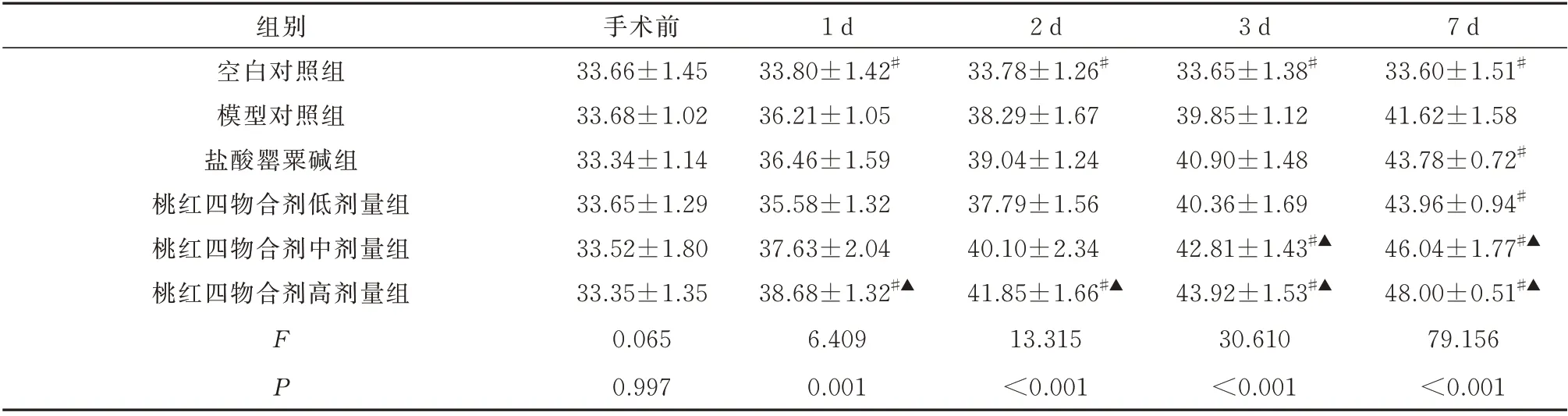
表5 6 组治疗前后mTOR 蛋白表达浓度比较(ng/mL,n=5,±s)Tab 5 Comparison of mTOR protein expression concentration of six groups before and after treatment(ng/mL,n=5,±s)
注:与模型对照组比较,#P<0.05;与盐酸罂粟碱注射液组比较,▲P<0.05。
7 d 33.60±1.51#41.62±1.58 43.78±0.72#43.96±0.94#46.04±1.77#▲48.00±0.51#▲79.156<0.001组别空白对照组模型对照组盐酸罂粟碱组桃红四物合剂低剂量组桃红四物合剂中剂量组桃红四物合剂高剂量组FP手术前33.66±1.45 33.68±1.02 33.34±1.14 33.65±1.29 33.52±1.80 33.35±1.35 0.065 0.997 1 d 33.80±1.42#36.21±1.05 36.46±1.59 35.58±1.32 37.63±2.04 38.68±1.32#▲6.409 0.001 2 d 33.78±1.26#38.29±1.67 39.04±1.24 37.79±1.56 40.10±2.34 41.85±1.66#▲13.315<0.001 3 d 33.65±1.38#39.85±1.12 40.90±1.48 40.36±1.69 42.81±1.43#▲43.92±1.53#▲30.610<0.001
3 讨论
在中医学理论中,“血管”的概念涵盖于“脉”之中[30]。由此,现代血管的解剖称谓在古代文献中常称为“脉”,“血脉”,“血络”等。中医学认为,断肢(指)为外伤致筋骨离断、血脉受损,筋伤骨折失其连接作用使肢(指)体活动障碍,再植后血管危象为血脉受损,或因血溢脉外,或因血滞脉内,均凝为瘀血、继发气滞使筋脉失养,总以外伤致筋脉血瘀、气滞、失养为病机。故治疗应以活血行气、化瘀通脉、养血活血为法[31,32]。
桃红四物汤首见于清·吴谦《医宗金鉴》,方中川芎、当归、白芍、熟地黄、桃仁及红花相合,共奏养血活血逐瘀之效,为中医传统袪瘀生新的经典方剂之一。我院中医骨伤科以桃红四物汤为基础方研制的桃红四物合剂不仅功效类似,且在存储、服用等方面相较于桃红四物汤更加方便。现代化学成分及药理作用研究表明,桃红四物汤有抗血栓,抑制血小板聚集,快微动脉血流,改善局部微循环[33,34];延缓股骨头坏死,促进骨折愈合并减少下肢静脉血栓、肿胀 等并发症[35,36];增强细胞抗氧化能力,减轻血管内皮细胞损伤并增加内皮祖细胞数量,改善血管内皮细胞分泌功能失调[37-39]。
现显微外科缝合技术成熟、手术器械先进使得血管吻合质量显著提高,术后护理模式多样且全面,均能有效提升再植术后存活率。因此,外伤、手术等损伤血管内皮细胞,以及伴随的炎症反应激活血小板及内、外源性凝血系统,血小板凝集、纤维蛋白形成、血液高凝使血小板等在损伤部位发生粘附,吻合动脉管壁血栓形成,吻合血管失通是再植失败的主要病理原因[40-43]。
PI3K/AKT/mTOR 通路是人体内参与多种生理和病理状态的关键信号通路,通过通路本身及其下游底物HIF-1α、VEGF 等介质调控内皮细胞增殖、代谢、存活,是平滑肌细胞和内皮细胞生长发育的必要条件,在血管生成过程中起重要作用。研究发现[44-46],PI3K 是机体血管病理及生理性生成活动过程中尤为重要的信号节点,通过调控血管生成过程中毛细血管周细胞的增殖和成熟参与血管生成,且Ⅰ类PI3K 中的亚型PI3Kα 是血管内皮细胞生成、生长、凋亡等过程中最相关的亚型。PI3K 的活化使AKT 发生磷酸化,从而激活AKT。研究发现[47,48],AKT 具有负调节机体细胞凋亡机制作用,从而促进细胞增殖存活,参与血管内皮细胞的存活与凋亡之间的平衡协调。mTOR 与PI3K/AKT 具有双向激活 效 应,且mTOR 是HIF-1α 促 进VEGF 表 达 之 间的 连 系 点。mTOR 正 性 调 节HIF-1α 的 表 达,HIF-1α 不仅可以直接激活VEGF 的转录活性,还可以通过缺氧条件下合成NO 使血管通透性增加从而促进VEGF 表达[49-53]。血管新生过程中骨架结构的构成、细胞形态的伸长、细胞的迁移增殖等关键环节均 是 在VEGF 调 控 下 完 成[54]。因 此,PI3K/AKT/mTOR 信号通路不仅能够直接影响血管内皮细胞生长,还可以通过激活下游HIF-1α 及VEGF 等多层面宏观调控血管新生。
本研究结果显示,模型对照组实验兔血清PI3K、AKT、mTOR 的表达浓度在术后1~7 d 均明显高于空白对照组,表明血管内皮细胞损伤、缺血缺氧可以激活PI3K/AKT/mTOR 通路,同上述研究结果一致。桃红四物合剂组与模型对照组相比,低剂量组血清PI3K、AKT、mTOR 表达浓度于术后7 d 明显增高,中剂量组PI3K 及AKT 表达浓度于术后2~7 d 均明显增高、mTOR 表达浓度于术后3~7 d 均明显增高,高剂量组于术后1~7 d 均明显增高。同时,桃红四物合剂与盐酸罂粟碱注射液组相比,中剂量组血清PI3K、AKT、mTOR 表达浓度于术后3~7 d 均明显增高,高剂量组PI3K 及mTOR 表达浓度于术后1~7 d 均明显增高、AKT 表达浓度于术后3~7 d 均明显增高,表明桃红四物合剂能够通过激活PI3K/AKT/mTOR 通路促进血管新生,利于兔股动脉吻合术后再通血管的修复愈合,利于提高再植术后成活率。
本研究仅通过ELISA 实验检测PI3K/AKT/mTOR 通路指标,方法较为单一,无法判断除通路指标作用外是否有下游产物作用。进一步研究将结合吻合血管病理切片观察血管再生情况、免疫组化法检测本通路及其下游指标观察是否有下游指标参与、使用PI3K/AKT/mTOR 通路阻断剂判断是否为通路直接作用。
作者贡献度说明:
东智卓玛:参与全程实验;谢先敏、李梓宸、许晓彤:实验动物造模等;安建平、王哲、周麒、岳凯峰:实验动物灌胃,标本采集等;谢心军:实验指导;邝高艳:论文指导。
