非痴呆老年人脑白质高信号进展的危险因素分析
2021-10-29庄丽英乔松王俊俊赖其伦刘璐楼跃程琳莫晔嘉金煜
庄丽英,乔松,王俊俊,赖其伦,刘璐,楼跃,程琳,莫晔嘉,金煜
浙江医院神经内科,杭州 310013
脑白质高信号(white matter hyperintensities,WMHs)是指T2加权成像或液体衰减反转恢复序列(fluid-attenuated inversion recovery,FLAIR)的异常高信号,是脑小血管病的重要影像学特征之一[1-2]。随着人口的老龄化和影像学技术的发展,WMHs的发病率和诊断率逐年上升。WMHs在“健康人”中高发,且随着年龄的增长其患病率逐渐增高。基于社区的研究发现,≤55岁人群WMHs患病率低,随着年龄的增长WMHs患病率急剧上升[3],64岁左右老年人群为11%~21%,82岁左右老年人群则高达94%[4]。年龄和高血压是目前公认的WMHs的危险因素,高胆固醇血症、糖尿病、吸烟和心血管疾病等与WMHs相关,而WMHs与卒中、认知障碍和情感异常风险增加密切相关[5-8]。WMHs并非处于静态不变状态[9],其病因及发病机制尚未明确,动态随访WMHs体积的变化具有重要意义。本研究基于前瞻性队列研究的阿尔茨海默病神经影像学倡议(Alzheimer's Disease Neuroimaging Initiative,ADNI)-1队列探讨非痴呆老年人WMHs进展的危险因素。
1 资料与方法
1.1 研究对象及分组 筛选ADNI-1数据库(http://adni.loni.usc.edu)中完成基线及3年随访T2FLAIR扫描的非痴呆老年人263例。纳入标准:(1)年龄≥65岁;(2)简易精神状态检查量表(mini-mental state examination,MMSE)评分为24~30分,临床痴呆评定量表(clinical dementia rating,CDR)评分为0~0.5分;(3)认知正常或轻度认知障碍(存在记忆或认知损害,对日常生活能力无明显影响,未达到痴呆程度);(4)具备基线期和3年随访的T2FLAIR数据。排除标准:痴呆,符合美国国立神经病、语言交流障碍和卒中研究所/老年性痴呆及相关疾病学会(NINCDS/ADRDA)的诊断标准。根据3年随访时的WMHs较基线是否进展分为进展组与非进展组。若3年随访时的WMHs体积-基线WMHs体积≥所有差值的75%分位数,则定义为WMHs进展[10]。
1.2 方法
1.2.1 基线资料及基础病史收集 收集患者的基线资料(包括年龄、性别、身高、体重、教育年限等)、基础病史(包括高血压、糖尿病、冠心病、高胆固醇血症、房颤等)及目前吸烟等。其中年龄65~79岁为年轻老人,年龄≥80岁为老老年人。由身高和体重计算体重指数(body mass index,BMI),BMI≥30 kg/m2为肥胖。高血压指收缩压≥140 mmHg和(或)舒张压≥90 mmHg,目前服用降压药物或既往有高血压病史。糖尿病指空腹血糖≥7.0 mmol/L和(或)糖负荷后2 h血糖≥11.1 mmol/L,或既往有糖尿病史。冠心病指由于冠状动脉粥样硬化导致心肌缺血缺氧而引起的心脏病。高胆固醇血症指胆固醇>6.45 mmol/L和(或)三酰甘油>1.88 mmol/L,和(或)低密度脂蛋白胆固醇>3.12 mmol/L。房颤病史指心电图提示小f波、心律绝对不齐,或既往有房颤病史。目前吸烟指吸烟平均>1支/d,烟龄>3个月,未戒烟。
1.2.2 总体认知、记忆、执行功能评定 ADNI-1采用统一的量表进行认知测评。采用MMSE和阿尔茨海默病评定量表-认知分量表(Alzheimer's disease assessment scale-cognitive section,ADAS-Cog)评定总体认知功能,通过听觉词语学习测验(auditory verbal learning test,AVLT)和逻辑记忆测验(logical memory test,LMT)评定记忆功能,通过数字符号转换测验(digit symbol substitution test,DSST)、连线测验(trail making test,TMT)-B评定执行功能。
1.2.3 载脂蛋白E(apoE)基因型测定[11]apoE基因型数据来源于ADNI-1数据库,具体测定方法如下:利用Qiagen试剂盒从受试者外周血细胞样本中提取DNA。采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)法分别检测rs7412和rs429358等位基因,rs7412和rs429358的单倍型最终决定apoE基因型。apoEɛ4携带指携带有1个或2个ɛ4等位基因。
1.2.4 WMHs体积定量分析[12]所有扫描图像采用标准化流程进行预处理:T1、T2、PD和FLAIR图像互相配准,并人工去除所有扫描图像中的非脑组织。基于FLAIR扫描和人工输入半自动检测WMH体素,将每个体素的三种模态(PD、T1和T2)图像强度构建成一个向量,利用贝叶斯马尔可夫随机场(MRF)方法检测该向量是否符合白质高信号的特点,然后用二进制数标定每个体素是否属于白质高信号区域。
1.3 统计学处理 采用SPSS 17.0软件进行统计分析。计数资料以例(%)表示,组间比较采用χ2检验;符合正态分布的连续变量以表示,非正态分布的连续变量以M(Q1,Q3)表示,组间比较采用双样本t检验或非参数检验。相关性分析采用Pearson或Spearman相关检验。WMHs进展的危险因素分析采用logistic回归分析,检验水准α=0.05。P<0.05为差异有统计学意义。
2 结 果
2.1 两组一般资料及WMHs体积比较 共纳入非痴呆老年人263例,其中WMHs进展者66例,非进展者197例。两组性别,教育年限,apoEɛ4携带者比例,MMSE、ADAS-Cog、LMT延迟回忆、DSST评分,血管风险因素(BMI及高血压、糖尿病、高胆固醇血症、目前吸烟、房颤比例)比较,差异无统计学意义(P>0.05)。WMHs进展组年龄、冠心病比例、基线WMHs体积和3年随访时的WMHs体积明显高于非进展组,AVLT即刻记忆、TMT-B评分明显低于非进展组,差异有统计学意义(P<0.05)(表1)。
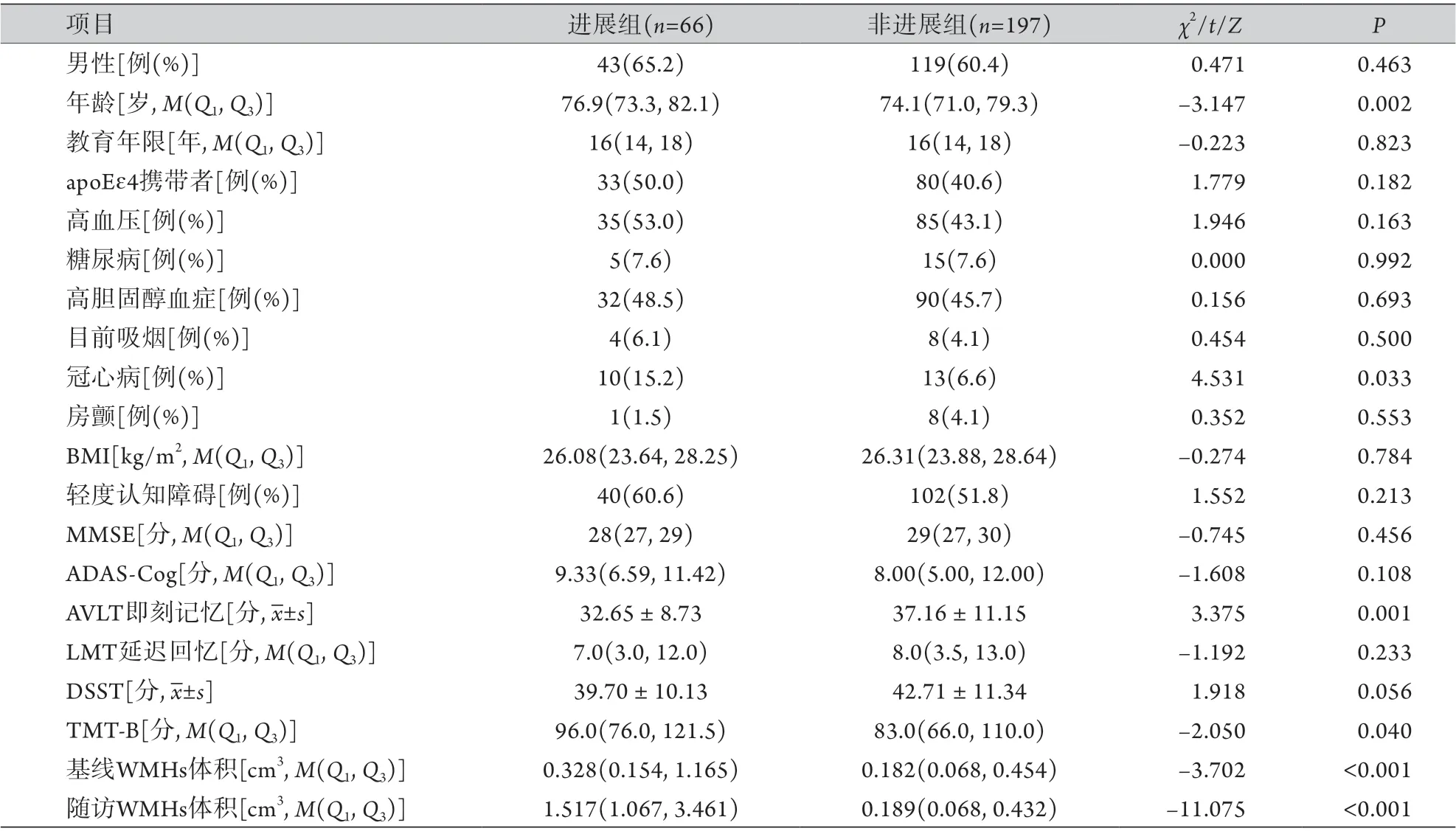
表1 WMHs进展组与非进展组一般资料及WMHs体积比较Tab.1 Comparison of general data and WMHs volumes between WMHs progressive group and non-progressive group
2.2 年龄与WMHs体积的相关性分析 年龄与WMHs体积呈非正态分布,采用Spearman相关检验分析显示,年龄与基线WMHs体积及3年随访时的WMHs体积均呈正相关(rs=0.273,P<0.001;rs=0.306,P<0.001)。
2.3 WMHs进展影响因素的单因素分析 各变量与WMHs进展的单因素logistic回归分析显示,年龄≥80岁和冠心病史是非痴呆老年人WMHs进展的危险因素(OR=2.243,95%CI 1.219~4.128,P=0.009;OR=2.527,95%CI 1.025~6.075,P=0.038,表2)。
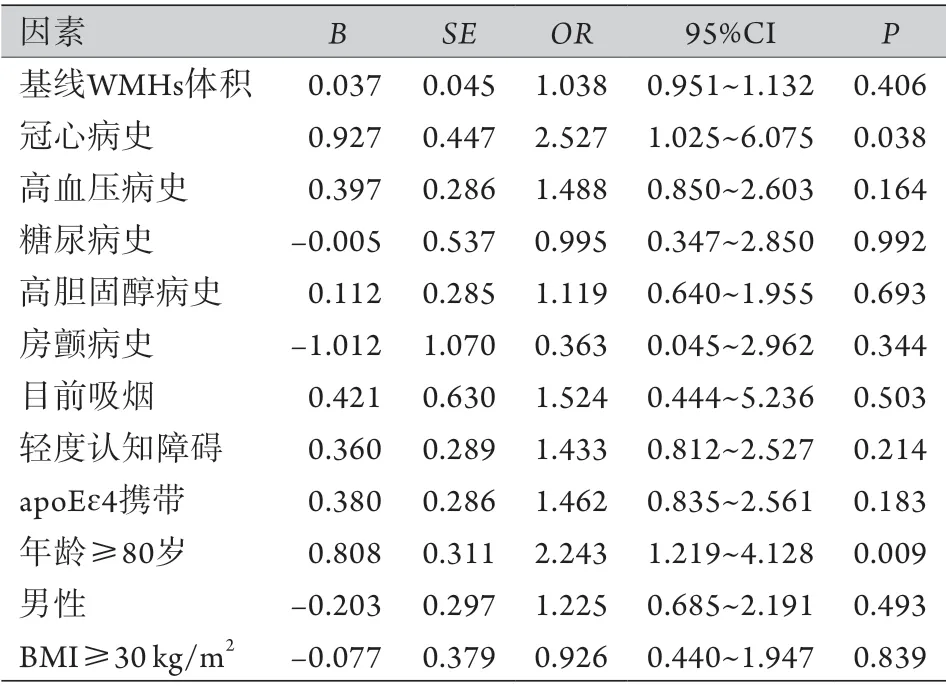
表2 WMHs进展影响因素的单因素logistic回归分析Tab.2 Univariate logistic regression analysis of risk factors for the WMHs progression
2.4 WMHs进展影响因素的多因素分析 以3年随访时WMHs是否进展(非进展为0,进展为1)为因变量,以单因素分析中P<0.2的因素为自变量,采用Wald前进法建立logistic回归模型,结果显示,年龄≥80岁和冠心病史是非痴呆老年人WMHs进展的独立危险因素(OR=2.257,95%CI 1.219~4.178,P=0.010;OR=2.556,95%CI 1.048~6.234,P=0.039,表3)。

表3 WMHs进展影响因素的多因素logistic回归分析Tab.3 Multivariate logistic regression analysis of risk factors for the WMHs progression
3 讨 论
ADNI是一个开放的多中心、跨学科纵向研究数据库,旨在开发用于阿尔茨海默病早期检测和跟踪的临床、影像、遗传和生化标志物。本研究基于ADNI-1队列,探索非痴呆老年人随访3年后WMHs进展的危险因素,纳入分析的因素包括年龄、血管风险因素、apoE基因型、教育年限、认知状态及基线WMHs体积等,发现WMHs进展组较非进展组年龄大、冠心病史比例高、WMHs体积大。单因素及多因素logistic回归分析显示,年龄≥80岁和冠心病史是非痴呆老年人WMHs进展的独立危险因素。
有半定量研究发现,WMHs患病率和严重程度均随年龄增长而增高[13]。国内学者基于半定量分析发现,年龄是预测WMHs进展的独立危险因素[14]。本研究采用定量分析发现,年龄与WMHs基线体积及3年后随访体积呈正相关。一项纳入2367名20~90岁普通人群的研究发现,年龄和高血压等心血管风险因素与WMHs体积密切相关[15]。Garnier-Crussard等[16]纳入137名无认知障碍的社区成人(50名<40岁,36名40~60岁,51名>60岁)进行研究,发现成人WMHs体积随着年龄增长而增加,且在年龄较大时增加幅度最大。本研究发现,年龄≥80岁是非痴呆老年人WMHs进展的独立危险因素,提示年龄增长特别是年龄≥80岁是WMHs进展最重要的危险因素之一。
心血管疾病在WMHs发病中发挥关键作用。本研究发现,冠心病史是非痴呆老年人WMHs进展的独立危险因素,提示心血管健康状况与脑小血管病变负担密切相关。Dickie等[17]分析73岁非痴呆老年人的多种血管危险因素与3年后WMHs体积进展的相关性,发现基线期收缩压和舒张压与3年后WMHs体积进展呈正相关,考虑可能是由于高血压破坏了脑微循环结构;该研究还发现收缩压和舒张压均与更大的WMHs体积有关,但校正年龄因素后则未发现相关性。本研究并未发现高血压与WMHs的相关性,可能与本研究样本量偏小及纳入了更多的老老年人有关。
研究发现,68岁左右的老年人基线WMHs体积与7年后WMHs进展密切相关[18]。Holmegaard等[19]基于缺血性卒中队列调查WMHs进展情况及其预测因素,发现基线WMHs体积是预测WMHs进展的独立危险因素。本研究并未发现基线WMHs体积是WMHs进展的预测因素,可能与随访年限较短及纳入人群年龄较大有关。
WMHs的病因和病理生理机制尚未完全阐明,有学者认为WMHs为血管源性的,可能与老化及血管危险因素相关的动脉硬化性微血管疾病有关[20]。Wardlaw等[21]基于881名社区老年人和257例非致残性卒中患者的队列研究发现,高血压等血管风险因素分别仅能解释1.4%~2.0%和0.1%的WMHs,提示WMHs存在非血管性或非动脉粥样硬化性病因。影像学研究显示,WMHs的病理学基础主要包括血脑屏障破坏所致的水肿、髓鞘丢失和炎症等[22]。Jiaerken等[9]近期研究发现,收缩的WMHs与恒定不变的WMHs具有相似的微观结构和代谢性质,而进展的WMHs则存在明显的白质微结构变化,提示WMHs的动态演变与白质微结构、代谢改变有关。van Leijsen等[23]也发现,白质微结构完整性受损在“正常”脑白质转化为WMHs前已存在,并且随着白质完整性的持续受损,WMHs逐渐进展。
综上所述,本研究结果表明,年龄≥80岁和冠心病史是非痴呆老年人WMHs进展的独立危险因素,该结果为控制心血管疾病以预防WMHs进展提供了依据。WMHs病因不明、病机不清,并不是“良性的”老化标志,积极寻找和管理危险因素至关重要。但本研究存在一些不足之处:仅纳入非痴呆老年人作为研究对象,样本量偏小,所得结论不适用于全老年人群,未来需扩大样本量纳入不同认知状态的老年人进行纵向随访研究;重点关注全脑WMHs的进展情况,未涉及不同脑区WMHs的分布,未来需对不同解剖部位WMHs的进展情况进行研究。
