下呼吸道肺炎链球菌感染的临床特征及耐药性分析
2021-10-29程琰高杰英顾江陈晶高鹏王佳钰佘梦瑶王缚鲲
程琰,高杰英,顾江,陈晶,高鹏,王佳钰,佘梦瑶,王缚鲲*
1解放军联勤保障部队第980医院基础医学实验室,石家庄 050081;2解放军联勤保障部队第980医院检验科,石家庄050081;3解放军陆军军医大学微生物与生化药学教研室,重庆 400038
肺炎链球菌(Streptococcus pneumoniae,SP)属于链球菌属,为革兰阳性球菌,多数不致病或致病力弱,少数致病力强[1]。荚膜作为肺炎链球菌致病的主要侵袭力,可抵抗宿主体内吞噬细胞的吞噬作用而大量繁殖。该病原菌主要黏附于健康人类鼻咽部上皮细胞及口腔上皮细胞,为条件致病菌[2]。当宿主免疫力低下、机械屏障损伤或生理结构损伤时,鼻咽部黏附的病原菌大量繁殖,侵入相应组织器官,引发宿主的炎症反应,从而导致大叶性肺炎、支气管炎、中耳炎、鼻窦炎,甚至导致脑膜炎和败血症[3]。肺炎链球菌引起的感染最常见的是肺炎,5岁以下儿童、65岁以上老年人以及长期患病者是易感人群。据世界卫生组织统计,全球每年约有160万人死于肺炎链球菌感染性疾病,其中一半以上为5岁以下儿童[4]。近年来,肺炎链球菌对大环内酯类和β-内酰胺类抗菌药物的耐药率有逐年升高的趋势,给临床治疗带来了困难[5]。对肺炎链球菌感染的临床特征、肺炎链球菌的耐药性以及耐药趋势进行分析,有助于临床了解关联因素并做出合理的临床诊断,对指导临床治疗具有重要意义。本研究回顾性分析了我院2014-2018年收治的下呼吸道肺炎链球菌感染患者的临床特征、成人及儿童肺炎链球菌对常用抗菌药物的耐药特征以及5年耐药趋势变化,旨在为指导临床合理用药提供参考。
1 资料与方法
1.1 一般资料 选取2014年1月1日-2018年12月31日解放军联勤保障部队第980医院收治的从合格呼吸道标本中分离出肺炎链球菌的934例下呼吸道肺炎链球菌感染患者,回顾性分析其临床资料以及肺炎链球菌的耐药性。剔除同一患者同一部位分离的重复菌株,相同患者连续分离菌株选取首次分离菌株。合格痰标本标准:白细胞≥25个/低倍镜视野,鳞状上皮细胞<10个/低倍镜视野。肺炎链球菌肺炎诊断标准:患者出现呼吸道感染的临床症状且胸部影像学检查显示肺部病变,呼吸道标本分离到肺炎链球菌。
1.2 仪器与试剂 全自动血液分析仪(希森美康,XN550)检测患者全血中白细胞计数;特定蛋白分析仪(BioSystems,A15)检测患者血清C反应蛋白水平;病原菌检测仪器为珠海美华医疗科技有限公司MA120细菌鉴定/药敏分析系统;哥伦比亚血平板购自郑州安图生物有限公司;质控菌株肺炎链球菌ATCC49619、金黄色葡萄球菌ATCC29213购自卫健委临床检验中心;革兰染液购自珠海贝索生物技术有限公司。奥普托欣纸片购自杭州天和公司,青霉素、美罗培南E-test药敏纸条购自郑州安图生物有限公司。
1.3 肺炎链球菌的分离、培养与鉴定 标本的采集与接种、肺炎链球菌的分离与培养按照《全国临床检验操作规程》[6]的方法进行。临床送检的呼吸道标本接种于哥伦比亚血平板,37 ℃、5% CO2条件下培养18~24 h。挑取草绿色溶血、脐窝状的可疑菌落,根据革兰染色后镜下形态、奥普托欣试验进行初步鉴定,奥普托欣试验阳性(抑菌圈直径>14 mm)的菌株进一步采用MA120微生物分析仪进行菌种鉴定。
1.4 药敏试验 采用MA120细菌鉴定/药敏分析系统对青霉素、阿莫西林/克拉维酸、头孢呋辛、头孢噻肟、头孢曲松、头孢吡肟、美罗培南、氯霉素、四环素、左氧氟沙星、复方新诺明、红霉素、阿奇霉素、克林霉素、利奈唑胺、万古霉素等16种抗菌药物进行最低抑菌浓度(MIC)测定。参照美国临床实验室标准化委员会(CLSI)2018年的标准进行药敏结果判定[7]。对于青霉素经仪器测定MIC≥2 μg/ml或者美罗培南经仪器测定MIC ≥0.5 μg/ml的菌株,采用E-test法复核。
1.5 统计学处理 采用WHONET 5.6进行耐药统计,应用SPSS 20.0软件进行数据分析。计量资料以表示;计数资料以例(%)表示,组间比较采用χ2检验;同一抗菌药物不同年份耐药率的比较采用χ2检验或者Fisher精确检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 934例中儿童728例,成人206例。728例儿童SP感染结果如表1所示。感染儿童年龄为1 d~14岁[(1.2±1.2)岁]。患儿疾病分布以肺炎为主,229例(31.46%)患儿合并其他病原体感染,以肺炎支原体(91例)、呼吸道合胞病毒(45例)、乙型流感病毒(45例)、副流感病毒(21例)和腺病毒(13例)多见。成人SP感染结果如表2所示,感染成人年龄为15~92岁[(61.6±19.6)岁]。206例成人中,149例患有基础疾病,占72.33%,其中合并两种及以上基础疾病者14例(6.80%)。
2.2 炎性反应指标 728例患儿中,545例(74.86%)出现白细胞计数增高,620例(85.16%)出现C反应蛋白增高(表1)。SP感染的成人中,160例(77.67%)白细胞计数增高,173例(83.98%)C反应蛋白增高(表2)。
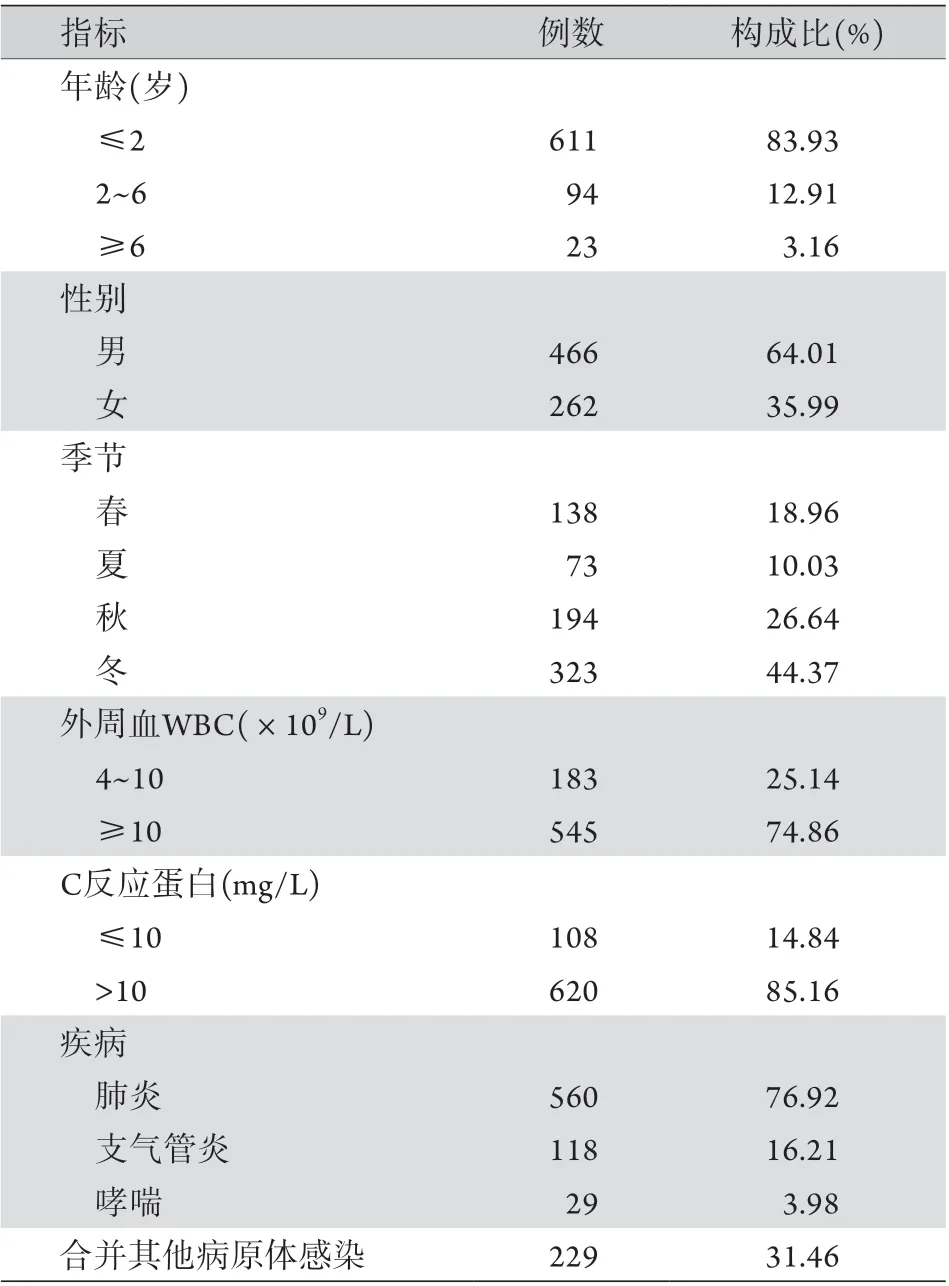
表1 儿童肺炎链球菌感染的临床特征分析Tab.1 Clinical characteristics of children with Streptococcus pneumoniae infection
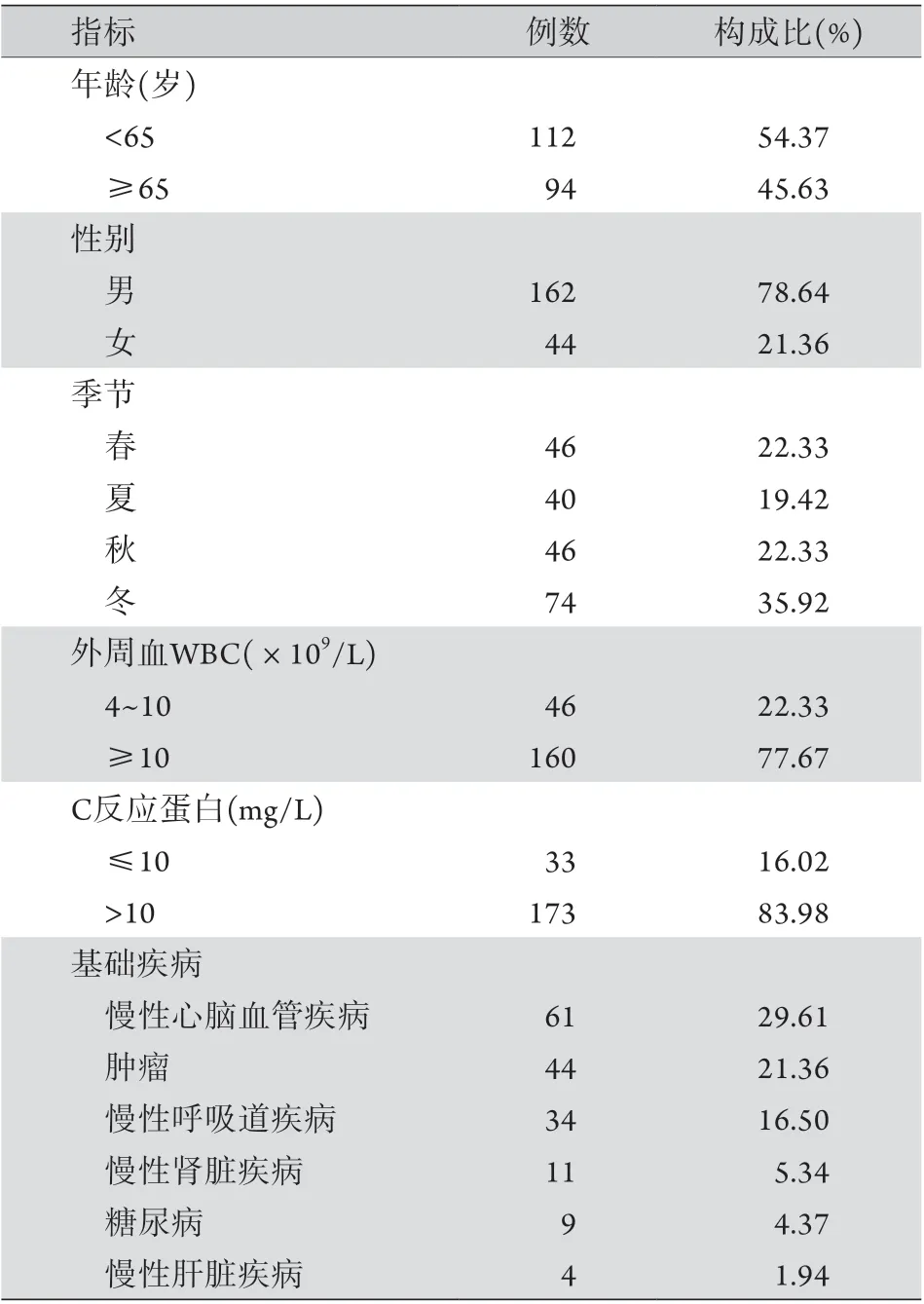
表2 成人肺炎链球菌感染的临床特征分析Tab.2 Clinical characteristics of adults with Streptococcus pneumoniae infection
2.3 菌株的季节分布 728株儿童分离菌株的季节分布为:冬季323株(44.37%),秋季194株(26.64%),春季138株(18.96%),夏季73株(10.03%)。206株成人分离菌株的季节分布为:冬季74株(35.92%),秋季46株(22.33%),春季46株(22.33%),夏季40株(19.42%)。
2.4 分离菌株科室分布 5年来,临床分离的肺炎链球菌主要来源于儿科,占77.94%;成人分离菌株占22.06%,其科室分布未见明显临床意义(表3)。
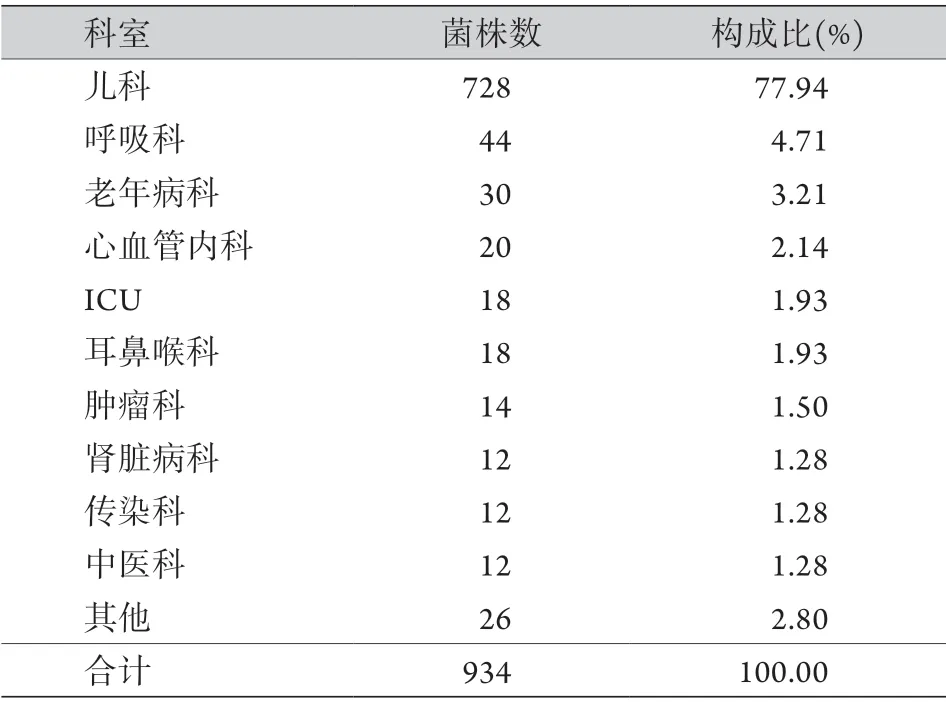
表3 肺炎链球菌的科室分布Tab.3 Clinical distribution of Streptococcus pneumoniae strains
2.5 肺炎链球菌耐药性
2.5.1 儿童肺炎链球菌耐药率变化 2014-2018年无美罗培南、万古霉素、利奈唑胺耐药菌株出现。2014-2016年无阿莫西林/克拉维酸耐药菌株出现,从2017年开始出现阿莫西林/克拉维酸耐药菌株,5年平均耐药率为1.65%。5年间,儿童肺炎链球菌对青霉素、左氧氟沙星保持高度敏感,平均耐药率<1%;对头孢噻肟、头孢曲松、头孢吡肟的耐药率有所波动,但均<5%;对复方新诺明、头孢呋辛、四环素、红霉素、阿奇霉素、克林霉素呈现高耐药率,平均耐药率分别为47.53%、57.42%、82.14%、93.13%、92.31%、87.50%(表4)。2014-2018年5年间各年份儿童肺炎链球菌对不同药物耐药率的变化如图1所示。
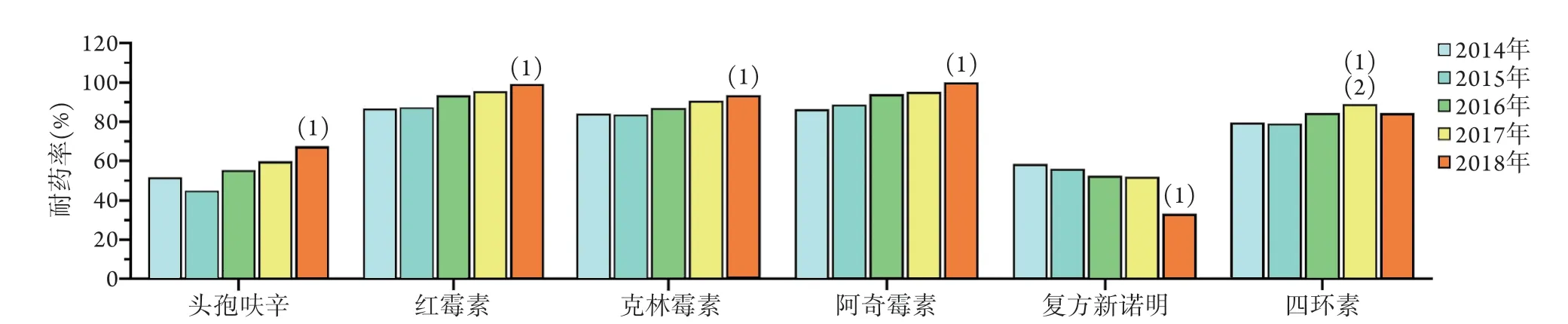
图1 2014-2018年728株儿童肺炎链球菌对抗菌药物的耐药率变化Fig.1 Drug resistance rates of 728 S.pneumoniae strains isolated from children during 2014-2018
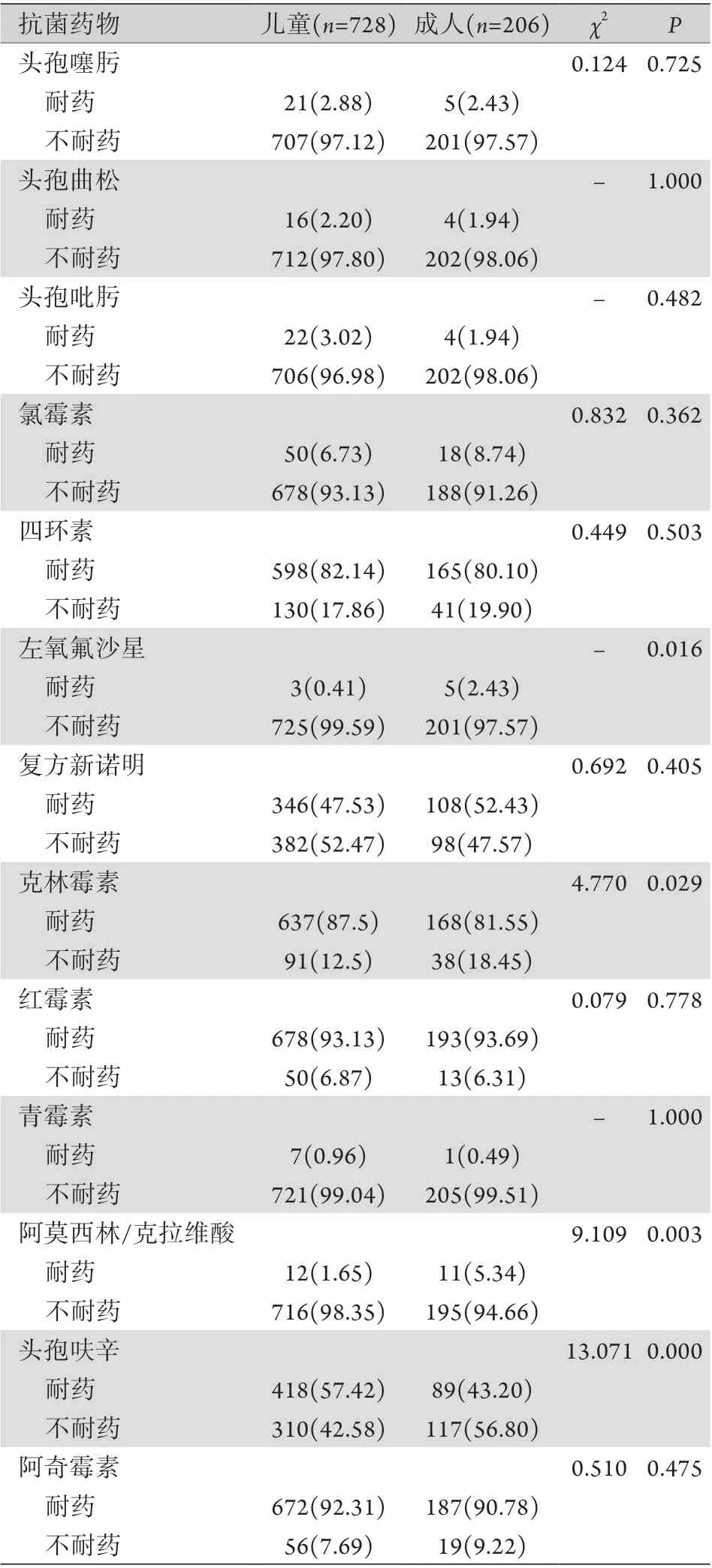
表4 2014-2018年成人与儿童肺炎链球菌对抗菌药物的耐药情况[例(%)]Tab.4 Drug resistance of S.pneumoniae strains isolated from children and adults during 2014-2018 [n(%)]
2.5.2 成人肺炎链球菌耐药率变化 2014-2018年无美罗培南、万古霉素、利奈唑胺耐药菌株出现。5年间,仅在2017年检出1株青霉素耐药菌株,青霉素的平均耐药率为0.49%;对头孢噻肟、头孢曲松、头孢吡肟、阿莫西林/克拉维酸、左氧氟沙星保持高度敏感,平均耐药率分别为2.43%、1.94%、1.94%、5.34%、2.43%;对头孢呋辛、四环素、红霉素、阿奇霉素、克林霉素均保持高耐药率,平均耐药率分别为43.20%、80.10%、93.69%、90.78%、81.55%(表4)。2014-2018年5年间各年份成人肺炎链球菌对不同药物耐药率的变化如图2所示。
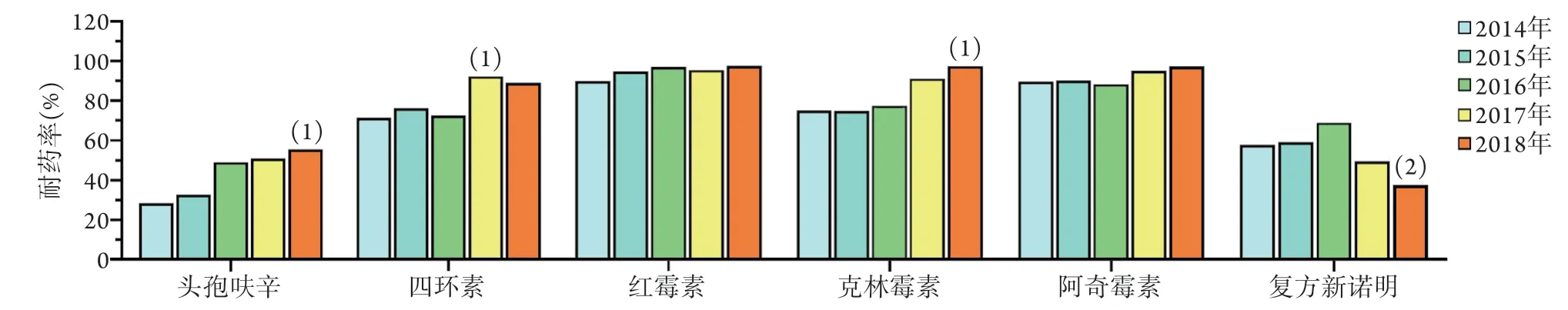
图2 2014-2018年206株成人肺炎链球菌对抗菌药物的耐药率变化Fig.2 Drug resistance rates of 206 S.pneumoniae strains isolated from adult during 2014-2018
2.5.3 儿童与成人肺炎链球菌平均耐药率比较儿童与成人分离菌株对美罗培南、利奈唑胺、万古霉素均敏感,5年间无耐药菌株出现。儿童与成人分离菌株对阿莫西林/克拉维酸、左氧氟沙星、克林霉素、头孢呋辛等的耐药率差异有统计学意义(P<0.05),其中,儿童分离菌株对头孢呋辛的耐药率为57.42%,显著高于成人分离菌株的耐药率43.20%(P<0.05)。儿童和成人分离菌株对其余抗菌药物的耐药情况基本一致,耐药率差异无统计学意义(表4)。
3 讨 论
1881年,肺炎球菌首次由Pasteur及Sternberg分别在法国和美国从患者痰液中分离获得,1974年正式命名为肺炎链球菌[8]。该病原菌可通过呼吸道飞沫传播,是引起成人和儿童社区获得性肺炎(community-acquired pneumonia,CAP)的重要致病菌,也是导致急性呼吸道疾病的重要病原菌之一。荚膜多糖是肺炎链球菌致病的重要毒力因子,有研究表明,与其他病原菌相比,肺炎链球菌因其侵袭性高更容易造成儿童和老年人死亡[9]。2岁以下儿童是肺炎链球菌的易感人群[10],与该年龄阶段儿童鼻咽部肺炎链球菌携带率高有关。此外,该年龄阶段的儿童处于生理性免疫功能低下期,自身免疫系统尚未发育成熟,对病原菌的抵抗力差,因此增加了易感性。本研究年限内,934株肺炎链球菌中儿童分离株共728株,占77.94%,其中2岁及以下儿童分离株超过50%(83.93%),与国内其他临床报道结果相似[11]。本研究结果显示,31.36%的患儿合并其他病原体感染,其中138例(18.96%)患儿合并呼吸道病毒感染。上呼吸道病毒感染后,机体产生的细胞因子会上调呼吸道上皮的黏附因子,使肺炎链球菌通过表面黏附分子(PsaA、PspA、PspC、肺炎链球菌溶血素等)增加黏附,肺炎链球菌的肽聚糖、磷壁酸等成分可介导黏附和炎症,最终导致感染。因此,肺炎链球菌是呼吸道病毒感染后继发细菌感染的常见病原菌。
研究表明,成人肺炎链球菌感染的易感人群和危险因素包括年龄大于65岁、合并慢性疾病(慢性呼吸道疾病、慢性心脏病、糖尿病、慢性肝病和肝硬化、慢性肾衰竭等)、免疫功能受损(HIV感染、恶性肿瘤、骨髓移植受者等)、医源性因素(气管插管、气管切开、呼吸机应用等)[12-15]。本研究年限内,成人分离菌株占22.06%,患者多具有肺炎链球菌感染的临床危险因素。65岁以上成人分离菌株超过50%(54.37%),79.12%的成人感染患者合并慢性疾病或免疫功能受损。
本研究结果显示,在季节分布上,儿童肺炎链球菌的分离率以冬季最高,其次为秋季和春季,夏季最低,这与国内外研究结果一致[16-17];成人肺炎链球菌的分离率以冬季最高,但是秋季、春季、夏季的分离率差异无统计学意义。该结果提示,肺炎链球菌肺炎发病率随季节变化而变化,寒冷季节比温暖季节高发。从临床特征看,无论成人还是儿童患者均以男性居多,提示肺炎链球菌感染男性比女性高发。
青霉素廉价且对肺炎链球菌具有强大的杀菌活性,这使得肠外应用青霉素成为治疗肺炎链球菌感染的理想选择。然而,在20世纪60年代,耐青霉素的肺炎链球菌(penicillin resistantStreptococcus pneumoniae,PRSP)被发现,其对青霉素等β-内酰胺类抗菌药物耐药的分子机制主要是细菌青霉素结合蛋白(penicillin binding protein,PBP)基因突变,导致细胞壁上青霉素结合蛋白的结构发生改变,从而降低了抗菌药物对肺炎链球菌的结合能力。近年来,国内有报道显示肺炎链球菌对青霉素的耐药性有不断上升的趋势[11],而本院2014-2018年儿童分离菌株的耐药率在0~2.01%之间波动,成人分离菌株的耐药率在0~1.96%之间波动,均处于较低水平,低于全国CHINET 2014-2018年的耐药数据[18-21],提示PRSP的分离率具有地区差异,尽管本院分离菌株对青霉素敏感率高,但在耐药形势下,仍需警惕肺炎链球菌对青霉素的耐药问题。
2018年,国内专家推荐除青霉素外,头孢呋辛、阿莫西林/克拉维酸钾可用于青霉素敏感的肺炎链球菌肺炎的治疗,头孢曲松、头孢噻肟、万古霉素可用于青霉素耐药的肺炎链球菌肺炎的治疗[22]。本院5年耐药数据显示,成人和儿童分离菌株对头孢呋辛的耐药率均呈上升趋势;儿童分离菌株的平均耐药率高于成人分离菌株;成人和儿童分离菌株对头孢呋辛的平均耐药率均明显高于青霉素,差异有统计学意义(P<0.05)。临床抗感染治疗中,在没有获得明确病原学诊断前,只能结合患者的病情以及辅助检查结果进行经验治疗,本院的耐药数据提示,在治疗肺炎链球菌感染中头孢呋辛并不优于青霉素,经验性用药需谨慎。头孢呋辛在儿童中的使用频率较高,这可能是儿童分离菌株对头孢呋辛耐药率高于成人分离菌株的原因。成人和儿童分离菌株对阿莫西林/克拉维酸钾的平均耐药率分别为5.34%和1.65%,表明阿莫西林/克拉维酸钾对肺炎链球菌具有良好的敏感性,可用于轻症肺炎链球菌肺炎的经验治疗以及轻症、重症肺炎链球菌肺炎的目标治疗。本院5年监测结果显示,无万古霉素耐药菌株出现;头孢曲松和头孢噻肟对儿童和成人分离菌株均保持较好的敏感性,但均有耐药菌株出现,平均耐药率均<3%。这一结果提示,由于肺炎链球菌可能对头孢曲松或头孢噻肟耐药,在初始经验治疗疑似肺炎链球菌导致的极重症肺炎时,应考虑头孢曲松或头孢噻肟联合万古霉素的联合治疗方案。
20世纪60年代PRSP被发现时,肺炎链球菌对大环内酯类抗菌药物的耐药非常罕见,因此该类抗菌药物曾被用于治疗肺炎链球菌导致的感染,但随着大环内酯类抗菌药物的广泛应用以及耐药菌株的克隆传播,肺炎链球菌对该类抗菌药物的耐药率迅速增高。欧美国家肺炎链球菌对红霉素和阿奇霉素的耐药率分别为12.9%~39%和4.3%~33.3%[23]。而我国的耐药率有别于欧美国家。2003-2005年成人CAP调查结果显示我国肺炎链球菌对大环内酯类抗菌药物的耐药率为63.2%~75.4%。2014-2018年CHINET数据显示,肺炎链球菌对大环内酯类抗菌药物的耐药率进一步提高,对红霉素的耐药率超过90%[18-21]。本监测数据显示,儿童分离菌株对红霉素、阿奇霉素的耐药率高并且呈上升趋势,儿童和成人分离菌株5年平均耐药率均超过90%,与全国数据一致,提示在本地区红霉素、阿奇霉素已不是治疗肺炎链球菌感染的有效药物,不建议用于经验性抗感染治疗。本监测结果显示,肺炎链球菌对克林霉素的药敏结果与红霉素类似,亦不考虑临床应用。肺炎链球菌对红霉素的耐药主要与erm基因介导的核糖体甲基化修饰相关,而对四环素耐药是由tetM基因编码的核糖体保护蛋白介导的,tetM基因常常携带包含于ermB基因内的转座子[23-24],因此,对大环内酯类抗菌药物耐药的菌株可能对四环素也具有高耐药率,本研究数据显示成人和儿童分离菌株对四环素的平均耐药率均超过80%,与此观点一致。鉴于肺炎链球菌对四环素的高耐药率,中国指南和欧洲指南均不推荐将四环素作为肺炎链球菌肺炎经验性抗感染治疗用药[25-26]。
由于肺炎链球菌对大环内酯类抗菌药物具有高耐药率,而喹诺酮类抗菌药物因其抗菌谱广、较强的呼吸道组织穿透力和较高的组织浓度,且近年来耐药发生率低,因此IDSA/ATS成人CAP指南[25]以及专家共识[27-28]等均推荐呼吸喹诺酮类(左氧氟沙星、莫西沙星、吉米沙星)可作为治疗CAP的首选药物。本院5年监测结果显示,左氧氟沙星对成人分离菌株保持良好的敏感性,提示喹诺酮类抗菌药物可用于治疗肺炎链球菌导致的成人CAP。儿童肺炎链球菌分离菌株尽管对喹诺酮类抗菌药物保持高敏感性,但此类药物会影响骨骼成长,儿童不宜使用。
综上所述,儿童和成人肺炎链球菌感染均以冬季发病率最高,且急性期炎性反应较明显;儿童肺炎链球菌感染以<5岁儿童为主,而年龄>65岁、患有基础性疾病是成人肺炎链球菌感染的危险因素;本院分离的肺炎链球菌对青霉素保持高敏感性,可作为临床治疗的首选药物;头孢呋辛耐药率高并呈上升趋势,经验性抗感染治疗时选择需慎重;头孢曲松和头孢噻肟耐药率低,可用于治疗青霉素不敏感肺炎链球菌感染或重症感染;大环内酯类抗菌药物耐药率极高,已不适合用于CAP患者的经验治疗。面对肺炎链球菌日益严重的耐药问题,临床微生物实验室应重视细菌耐药监测工作,每年为临床提供病原菌耐药数据。临床医师在初始经验性抗感染治疗时,选择治疗方案需结合临床特征、细菌耐药特征、本地区抗菌药物耐药率及耐药趋势,而后根据药敏结果合理选择有效抗菌药物进行目标治疗,尽可能减少细菌耐药的发生。
