circ_0081664通过靶向miR-1205调控非小细胞肺癌细胞的生长和转移
2021-10-29肖雪飞赵四林王伟符艳
肖雪飞 赵四林 王伟 符艳
非小细胞肺癌具有高转移潜力,导致临床预后不良,近年来,非小细胞肺癌的治疗取得了重要进展,但在转移性疾病其总体治愈率和生存率仍然很低[1-2]。研究表明circRNA与非小细胞肺癌的发生、发展和转移具有密切关系,有望成为一种理想的生物标志物,用于非小细胞肺癌的早期诊断,并提供新的治疗靶点和预后监测点[3]。研究报道circ_0081664在肺癌顺铂耐药细胞株中,显著上调[4]。然而circ_0081664对非小细胞肺癌细胞的生长和转移的影响及机制尚不清楚。研究报道miR-1205在非小细胞肺癌中起肿瘤抑制作用,可以抑制裸鼠中A549移植瘤的生长[5]。miR-1205在人喉鳞状细胞癌组织中被下调,miR-1205过表达减弱了人喉鳞状细胞癌细胞的迁移,生长和侵袭[6]。因此,本实验旨在研究circ_0081664对非小细胞肺癌细胞的生长和转移的影响及其机制,是否与miR-1205有关。
资料与方法
一、组织材料
选取2016年1月至2020年5月期间本院收治的30例非小细胞肺癌患者,通过手术取其癌组织及相应的癌旁组织,取出标本后立即置于液氮中,而后置于-80℃冰箱中保存;入选患者未经过放化疗,所有患者均知情且同意。
二、主要试剂
A549细胞(货号:HZ-H122,上海沪震实业有限公司);RPMI-1640培养基(货号:GNM-31800,上海经科化学科技有限公司);荧光定量PCR试剂盒(货号:218073,上海研卉生物科技有限公司);MTT试剂盒(货号:GOY-9134,上海谷研实业有限公司);凋亡检测试剂盒(货号:FXP018,北京四正柏生物科技有限公司);Transwell小室、Matrigel(货号:354483、354277,美国Corning公司);RIPA蛋白裂解液(货号:00000190,上海北诺生物科技有限公司);双荧光素酶报告基因检测试剂盒(货号:12535,上海宇劲生物技术有限公司)。si-NC、si-circ_0081664、pcDNA-NC、pcDNA-circ_0081664、miR-NC、miR-1205(百奥迈科生物技术有限公司)。Ki-67、Bcl2、MMP-2、MMP-9、P21、Bax抗体(深圳市豪地华拓生物科技有限公司)。
三、细胞分组
A549细胞用RPMI-1640培养基常规培养,将si-NC、si-circ_0081664、pcDNA-NC、pcDNA-circ_0081664、miR-NC、miR-1205分别转染至A549细胞中,记为si-NC组、si-circ_0081664组、pcDNA-NC组、pcDNA-circ_0081664组、miR-NC组、miR-1205组;将si-circ_0081664分别与anti-miR-NC、anti-miR-1205共转染至A549细胞中,记为si-circ_0081664+anti-miR-NC组、si-circ_0081664+anti-miR-1205组。
四、实时荧光定量PCR(RT-qPCR)检测circ_0081664和miR-1205的表达水平
取适量组织及各组细胞,提取其总RNA,合成cDNA后进行荧光定量PCR,反应条件为95℃ 3 min,95℃ 15 s,60℃ 30 s,72℃ 30 s,共40个循环;circ_0081664和miR-1205分别以GAPDH和U6为内参,用2-△△Ct法计算其相对表达量。circ_0081664上游引物序列:5′-AGTCTGGACCTGTCAGGATTG-3′,下游引物序列:5′-ACTGGCACAAGGCAGTAACA-3′;GAPDH上游引物序列:5′-TGTTGCCATCAATCACCCCTT-3′,下游引物序列:5′-CTCCACGACGTACTCAGCG-3′;miR-1205上游引物序列:5′-CCCTCTGCAGGGTTTGCTTTGAG-3′,下游引物序列:5′-CAGTGCGTGTCGTGGAGT-3′;U6上游引物序列:5′-CGCTTCGGCAGCACATATACTA-3′,下游引物序列:5′-CGCTTCACGAATTTGCGTGTCA-3′;引物由上海生工生物工程公司合成。
五、 MTT实验
在各组细胞培养至24 h时,每孔分别加入5 mg/mL的MTT溶液20 μL,于培养箱中继续孵育4 h后弃去上清液,每孔加入DMSO 150 μL,振荡反应10 min使沉淀溶解,用酶标仪于波长490 nm处检测吸光度(OD490 nm)值。
六、流式细胞术检测细胞凋亡
取转染24 h后生长状态良好的细胞,吸弃上清液,PBS漂洗细胞2次,加入结合缓冲液重悬,分别加Annexin V-FITC和PI各5 μL,轻摇混匀,再加入结合缓冲液350 μL,混匀,常温避光孵育15 min,流式细胞仪检测。
七、Transwell小室实验
迁移实验:将细胞用无血清培养基以5×105细胞/mL的密度悬浮,将100 μL悬浮液添加到Transwell小室上室,在培养箱培养48 h,用棉签除去膜顶表面上未迁移的细胞;然后用甲醇固定30 min,PBS洗涤细胞后再用1%的结晶紫染色30 min,用PBS轻轻清洗两次,风干后用倒置显微镜拍摄并计数细胞。侵袭实验用Matrigel覆盖Transwell小室上室,其余步骤与迁移实验相同。
八、Western blot实验
提取细胞总蛋白,通过电泳分离蛋白,转至聚偏二氟乙烯膜,封闭液封闭后加入Ki-67、Bcl2、MMP-2、MMP-9、P21、Bax一抗(1 ∶800),4℃孵育过夜,加入二抗(1 ∶1200)室温孵育2 h,用ECL发光液显影,成像后检测蛋白条带的灰度值,以β-actin为内参,蛋白相对表达水平为目的条带和β-actin条带灰度值的比值。
九、双荧光素酶报告实验
使用在线软件Starbase预测circ_0081664和miR-1205的靶向结合位点。使用PCR扩增,包含miR-1205结合位点的circ_0081664序列片段(上游引物:5′-AAAGTCGACACTTCCTGCAGT-3′,下游引物5′-CCCGTCGACACTGGCACAAGGCAGTAACA-3′),并构建至pmir-GLO luciferase载体中,获得circ_0081664野生型载体(WT-circ_0081664),将circ_0081664序列 UGCAAAAG突变为GUACCG,获得circ_0081664突变型载体(MUT-circ_0081664),将WT-circ_0081664、MUT-circ_0081664分别与miR-NC、miR-1205共转染至A549细胞中,转染48 h后,检测荧光素酶活性。
十、统计学分析
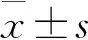
结 果
一、 circ_0081664和miR-1205在组织中的表达
与癌旁组织比较,肺癌组织中circ_0081664表达水平升高,miR-1205表达水平降低(P<0.05)(见表1)。
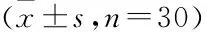
表1 circ_0081664和miR-1205在组织中的表达
二、抑制circ_0081664表达对A549细胞增殖、凋亡及迁移侵袭的影响
与si-NC组比较,si-circ_0081664组A549细胞活性降低,Ki-67、Bcl2、MMP-2、MMP-9表达水平降低,P21、Bax表达水平升高,细胞凋亡率升高,迁移侵袭细胞数减少(P<0.05)(见表2,图1、2)。

图1 抑制circ_0081664表达对A549细胞增殖、凋亡及迁移侵袭相关蛋白表达的影响A:增殖相关蛋白表达;B:凋亡相关蛋白表达;C:迁移、侵袭相关蛋白表达

图2 抑制circ_0081664表达对A549细胞凋亡及迁移侵袭的影响A:凋亡图;B:迁移、侵袭图(结晶紫染色, ×200)

表2 抑制circ_0081664表达对A549细胞增殖、凋亡及迁移侵袭的影响
三、 circ_0081664靶向调控miR-1205的表达
Starbase预测显示circ_0081664的序列中含有与miR-1205互补的核苷酸序列(图3)。WT-circ_0081664与miR-1205共转染后细胞荧光素酶活性降低(P<0.05),MUT-circ_0081664与miR-1205共转染后细胞荧光素酶活性无显著变化(见表3)。与pcDNA-NC组比较,pcDNA-circ_0081664组miR-1205表达水平降低;与si-NC组比较,si-circ_0081664组miR-1205表达水平升高(P<0.05)(见表4)。

表3 双荧光素酶报告实验

图3 circ_0081664的序列中含有与miR-1205互补的核苷酸序列

表4 circ_0081664靶向调控miR-1205的表达
四、过表达miR-1205对A549细胞增殖、凋亡及迁移侵袭的影响
与miR-NC组比较,miR-1205组A549细胞活性降低,Ki-67、Bcl2、MMP-2、MMP-9表达水平降低,P21、Bax表达水平升高,细胞凋亡率升高,迁移侵袭细胞数减少(P<0.05)(见表5,图4-5)。

表5 过表达miR-1205对A549细胞增殖、凋亡及迁移侵袭的影响
五、干扰miR-1205表达逆转抑制circ_0081664表达对A549细胞增殖、凋亡及迁移侵袭的影响
与si-circ_0081664+anti-miR-NC组比较,si-circ_0081664+anti-miR-1205组A549细胞活性升高,Ki-67、Bcl2、MMP-2、MMP-9表达水平升高,P21、Bax表达水平降低,细胞凋亡率降低,迁移侵袭细胞数增加(P<0.05)(见表6,图6、7)。

表6 干扰miR-1205表达逆转抑制circ_0081664表达对A549细胞增殖、凋亡及迁移侵袭的影响
讨 论
非小细胞肺癌是肺癌的主要发病类型,随着分子靶向药物治疗进展,使得非小细胞肺癌的治疗方案更加个体化,精确化[7-8]。circRNA在肺癌的发生,转移和预后中起关键作用,可以作为潜在的肿瘤诊断和预后的生物标志物[9]。研究报道circPTK2过表达抑制非小细胞肺癌细胞上皮-间质转化和转移[10]。抑制circRNA 100146可抑制非小细胞肺癌细胞的增殖和侵袭并促进细胞凋亡[11]。敲除circZFR可以显著抑制体外培养的非小细胞肺癌细胞的增殖,迁移和侵袭[12]。circ_0081664来源于LRWD1的一种环状RNA,位于chr7:102107785-102109101;已有研究表明circ_0081664在肺癌顺铂耐药细胞株中显著上调[4]。本实验结果显示,肺癌组织中circ_0081664表达水平升高,提示circ_0081664可能在肺癌中起促癌作用;转染circ_0081664抑制表达载体后,A549细胞的活性降低,Ki-67、Bcl2、MMP-2、MMP-9表达水平降低,P21、Bax表达水平升高,细胞凋亡率升高,迁移侵袭细胞数减少;表明抑制circ_0081664表达可抑制A549细胞增殖、迁移侵袭,且促进细胞凋亡。
miR-1205是一种miRNA,位于chr8:(127960633-127960695),研究表明miR-1205可促进肺腺癌及前列腺癌细胞生长[13-14]。本实验结果显示,肺癌组织中miR-1205表达水平降低,提示miR-1205可能在肺癌中起抑癌作用。miR-1205过表达后A549细胞活性降低,Ki-67、Bcl2、MMP-2、MMP-9表达水平降低,P21、Bax表达水平升高,细胞凋亡率升高,迁移侵袭细胞数减少;表明miR-1205过表达可抑制A549细胞增殖、迁移侵袭,且促进细胞凋亡。此外,研究报道circRNA可通过调控miRNA影响肿瘤的进展,如circ_0039411通过miR-1205 / MTA1通路促进甲状腺乳头状癌细胞的生长,迁移和侵袭[15]。circ_0034642通过调节miR-1205/S100A8轴促进胶质瘤细胞增殖,迁移和侵袭能力并抑制细胞凋亡[16]。circ_0002052过表达,通过调节miR-1205/APC2轴显著抑制骨肉瘤细胞的增殖,迁移和侵袭,同时促进了细胞凋亡[17]。此外,本实验还发现circ_0081664靶向调控miR-1205,同时抑制circ_0081664和miR-1205表达后,细胞活性升高,细胞凋亡率降低,迁移侵袭细胞数增加;表明miR-1205可影响circ_0081664对肺癌细胞增殖、迁移侵袭和凋亡的影响。
综上所述,抑制circ_0081664表达可能通过上调miR-1205抑制非小细胞肺癌细胞的生长和转移。
