气管植入间充质干细胞联合部分液体通气对海水淹溺致肺损伤大鼠治疗作用的研究
2021-10-29张春阳李亮张宁坤
张春阳 李亮 张宁坤
海水淹溺可导致肺组织损伤,严重者出现急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),死亡率高。传统的治疗方法,如常规机械通气、高压氧等,不能有效的促进局部损伤细胞修复、阻止ARDS的病理进程,未从根本上解决肺泡/毛细血管膜受损的问题[1-2]。有研究发现,部分液体通气可减轻ARDS所导致的肺泡萎陷,同时作为液体通气的介质-全氟化碳(perfluorocarbon,PFC)具有降低炎症反应的作用[3]。而间充质干细胞(mesenchymal stem cells,MSCs)具有修复损伤、自动归巢、免疫调节的作用,有可能针对肺泡/毛细血管膜受损,减轻海水淹溺导致的肺损伤[2]。目前国内外尚无将两者联合,用于海水淹溺导致的肺损伤及急性呼吸窘迫综合征治疗的研究报道。因此,本研究拟通过气管内植入脐带来源的间充质干细胞联合部分液体通气,观察对海水淹溺致大鼠肺损伤的治疗效果,以探索新的救治手段。
资料与方法
一、主要试剂及材料
DMEM/F12(dulbecco’s modified Eagle’s medium/F12)培养基(美国Hyclone公司);胰蛋白酶(Trypsin)(美 国Invitrogen公司);胎牛血清(fetal bovine serum,FBS)(美国 Gibco 公司);全氟化碳(上海捷视医疗设备有限公司);CM-Dil 细胞标记液(Molecular Probes,C7000);肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白介素-1β(Interleukin-1β, IL-1β)、白介素-6(Interleukin-6, IL-6)、白介素-10(Interleukin-10, IL-10)ELISA试剂盒(天津安诺瑞康生物技术有限公司,中国)。配置海水 参考前期研究[4],采用海水配方,海水成分:NaCl 26.518 g/L, MgCl22.447 g/L, MgSO43.305 g/L, CaCl21.141g/L, KCl 0.725 g/L,NaHCO30.202 g/L, NaBr 0.083 g/L, 渗透压浓度 1250~1350 mmol/L, PH 8.2, 比重 1.05~1.06。SPF级健康雌性SD大鼠(北京科宇动物养殖中心),鼠龄(2.5±0.5)月,体重(300±30)g,许可证号:SCXK(京)2018-0010。
二、方法
1. 间充质干细胞分离、培养、传代及荧光标记: 经伦理委员会批准(NO.HZKY-PJ-2015-1),签订知情同意书后,无菌条件下留取脐带组织。参考既往研究[5],采用组织块贴壁法,分离、培养脐带华通胶间充质干细胞,已对其分化及免疫表型进行检测,符合MSCs标准。取长势良好的第 3 代MSCs, 经0.25% 胰蛋白酶消化, PBS 洗涤离心后,弃上清,用空白细胞培养液制成1×106/mL的细胞悬液; 每毫升细胞悬液加5μl 的 CM-Dil 细胞标记液,轻柔地吹打混匀; 37 ℃孵育5 min或更短的时间,然后于4 ℃再孵育15 min。离心 5 min; 弃上清,DMEM重悬细胞沉淀; 再次孵育离心,重复2次,继续培养;观察标记情况。
2. 实验动物分组: 将大鼠分为5组:CONTROL组(C组)、MODEL组(M组)、REGULAR组(R组)、PFC组(P组)和PFC+MSC组(PM组),每组6只大鼠。
3. 构建模型:大鼠给予腹腔注射10%水合氯醛(0.35mL/100mg)麻醉,固定于鼠板,组织剪暴露颈部肌肉,钝性分离,暴露气管,并分离右侧颈动脉置管,供留取血气分析使用。气管切开后,使用1mL注射器,连接改良自腰椎穿刺麻醉用软导管,插入大鼠气道内1.5cm左右,缓慢注射配方海水(4mL/kg),时间约15 min,之后予以经气管切开处气管插管,连接呼吸机。于颈动脉留置动脉导管,于1h、3h抽取动脉血气分析。除C组外,其余各组给予气管切开后注入4 mL/kg海水。
4. 常规机械通气及部分液体通气: 除C和M组外,其余各组予以气管插管,R组给予常规机械通气,P组给予部分液体通气(参照研究[6],按2 mL/kg气管内注入PFC),PM组给予气管内植入100μl含1×106MSCs的PBS后,予以部分液体通气(同P组),以上机械通气,均采用CMV模式,呼吸频率80次/分,潮气量10mL/Kg,给氧浓度100%。
5. 监测指标: 监测大鼠呼吸、心率、血氧饱和度变化;造模后1h和3h测定大鼠动脉血气血氧分压(PaO2),计算氧合指数(动脉血氧分压/吸氧浓度,PaO2/FiO2)。
6. 标本的采集和处理: 麻醉后5mL注射器动脉穿刺置管放血处死大鼠,注入抗凝管后离心留取血清,-80℃冻存。组织剪剪开胸腔,充分暴露心脏及肺脏,眼科剪小心将双肺游离,立即放入冷0.9%生理盐水中,洗净残留血,吸水纸吸干后,观察肺大体表现。留取左肺叶置于10%的甲醛;余按右肺上叶、右肺中叶、右肺下叶,分别放入锡纸内包裹,标记信息后,立即放入液氮中保存。
7. 大鼠肺组织病理学检查: 左肺叶标本石蜡包埋,切片行H&E染色染色。光镜下观察,各组病理学的变化。
8. 观察大鼠肺组织内MSCs分布: 预冷恒冷箱切片机,设定在-18℃左右;将右肺上叶标本自液氮取出后,留取约1.0 cm×1.0 cm×0.5 cm大小的标本,加入OCT包埋剂;冷冻切片,5μm厚度,切片附着于洁净载玻片上,激光共聚焦显微镜,观察肺组织标本中表达红色荧光的MSCs表达情况。
9.ELISA法检测: 采用相应的试剂盒检测大鼠血清TNF-α、IL-1β、IL-6、IL-10含量变化。
三、统计分析
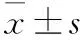
结 果
一、间充质干细胞形态及荧光标记
光镜下观察第4代间充质干细胞,可见细胞呈梭形,平行排列(见图1)。加入CM-DIL染料后,光镜下可见间充质干细胞呈梭形或多角形,更换荧光后,可见细胞发出红色荧光,提示CM-DIL标记细胞(见图2)。
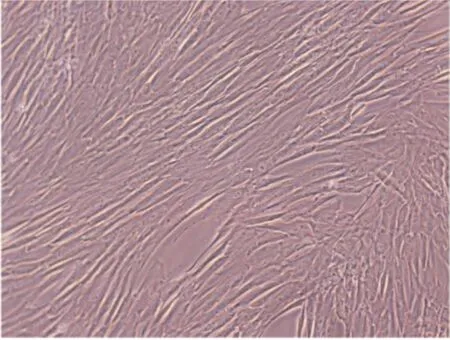
图1 光镜下观察间充质干细胞 (40×)
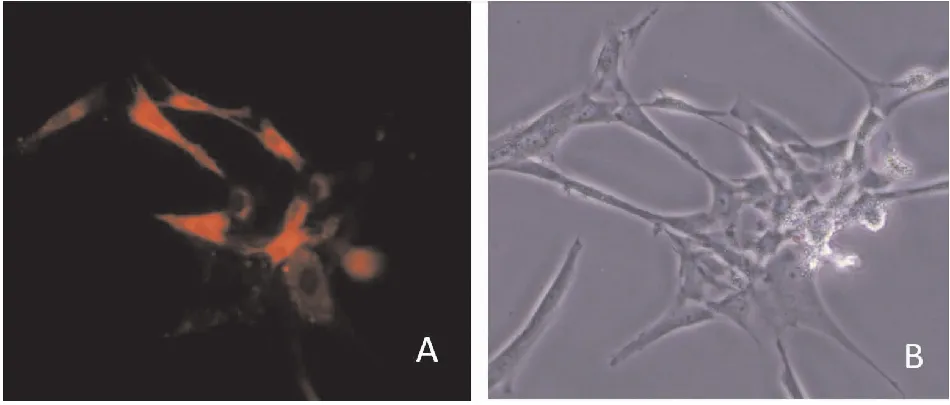
图2 间充质干细胞CM-DIL标记(A:CM-DIL标记的间充质干细胞,红色荧光;B:光镜下观察间充质干细胞 100×)
二、大鼠一般状况
M组大鼠气管内灌注海水后,立即出现呼吸频率增快、心率增快,偶有呛咳,并出现呼吸加深、屏气现象,气道内有白色泡沫样渗出物,可闻及气道喘鸣音。监测氧饱和度迅速下降。
三、动脉血气
氧分压PaO2变化:海水灌注大鼠气管后,1h时间点,M组较C组、R组、P组和PM组明显下降,PM组与C组比较,差异有统计学意义(H=25.062,P=0.032)。R组、P组和PM组较M组升高,P组和PM组与M组分别比较,差异有统计学意义(H=25.062,PvsM:P=0.001,PMvsM:P<0.001)。R组、P组和PM组水平依次升高,但两组之间分别比较,差异无统计学意义(H=25.062,P>0.05)。3h时,M组、R组、P组和PM组分别与C组比较,差异有统计学意义(F=659.461,P<0.001)。R组、P组和PM组分别与M组比较,差异有统计学意义(F=659.461,P<0.001)。P组高于R组,差异有统计学意义(F=659.461,P=0.046),PM组高于R组,差异有统计学意义(F=659.461,P=0.012)。PM组水平均轻度高于P组,两者之间无统计学差异(F=659.461,P>0.05)(见表1)。

表1 大鼠动脉血气分析氧分压(mmHg,n=6)
氧合指数PaO2/FiO2变化:在海水灌注后,1h和3h时间点,M组、R组、P组和PM组低于C组,两组间分别比较,差异有统计学意义,(1h:F=77.579,P<0.001;3h:F=74.000,P<0.001);M组较R组、P组和PM组明显下降,差异有统计学意义(1h:F=77.579,P<0.001;3h:F=74.000,P<0.001)。P组和PM组分别与R组比较,在1h时间点两组之间分别比较,差异有统计学意义(F=77.579,PvsR:P=0.013,PMvsR:P=0.005);在3h时间点比较,虽分别高于R组,但差异无统计学意义(P>0.05)。P组与PM组两者分别在1h、3h比较,PM组虽轻度高于P组,但两者差异无统计学意义(P>0.05)(见表2)。

表2 大鼠氧合指数(mmHg/%,n=6)
四、肺组织形态学变化
C组双肺组织呈粉红色,未见肿胀及充血改变。M组大鼠肺组织肿胀明显,呈苍白色,表面可见大面积片状出血,局部可见大小不等暗红色点片状实变。R组与C组比较,未出现明显苍白肿胀表现,但局部可见片状出血及暗红色实变样改变。P组及PM组大鼠肺组织表面片状出血及暗红色点片状实变较M组和R组少。PM组较P组大鼠肺组织表面片状出血面积及暗红色点片状实变减少(见图3)。
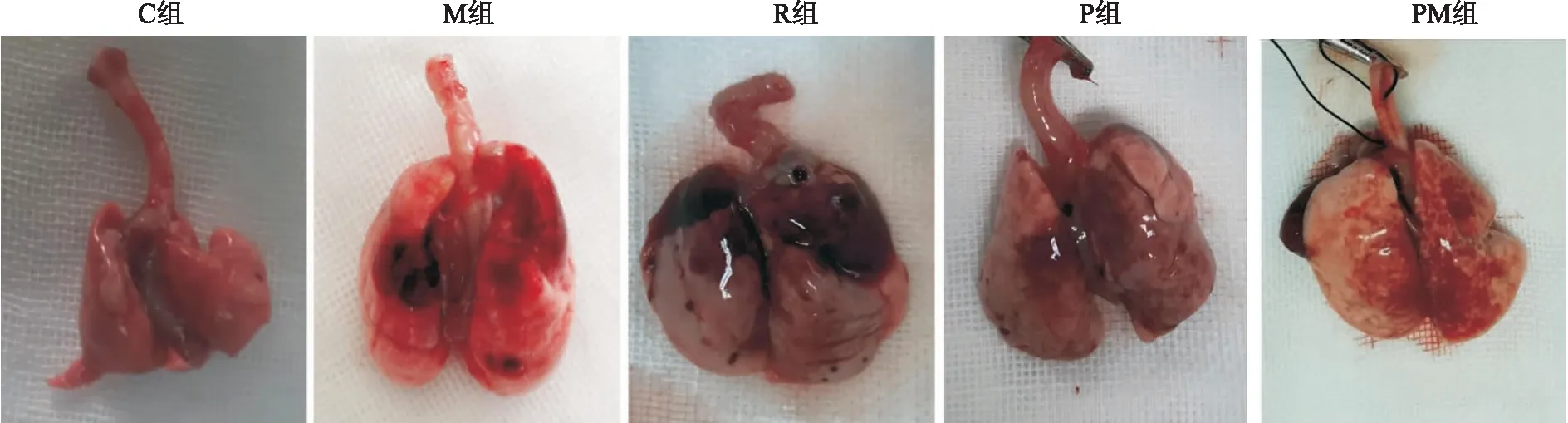
图3 大鼠肺组织形态
五、大鼠肺组织病理变化(HE染色)
光镜下可见,C组大鼠肺泡组织结构完整,肺泡壁薄,肺间质未见增厚,肺泡腔内未见水肿。M组可见肺组织内充血明显,并可见大量炎性细胞渗出,局部可见肺泡萎陷,失去正常结构,部分肺泡腔内可见大量红细胞,肺泡间隔明显增宽、增厚。R组、P组及PM组较M组减轻,其中P组和PM组损伤减轻更加明显,肺泡间隔较R组增宽、增厚减少,肺泡萎陷数量减少(见图4)。

图4 大鼠肺组织病理(A:C组,B:M组;C:R组;D:P组;E:PM组,HE染色 20×)
六、ELISA检测大鼠血清TNF-α、IL-1β、IL-6、IL-10表达
血清IL-1β表达,M组、R组均高于C组,差异有统计学意义(H=26.908,MvsC:P<0.001,RvsC:P=0.01)。P组和PM组水平高于C组,但各自两者之间比较无统计学差异(P>0.05)。R组、P组和PM组水平低于M组,PM组与M组比较,差异有统计学意义(H=26.908,P=0.004),R组和P组分别与M组比较,差异无统计学意义(P>0.05)。R组、P组和PM组的IL-1β表达水平依次下降,但两者之间分别比较,差异无统计学意义(P>0.05)(见表3)。

表3 大鼠海水淹溺血清细胞因子(pg/mL,n=6)
血清IL-6表达,M组、R组、P组和PM组均较C组显著升高,差异有统计学意义(F=231.683,P<0.001)。R组、P组和PM组与M组比较,各组均表达降低,两组之间分别比较,差异有统计学意义(F=231.683,P<0.001)。P组和PM组水平均分别低于R组,两组之间分别比较,差异有统计学意义(F=231.683,PvsR:P<0.001,PMvsR:P<0.001)。PM组水平低于P组,差异有统计学意义(F=231.683,P=0.004)(见表3)。
血清IL-10表达,M组、R组、P组和PM组均较C组显著升高,差异有统计学意义(F=85.451,P<0.001)。R组和PM组水平高于M组,两组之间分别比较,差异有统计学意义(F=85.451,RvsM:P=0.035,PMvsM:P<0.001)。P组水平高于M组,但差异无统计学意义(P>0.05)。P组表达水平低于R组,但差异无统计学意义(P>0.05)。PM组水平均高于R组和P组,两组之间分别比较,差异有统计学意义(F=85.451,PMvsR:P=0.003,PMvsp:P<0.001)(见表3)。
血清TNF表达,M组、R组、P组和PM组均较C组升高,M组与C组分别比较,差异有统计学意义(H=24.882,P=0.004),而R组、P组和PM组与C组比较,差异无统计学意义(P>0.05)。R组、P组和PM组与M组比较,表达水平均低于M组,R组和P组分别与M组比较,差异无统计学意义(P>0.05),PM组与M组比较,差异有统计学意义(H=24.882,P<0.001)。P组和PM组表达水平低于R组,P组与R组比较,差异无统计学意义(P>0.05),PM组与R组比较,差异有统计学意义(H=24.882,P=0.016)。PM组水平低于P组,但差异无统计学意义(P>0.05)(见表3)。
七、外源性MSCs在大鼠肺组织内分布及分化表达
通过激光共聚焦显微镜观察PM组大鼠肺组织冰冻切片,可发现通过CM-DIL标记的红色荧光表达的MSCs(图5)。
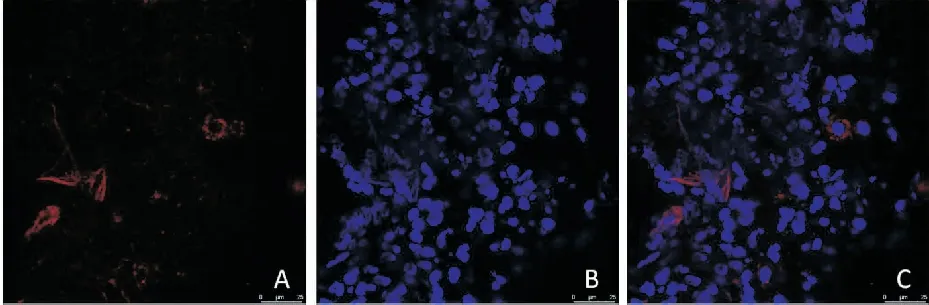
图5 激光共聚焦显微镜观察大鼠肺内间充质干细胞(A:CM-DIL ;B: DAPI;C: MERG, 100×)
讨 论
目前国内外尚无关于通过气道植入间充质干细胞联合部分液体通气治疗肺损伤的报道。PFC与MSCs直接接触,因PFC脂溶性、比重大等特征,对MSCs的活力及迁移均有着影响[8]。通过前期体外模拟试验中发现,不能直接将MSCs加入PFC中进行试验,而先加入MSCs,后加入PFC时,PFC对MSCs的细胞迁移、细胞增殖及分化能力未受明显影响。因此本研究采用先气管内植入间充质干细胞,之后灌注全氟化碳,进行部分液体通气。
本研究采用人工配方模拟海水,在气管内注入后,大鼠动脉血气分析提示氧合指数在造模后的1h和3h,均小于300mmHg,说明构建的大鼠海水淹溺模型可保持肺损伤导致缺氧状态。通过监测动脉血气分析及测算氧合指数,提示联合治疗同单独部分液体通气,同样可较快改善海水淹溺后大鼠的动脉血氧分压及氧合指数,并维持至造模观察终点3h。这一方面与PFC较高的氧溶解能力有关,另一方面因PFC比重大,可使损伤较重的肺泡萎陷区域复张,抑制海水灌注引起的肺泡腔炎性渗出,使肺内血流重新分布,从而改善通气/血流比值有关[8]。同时肺组织病理也证实,部分液体通气及联合干细胞治疗组可明显减轻肺泡损伤,维持正常结构。
研究表明,肺内过度和失控的炎症反应是导致ARDS的根本原因,其中TNF-α、IL-1β和IL-6均与ARDS发生、发展密切相关[1]。TNF-α、IL-1β是全身及局部炎症反应中起到重要作用的细胞因子,参与炎症级联反应[9]。IL-10作为抗炎细胞因子被发现具有抑制NF-kB活化的功能,其变化是机体抗炎反应的之一[9]。本研究在海水灌注后,大鼠血清中TNF-α、IL-1β和IL-6均显著升高,提示机体对于海水淹溺出现全身炎症反应。同时IL-10也同时升高,作为机体对过多炎症因子释放的反应,属于机体的负反馈调节。针对肺损伤机体过度炎症反应,本研究中部分液体通气联合气道植入间充质干细胞组和部分液体通气组,较常规通气治疗减轻了TNF-α、IL-1β和IL-6的升高,其中联合治疗组更加明显。考虑与PFC和MSCs均具有抗炎作用有关[10]。已有大量研究证明,MSCs具有免疫调节、抑制炎症反应的作用,并已在肺损伤的多种动物模型中被证实[11-12]。作为抗炎因子的IL-10,在联合治疗组较其他组升高更加明显,这有可能与MSCs通过免疫调节作用,参与机体对炎症反应的调控有关。
针对解决ARDS中肺泡/毛细血管膜受损的问题,本研究提出利用MSCs修复损伤的这一特点进行尝试。研究中可观察到大鼠肺组织内可见红色荧光标记的MSCs,提示通过气管植入的外源MSC可顺利植入肺组织内。因本研究未进行长时间的观察,需要后续研究观察植入MSCs在修复损伤方面所起到的作用。
总之,本研究首次发现气管植入间充质干细胞联合部分液体通气,较常规机械通气及部分液体通气可更好的改善和维持氧合,减轻海水淹溺导致的肺组织损伤,并可更有效的减少细胞因子表达水平,这为研究救治海水淹溺致急性呼吸窘迫综合征的方法,提供了新的思路和理论基础。
