二甲双胍诱导的干细胞样记忆性嵌合抗原受体-T细胞对小鼠多发性骨髓瘤移植瘤的治疗作用
2021-10-28董一唯孙艳莎李宗海蒋华
董一唯,孙艳莎,李宗海,蒋华
多发性骨髓瘤(multiple myeloma,MM)作为一种恶性浆细胞肿瘤,其特征为骨髓中单克隆浆细胞的恶性增殖并产生单克隆免疫球蛋白,临床症状主要表现为贫血、肾功能损害、溶骨性损害和高血钙等引起的终末器官损伤[1]。MM是第2常见的血液恶性肿瘤,在血液系统恶性肿瘤中约占10%,在所有肿瘤中约占1%[2]。尽管由于新兴治疗手段的发展,MM的中位生存期延长至6年[3],但多数患者会复发,所以目前MM仍被认为是无法治愈的恶性肿瘤。B细胞成熟抗原(B cell maturation antigen,BCMA)即CD269,也称作肿瘤坏死因子超家族成员17(tumor necrosis factor receptor superfamily member-17,TNFRSF-17),是由184个氨基酸组成的3型跨膜蛋白,对B细胞增殖、成熟、存活和向浆细胞分化发挥调节作用[4]。BCMA仅在浆细胞上表达,且在恶性浆细胞中的表达比例高于正常浆细胞[5]。80%~100%的MM细胞上都表达BCMA,并且随着疾病进展,BCMA表达上调[4]。另外,BCMA高表达与不良预后有关,因此被当做免疫治疗的理想靶抗原[5]。
近年来,嵌合抗原受体(chimeric antigen receptor,CAR)修饰的T细胞疗法成为肿瘤治疗领域最具前景的发展方向之一。CAR-T细胞治疗的主要流程为从体外获取人外周血T细胞,通过基因重组技术,获得表达CAR的T细胞,使得CAR-T细胞能够特异性识别和结合肿瘤表面抗原,并杀伤带有该特定抗原的肿瘤细胞。目前CAR-T疗法已被美国食品药品监督管理局批准用于治疗难治性前B细胞急性淋巴结白血病和弥漫大B细胞淋巴瘤[6]。然而,传统的CAR-T细胞产品主要由处于终末分化状态的效应T细胞(effector T cell,Teff)组成,这一定程度上导致了CAR-T细胞治疗血液肿瘤过程中的低免疫应答和治疗后复发。有研究显示,良好的治疗效果与T细胞的存活持久性有关[7]。除了肿瘤负荷的大小,不同的T细胞亚群比例也影响了临床治疗中的免疫应答和抗肿瘤效果。在治疗慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)过程中,靶向CD19的CAR-T细胞中低分化T细胞所占的百分比越高,患者对CAR-T细胞治疗的免疫应答越完全且持久。并且,完全应答的CLL患者的CAR-T细胞高表达记忆相关的基因,而未高表达终末分化和糖酵解相关的基因[8]。
初始T细胞(naïve T cell,Tn)遇到抗原刺激后分化为干细胞样记忆T细胞(stem-cell memory T cell,Tscm),随后逐渐分化为中央型记忆型T细胞(central memory T cell,Tcm)、效应记忆型T细胞(effector memory T cell,Tem)和效应T细胞(effector T cell,Teff)。在分化过程中,T细胞的效应杀伤功能逐渐增强,而干性逐渐丧失[9]。Tscm作为初始的记忆型T细胞,其干性最强,即具有自我更新和多向分化的能力。Tscm遇到抗原后能够分化为其他T细胞亚群,尤其是细胞毒性CD8+T细胞[10]。在动物模型中,相较于记忆型T细胞的其他亚群,Tscm显示出更强的增殖、存活和抗肿瘤能力[11]。长期接受抗原刺激后,肿瘤细胞表面的检查点分子会使细胞毒性CD8+T细胞耗竭进而功能失调[12],而Tscm富集的T细胞可以重新分化为细胞毒性CD8+T细胞,并增强T细胞的瘤内浸润[13]。因此,Tscm亚群有希望解决免疫治疗中T细胞存活时间短、瘤内浸润不足和T细胞失能等问题。本研究中采取体外诱导的策略,将传统的CAR-T细胞诱导为Tscm富集的CAR-T细胞,再进行体内治疗,以期提高免疫治疗效果。
T细胞的代谢对于T细胞分化十分重要,代谢重编程是获得大量记忆型T细胞的策略之一。活化后的T细胞利用需氧的糖酵解过程向效应T细胞分化。在T细胞亚群中,效应T细胞处于终末分化状态,记忆能力最低,仅能发挥短时的杀伤作用;而长期存活的记忆型T细胞仍然通过氧化磷酸化来供能[14]。研究表明,抑制雷帕霉素靶蛋白(mechanistic target of rapamycin,mTOR)通路,以及促进脂肪酸氧化(fatty acid oxidation,FAO)都可以促进记忆型CD8+T细胞的生成[15-17]。近年来,许多研究根据此思路更新了体外扩增T细胞的方案,以获得富集Tscm的T细胞库,例如体外培养T细胞过程中添加丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase,MEK)抑制剂和mTOR抑制剂等,主要机制涉及增强Notch信号,减少活性氧(reacitive oxygen species,ROS)或减少mTOR通路的活性[18-19]。二甲双胍是治疗糖尿病的常用药,其调节能量代谢的主要机制为促进AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)的活化、减少T细胞的脂肪酸氧化[15]。二甲双胍能抑制线粒体电子传递链(electron transport chain,ETC)和ATP生成,通过激活AMPK和抑制mTOR复合体Ⅰ来促进分解代谢、抑制合成代谢,从而调节肿瘤免疫微环境[20]。另外,二甲双胍降低T细胞表面程序性死亡配体1(programmed cell death protein ligand 1,PD-L1)的表达水平,提高肿瘤浸润CD8+T细胞的数量和分泌效应细胞因子的能力,使耗竭的T细胞由失活状态“复活”[21-22]。因此,作为AMPK激活剂,二甲双胍是T细胞代谢重编程的理想分子。因此,本研究中采用二甲双胍体外诱导BCMA靶向的CAR-T细胞,观察其对CAR-T细胞分化的影响,并进一步探究其对小鼠MM移植瘤模型生长的抑制作用。
1 材料与方法
1.1 细胞系和实验动物
人MM细胞系RPMI-8226购自中国科学院典型培养物保藏委员会细胞库,在含有10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养液中培养;人胚肾上皮细胞293T细胞构自美国典型培养物保藏中心,在含有10%胎牛血清、不含抗生素的DMEM培养液中培养;所有细胞均置于37 ℃、CO2体积分数为5%的细胞培养箱中进行培养。
5~6周龄的雌性高度免疫缺陷型NPG小鼠购自北京维通达生物技术有限公司[实验动物生产许可证号:SCXK(京)2019-0002]。小鼠饲养于上海市肿瘤研究所实验动物中心[实验动物使用许可证号:SYXK(沪)2017-0011]的无特定病原体(specific pathogen free,SPF)环境。本研究的动物实验严格按照上海交通大学医学院附属仁济医院实验动物管理委员会制定的实验动物伦理条例进行。
1.2 试剂和仪器
胎牛血清、RPMI 1640培养液、AIM-V培养液和DMEM培养液购自美国Gibco公司。人AB血清购自美国Gemini公司,细胞培养用青霉素-链霉素购自美国Invitrogen公司,非放射性细胞毒性检测试剂盒购自瑞士Roche公司。人CD3/CD28 T细胞活化磁珠购自美国Invitrogen公司。重组人白细胞介素2(recombinant human interleukin-2,rhIL-2)购自上海华新生物高技术有限公司,rhIL-7和rhIL-21购自美国PeproTech公司;盐酸二甲双胍购自美国Selleck Chemicals公司。生物素(biotin)标记的羊抗人F(ab’)多克隆抗体购自美国Jackson ImmunoResearch公司。藻红蛋白(phycoerythrin,PE)标记的链霉亲和素购自美国eBioscience公司。PerCP标记的抗人CD3抗体、FITC标记的抗人CD4抗体、PE标记的抗人CD8抗体、BV510标记的抗人CD8抗体、APC标记的抗人CD95抗体、PE-CF594标记的抗人C-C基序趋化因子受体7(C-C motif chemokine receptor 7,CCR7)抗体购自美国BD公司,FITC标记的抗人CD45RA抗体购自美国Invitrogen公司。FITC-Annexin Ⅴ和碘化丙啶(propidium iodide,PI)双染细胞凋亡试剂盒和绝对计数管购自美国BD公司。人外周血单个核细胞(peripheral blood mononuclear cell,PBMC)由上海市血液中心提供。聚乙二醇(polyethylene glycol,PEG)-8000和聚乙烯亚胺(polyethyleneimine,PEI)购自美国Sigma公司。
流式细胞仪(BD FACSCelesta™)为美国BD公司产品,生物安全柜为新加坡ESCO公司产品,细胞培养箱为美国Thermo公司产品。
1.3 慢病毒包装与浓缩
将293T细胞接种于直径为10 cm的培养皿中,待细胞状态良好时使用。在800 μL DMEM培养液中分别加入一定比例的pAX2、pMD2.G和携带有BCMA-BBZ的重组载体(由本实验室构建并保存)混匀(即为A液);在800 μL DMEM培养液中加入PEI溶液(PEI与质粒的质量比为2∶1)混匀(即为B液)。将A液滴加入B液中,室温静置10 min后将混合液滴加入接种有293T细胞的培养皿中,置于37 ℃、CO2体积分数为5%的细胞培养箱中进行培养。4~6 h后收集细胞,除去原培养上清液,更换为新鲜的含10%胎牛血清的DMEM培养液,继续培养72 h后收集病毒,用孔径为0.45 μm的尼龙过滤膜过滤后,加入1/4体积的5×PEG-8000溶液,混匀后置于4 ℃冰箱中过夜。次日,离心后收集病毒,用含2%人AB血清的AIM-V培养液重悬病毒,混匀后保存于-80 ℃冰箱备用。
1.4 CAR-T细胞的制备及扩增
二甲双胍诱导靶向BCMA的CAR-T细胞构建流程见图1A。采用Ficoll淋巴细胞分离液分离获得健康人群的PBMC,将约1×107个PBMC置于含2%人AB血清和rhIL-2(300 IU/mL)的AIM-V培养液中培养过夜。为了分离出PBMC中的T细胞,首先采用人CD3/CD28 T细胞活化磁珠进行活化∶按照CD3阳性细胞数与活化磁珠数比例为1∶2估算出所需活化磁珠的数量,加入相应的活化磁珠于培养体系内,将细胞密度调整为2×106个/mL,同时加入rhIL-2激活细胞,记为Day 0。为了将CAR转导至活化后的T细胞上,T细胞活化24 h后,更换新鲜的培养液并加入BCMA-BBZ慢病毒[感染复数(multiplicity of infection,MOI)=5]进行感染,同时添加8 μg/mL聚凝胺(polybrene)以提高感染效率,记为Day 1。为使CAR-T细胞扩增并诱导出更高比例的Tscm,在慢病毒感染T细胞24 h后,收集细胞并将原有的培养液更换为含2%人AB血清、rhIL-7(5 ng/mL)和rhIL-21(25 ng/mL)的AIM-V培养液,培养于培养瓶中,记为Day 2。二甲双胍诱导组(rhIL-7+rhIL-21+二甲双胍)为CAR-T细胞在rhIL-7和rhIL-21基础上加入二甲双胍(0.25 mmol/L),非二甲双胍诱导组(rhIL-7+rhIL-21)为CAR-T细胞在rhIL-7和rhIL-21基础上加入与二甲双胍溶剂等量的PBS,空白对照组为未感染慢病毒的人T细胞(untransduced T cell,UTD)。T细胞感染后3 d,用磁极吸附除去活化磁珠,各组分别更换为与Day 2一致的新鲜的培养液,记为Day 5。次日,收集细胞用于检测CAR-T细胞阳性率、表型和功能,记为Day 6。随后,置于37 ℃、CO2体积分数为5%的细胞培养箱中进行培养。
1.5 筛选二甲双胍体外诱导CAR-T细胞最佳条件
1.5.1 FCM法检测二甲双胍处理不同时间对CAR-T细胞阳性率的影响
收集各组CAR-T细胞[UTD组、rhIL-7+rhIL-21组、rhIL-7+rhIL-21+二甲双胍(0.25 mmol/L)组(分别在T细胞活化当天、活化后1 d和活化后2 d时进行处理)],使用含1%小牛血清的PBS洗涤后,加入Biotin标记的羊抗人F(ab’)抗体(体积稀释比例为1∶50),冰上避光孵育45 min;洗涤后加入PE标记的链霉亲和素(体积稀释比例为1∶200),室温避光孵育20 min后重悬细胞,上流式细胞仪检测。PE阳性的细胞即为慢病毒感染后表达CAR的T细胞,PE阳性细胞占总淋巴细胞的比例即为CAR-T细胞阳性率。
1.5.2 FCM检测不同浓度的二甲双胍对CAR-T细胞记忆表型的影响
收集不同浓度二甲双胍处理至第6天的各组CAR-T细胞[rhIL-7+rhIL-21组、rhIL-7+rhIL-21+二甲双胍(0.125 mmol/L)组、rhIL-7+rhIL-21+二甲双胍(0.25 mmol/L)组和rhIL-7+rhIL-21+二甲双胍(0.5 mmol/L)组],洗涤后同时加入BV510标记的抗人CD8抗体、APC标记的抗人CD95抗体、PE-CF594标记的抗人CCR7抗体和FITC标记的抗人CD45RA抗体(体积稀释比例均为1∶50),室温避光孵育20 min后重悬细胞,上流式细胞仪检测。首先圈出淋巴细胞中的CD8+CD95+的细胞群,以CD45RA和CCR7的表达水平区分Tscm和Teff细胞。CD8+T细胞中的CD95、CD45RA和CCR7高表达(CD95high CD45RAhigh CCR7high)的细胞亚群为Tscm,CD95和CD45RA高表达、CCR7低表达(CD95high CD45RAhigh CCR7low)的细胞亚群为Teff。
1.6 FCM检测不同浓度的二甲双胍诱导的CAR-T细胞的凋亡率
收集各组CAR-T细胞(细胞分组及处理时间同1.5.2节),PBS洗涤后,加入PI和FITCAnnexin Ⅴ(体积比例为1∶50),室温避光孵育15 min,直接加入适量指定溶液后上机检测细胞的凋亡率。
1.7 二甲双胍体外诱导CAR-T细胞中Tscm的富集
收集活化6和8 d后的非二甲双胍诱导组(rhIL-7+rhIL-2)和二甲双胍诱导组[rhIL-7+rhIL-21+二甲双胍(0.25 mmol/L)]CAR-T细胞,采用FCM法检测CAR-T细胞记忆表型,实验流程同1.5.2节。
1.8 非放射性细胞毒性法检测CAR-T细胞体外对MM细胞的杀伤能力
收集活化6 d后(Day 6)的CAR-T细胞作为效应细胞(培养过程及实验分组同1.4节),以MM细胞RPMI-8226作为靶细胞,离心后计数细胞,按照效靶比3∶1、1∶1和1∶3,将效应细胞和靶细胞接种于96孔板中;分别设置效应自发、靶细胞自发、靶细胞最大、空白对照和体积对照组,每组至少设3个复孔;培养体系为200 μL,培养于含10%胎牛血清的RPMI 1640培养液中,置于37 ℃、CO2体积分数为5%的细胞培养箱中培养。18 h后,每孔取50 μL培养上清液加入酶标板中,再加入显色试剂显色后用酶联免疫检测仪在波长490 nm处检测的各孔细胞的D值。
1.9 体外连续多轮靶细胞刺激
收集活化6 d(Day 6)后的CAR-T细胞作为效应细胞(培养过程及实验分组同1.4节),RPMI-8226细胞作为靶细胞,以1∶1的效靶比混合接种于6孔板中,加入含10%胎牛血清的RPMI 1640培养液培养2 d后(Day 8),收集剩余CAR-T细胞检测表型(实验方法同1.5.2节)或毒性杀伤能力(实验方法同1.8节),定义为第一轮刺激(Stim 1);同时,将剩余的CAR-T细胞再次与新的RPMI-8226细胞按1∶1的细胞数共培养,2 d后收集剩余CAR-T细胞再次检测表型或毒性杀伤能力(实验方法同第一轮刺激),定义为第二轮刺激(Stim 2)。
1.10 CAR-T细胞治疗小鼠MM皮下移植瘤的效果
收集状态良好的人MM细胞RPMI-8226接种于NPG小鼠的右侧腋部皮下,每只小鼠接种3×106个细胞。当肿瘤生长至体积为200~300 mm3(约14 d)时,将荷瘤小鼠被随机分为3组,实验分组同1.4节,每组6只。收集T细胞活化6 d后(Day 6)的UTD和CAR-T细胞(非二甲双胍诱导组和二甲双胍诱导组),培养过程及实验分组同1.4节,分别通过尾静脉注射输注至3组小鼠体内,每只小鼠尾静脉注射的剂量为5×105个UTD或CAR-T细胞。每周测量肿瘤体积(Vtumor=1/2×长径×短径2)和小鼠体质量2~3次。当每组小鼠肿瘤平均体积达到2 000 mm3时结束观察,小鼠实施安乐死。CAR-T细胞注射14 d时采用颌下静脉采血法采集少量小鼠外周血,保存于EDTA处理后的抗凝管中,使用抗人CD3、CD4和CD8抗体以及绝对计数管,检测外周血中CD4+T细胞和CD8+T细胞的数量。
1.11 FCM法检测小鼠外周血中CD8+ T细胞和CD4+ T细胞的数量
荷瘤小鼠尾静脉注射CAR-T细胞14 d后,每组选取3只小鼠采集外周血。吸取20 μL PerCP标记的抗人CD3抗体、FITC标记的抗人CD4抗体及PE标记的抗人CD8抗体滴加于绝对计数管管底的金属网上,勿溶解微球;随后加入50 μL外周血,涡旋混匀后室温静置15 min;再加入450 μL红细胞裂解液,涡旋混匀后室温条件下静置15 min,即可上机检测;最后根据说明书提供的方法计算阳性表达细胞的数量。所有流式数据通过FlowJo V10软件进行分析。
1.12 统计学方法
采用Graphpad Prism 8对所有实验数据进行统计学分析,所有实验均独立重复3次,计量资料以表示。2组间比较采取独立样本t检验,多组间比较采取双因素或单因素方差分析,组内两两比较采用Bonferroni检验。P<0.05为差异有统计学意义。
2 结果
2.1 二甲双胍体外诱导CAR-T细胞的最佳条件摸索
采用FCM法检测T细胞活化6 d后(UTD组和rhIL-7+rhIL-7组)以及Day 0、Day 1和Day 2时(见图1A)添加二甲双胍(0.25 mmol/L)对CAR-T细胞阳性率的影响。结果(图1B)显示,T细胞活化时(Day 0)和病毒感染转入CAR时(Day 1)添加二甲双胍会使CAR-T细胞的阳性率降低6%~10%,而在导入CAR 1 d后(Day 2)再加入二甲双胍则CAR-T细胞的阳性率不受影响。因此,本研究选择在T细胞导入CAR 1 d后(Day 2)加入二甲双胍进行诱导,并且3 d后(Day 5)更换培养液时重新加入二甲双胍以维持培养体系中二甲双胍的持续作用。

Fig.1 A: Schematic diagram of B cell maturation antigen (BCMA)-targeted chimeric antigen receptor(CAR)-T cells culture process and metformin (MET) induction.B: The effect of MET (0.25 mmol/L) on the transduction efficiency of BCMA-BBZ CAR on T cells at different time points (Day 0,Day 1 and Day 2) during the culture of CAR-T cells was detected by FCM method.Untransduced T cell (UTD): the blank control;CAR-T cells treated with cytokines [recombinant human interleukin-7 (rhIL-7)+rhIL-21]: the control.图1 靶向BCMA CAR-T细胞的构建及二甲双胍诱导处理流程图(A)及CAR-T细胞构建过程中不同时间点加入二甲双胍(0.25 mmol/L)对BCMA-BBZ CAR转染至T细胞转染效率的影响(B)
采用FCM法检测T细胞活化6 d后,添加不同浓度(0.125、0.25和0.5 mmol/L)二甲双胍诱导后对CAR-T细胞记忆表型的影响。结果(图2A)显示,浓度为0.125、0.25和0.5 mmol/L的二甲双胍诱导后的CD8+T细胞中的Tscm所占百分比依次升高,且0.25和0.5 mmol/L二甲双胍诱导后的CD8+T细胞中的Tscm所占百分比均明显高于非二甲双胍诱导组的细胞(P<0.05和P<0.01)。
FCM法检测结果(图2B)显示,浓度为0.25 mmol/L二甲双胍诱导的CAR-T细胞中凋亡细胞所占百分比明显低于0.5 mmol/L浓度组。为了减少凋亡细胞对CAR-T细胞的不利影响,因此,本研究后续选用0.25 mmol/L作为二甲双胍体外诱导CAR-T细胞的浓度。
2.2 二甲双胍体外成功诱导了CAR-T细胞中Tscm的富集
FCM法连续检测T细胞活化6和8 d后CAR-T细胞中CD8+T细胞和Tscm所占的百分比。结果(图3)显示,在连续培养的过程中,相较于只使用rhIL-7+rhIL-21培养的CAR-T细胞(非二甲双胍诱导组),使用二甲双胍诱导的CAR-T细胞中,CD8+细胞中Tscm所占的百分比明显增高(P<0.05),Teff所占的百分比略低但差异无统计学意义(P>0.05)。这一结果说明,体外培养时加入二甲双胍能维持CAR-T细胞中CD8+T细胞的记忆性和干性,减缓向终末分化的速度。
2.3 二甲双胍诱导的CAR-T细胞在靶细胞刺激后仍维持Tscm的富集
用RPMI-8226细胞对CAR-T细胞进行多轮刺激后检测CAR-T细胞中Tscm的富集情况。结果(图4A)显示,经第一轮和第二轮刺激后,二甲双胍诱导的CAR-T细胞的CD8+T细胞中Tscm所占百分比均高于未经二甲双胍诱导的CAR-T细胞。这一结果提示二甲双胍的诱导后的CAR-T细胞在长期抗原刺激下仍能保持Tscm的富集。
非放射性细胞毒性法检测各组CAR-T细胞对RPMI-8226细胞的杀伤能力。结果(图4B)显示,在RPMI-8226细胞对CAR-T细胞进行刺激前,在不同的靶效比中,与未经二甲双胍诱导的CAR-T细胞相比,二甲双胍诱导后的CAR-T细胞对肿瘤细胞的杀伤能力没有明显变化,差异无统计学意义(P均>0.05);经二甲双胍诱导的Tscm富集的CAR-T细胞在经过RPMI-8226细胞第一轮和第二轮刺激后,在不同的靶效比中,与未经二甲双胍诱导的CAR-T细胞相比,其特异性杀伤能力差异均无统计学意义(P均>0.05)。

Fig.2 The differentiation (A) and apoptosis rate (B) of chimeric antigen receptor (CAR)-T cells induced by different concentrations (0.125,0.25 and 0.5 mmol/L) of metformin (MET) were determined by flow cytometry (FCM).CAR-T cells treated with cytokines [recombinant human interleukin-7 (rhIL-7)+rhIL-21]: the control.*P<0.05,**P<0.01 (n=3).图2 FCM法检测不同浓度二甲双胍处理后对CAR-T细胞中的记忆细胞分化(A)和凋亡(B)的影响
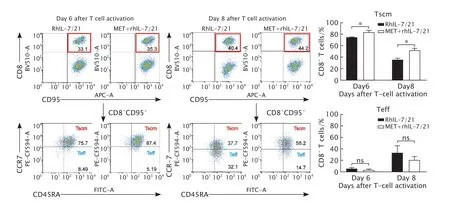
Fig.3 The effects of metformin (MET) on the percentage of stem-cell memory T cell (Tscm) in CD8+ T cells after T cell activation at Day 6 and Day 8 were detected by flow cytometry (FCM).CAR-T cells treated with recombinant human interleukin-7 (rhIL-7) and rhIL-21: the control.*P<0.05 (n=3).图3 FCM检测T细胞活化第6和第8天时二甲双胍对CD8+干细胞性记忆T细胞比例的影响
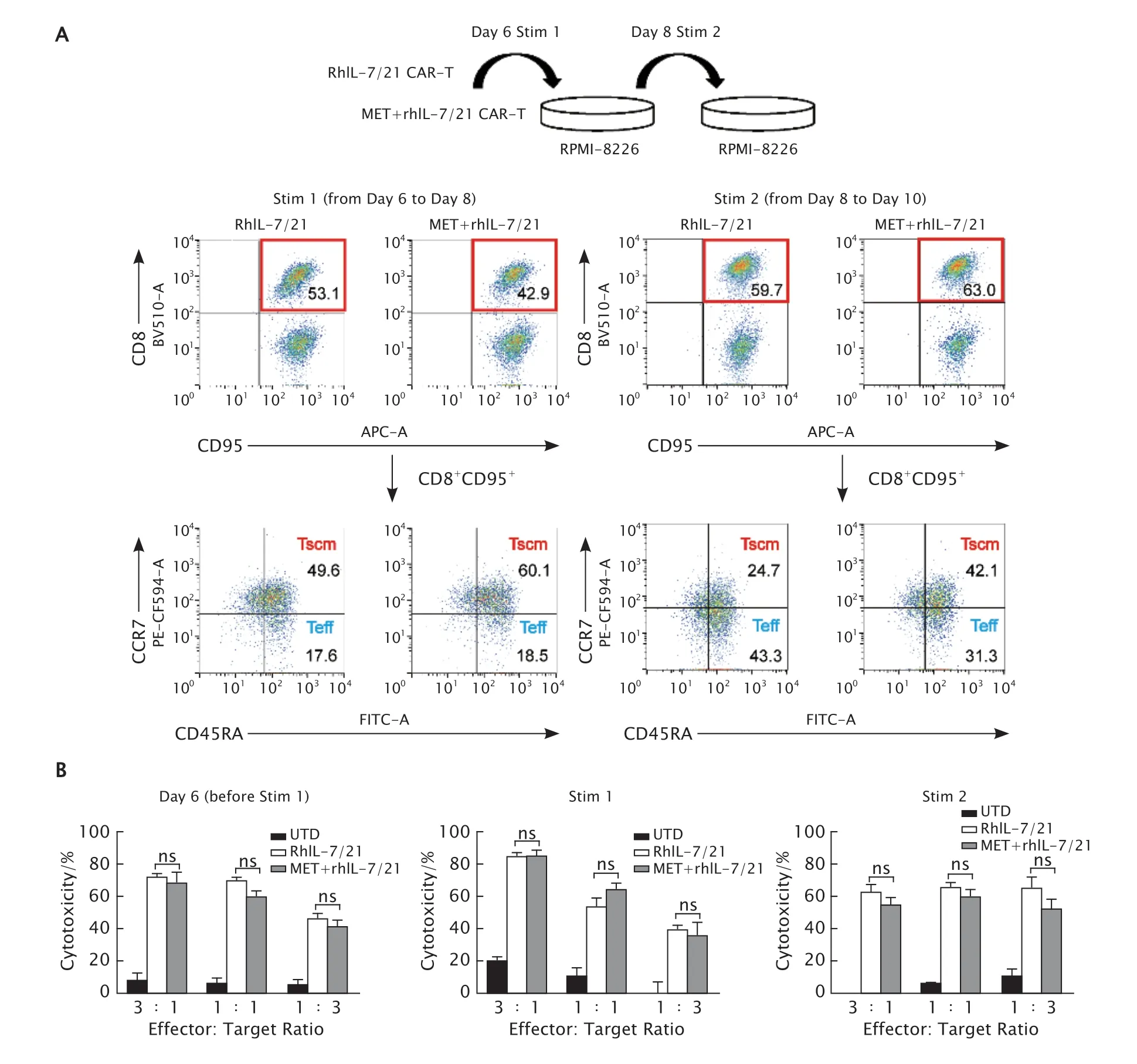
Fig.4 A: Experimental scheme for serial antigen stimulation by RPMI-8226 cells,and the effect of metformin (MET) on the percentage of stem-cell memory T cell (Tscm) in CD8+ T cells after serial RPMI-8226 cells stimulation was determined by flow cytometry (FCM).Chimeric antigen receptor (CAR)-T cells treated with recombinant human interleukin-7 (rhIL-7) and rhIL-21: the control (n=3).B: The effect of MET on the cytotoxic activities of CAR-T cells before and after serial RPMI-8226 cells stimulation (Stim 1 and Stim 2) was tested by nonradioactive cytotoxicity assay.CAR-T cells treated with rhIL-7 and rhIL-21:the control;the untransduced T cells (UTD): the blank control (n=3).图4 FCM法检测二甲双胍诱导对经过连续2轮RPMI-8226细胞刺激的CAR-T细胞中CD8+ Tscm所占比例的影响(A)以及非放射性细胞毒性法检测RPMI-8226细胞刺激前和连续2轮刺激后二甲双胍诱导对CAR-T细胞体外杀伤能力的影响(B)
2.4 二甲双胍诱导的CAR-T细胞有效抑制小鼠MM移植瘤的生长
构建小鼠MM细胞RPMI-8226皮下移植瘤模型:肿瘤细胞接种14 d后,将肿瘤平均体积约250 mm3的小鼠随机分为3组,尾静脉注射相应的CAR-T细胞(图5A),记录小鼠肿瘤体积。结果(图5B)显示,相较于UTD组,二甲双胍诱导的CAR-T治疗组与非二甲双胍诱导CAR-T治疗组均能有效抑制MM移植瘤的生长(P<0.000 1和P<0.01),但二甲双胍诱导前后的2个CAR-T治疗组之间其的抑瘤效果,差异无统计学意义(P>0.05)。在肿瘤接种35 d后,二甲双胍诱导组CAR-T细胞和非二甲双胍诱导组CAR-T细胞的抑瘤率分别为83.14%和90.92%(图5C)。此时UTD组小鼠的平均肿瘤体积超过2 000 mm3,继续观察剩余2组小鼠的肿瘤体积直到出现小鼠死亡,结果显示虽然在UTD组小鼠死亡时二甲双胍诱导组CAR-T细胞的抑瘤率略小于非诱导组CAR-T细胞的抑瘤率,但肿瘤细胞接种42 d后,二甲双胍诱导的CAR-T治疗组的抑瘤效果持续略优于与非诱导CAR-T细胞组。
期间每周记录小鼠体质量,结果(图5D)显示每组之间小鼠体质量没有明显变化,说明用二甲双胍诱导的CAR-T细胞治疗无明显不良反应。随后,继续观察剩余治疗组的小鼠生存期,结果(图5E)显示,二甲双胍诱导的CAR-T治疗组的小鼠与非二甲双胍诱导的CAR-T细胞组小鼠相比具有一定的生存获益(肿瘤细胞接种87 d后,二甲双胍诱导CAR-T组1只小鼠死亡,非诱导组2只小鼠死亡),但2组之间差异无统计学意义。
2.5 经二甲双胍诱导的CAR-T细胞在荷瘤小鼠外周血中的存活数量增多
FCM法检测经尾静脉注射CAR-T细胞14 d后的荷瘤小鼠外周血中CD4+和CD8+T细胞的数量。结果(图5F)显示,二甲双胍诱导的CAR-T治疗组的小鼠外周血中CD8+T细胞数明显多于二甲双胍非诱导CAR-T细胞组(P<0.05)。上述结果说明,虽然Tscm富集的CAR-T细胞的抗肿瘤疗效并未显著优于非诱导的CAR-T细胞,但其CD8+T细胞在体内存活数量明显增多,提示从抗肿瘤持久性上,可能具有一定的生存获益。
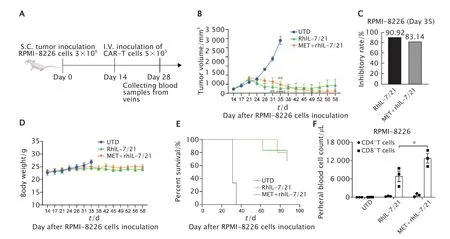
Fig.5 A: Schematic diagram of murine subcutaneous xenografts of multiple myeloma RPMI-8226 cells.The effect of MET-induced chimeric antigen receptor (CAR)-T cells on the tumor growth (B-C),body weight(D) and survival (E).The effect of MET-induced CAR-T cells on the number of lymphocytes in murine peripheral blood tested by flow cytometry (FCM) (F).*P<0.05,**P<0.01,****P<0.000 1,vs UTD group [n=6(B-E) or n=3 (F)].图5 NPG小鼠RPMI-8226细胞皮下移植瘤模型建立的示意图(A),二甲双胍诱导的CAR-T细胞对小鼠体内肿瘤的抑制作用(B和C)、小鼠体质量(D)和小鼠生存期的影响(E),FCM检测二甲双胍对小鼠外周血中淋巴细胞数量的影响(F)
3 讨论
Tscm在抗肿瘤应答的许多环节都起着非常重要的作用,Tscm具有高增殖和多向分化的特点。目前,在CAR-T细胞输注之前将具有细胞毒性的CD8+T细胞重编程为具有干性的细胞是细胞治疗领域的热点之一。大部分过继性T细胞治疗的临床试验均采用T细胞的集合而不是特定的T细胞亚群,所以在向患者输注细胞治疗产品之前,尽量提高Tscm比例非常必要。体外通过调节Notch或Wnt信号通路诱导Tscm富集的T细胞显示出更强的抗肿瘤能力,优于其他记忆T细胞亚群[19,23]。本研究的结果表明,二甲双胍体外处理后的CAR-T细胞分化程度低,其Tscm亚群所占百分比升高,并且经过体外靶细胞多轮刺激后仍能保持Tscm富集,提示二甲双胍在体内可能有利于CAR-T细胞的存活。
二甲双胍促进Tscm生成的具体机制尚未被完全阐明。在线粒体水平,二甲双胍通过抑制ETC从而抑制氧化磷酸化,导致AMP水平升高及AMPK的磷酸化,激活后的AMPK能够抑制mTOR活性[24-26]。AMPK-mTOR通路在许多生物过程中普遍存在,因此二甲双胍的作用并不特异,其在不同细胞和不同器官中起不同作用。例如,二甲双胍在固有和适应性免疫系统中发挥着抑瘤作用,包括促进M2巨噬细胞向M1巨噬细胞极化、抑制骨髓来源的抑制性细胞和调节性T细胞的作用、减少抗炎性细胞因子的生成和提高T细胞的应答水平[22,27-30]。AMPK-mTOR通路也作用于T细胞代谢重编程,即将糖酵解转化为氧化磷酸化,对于T细胞保持杀伤功能和记忆性非常重要[14,31]。AMPK激活过氧化物酶体增殖物激活受体γ共激活因子1(peroxisome proliferatoractivated receptorγcoactivator-1,PGC-1),可以使肿瘤浸润的细胞毒性T细胞进行代谢重编程,增强线粒体功能和免疫应答[32]。mTOR的抑制可促进记忆T细胞形成过程中的氧化磷酸化,对维持线粒体正常功能非常关键[17,33-34]。上述研究结果提示,二甲双胍可能通过激活的AMPK-mTOR通路来抑制T细胞糖酵解,从而增强T细胞记忆表型,然而二甲双胍诱导后的CAR-T细胞的代谢改变仍需进一步予以阐明。
本研究中的荷瘤小鼠模型实验结果显示,二甲双胍诱导的CAR-T细胞能够显著抑制肿瘤生长,并保持更高的外周血CD8+T细胞的存活,且能带来一定程度的生存期受益,这一研究说明二甲双胍能在保持CAR-T杀伤功能的同时延长CAR-T细胞在体内的存活时间。然而本研究中也发现,在人MM免疫缺陷小鼠皮下移植瘤模型中,给予靶向BCMA的二代CAR-T细胞进行治疗,二甲双胍诱导获得的Tscm富集的CAR-T细胞虽能显著抑制肿瘤生长,甚至清除肿瘤,但与诱导前的CAR-T细胞相比,未能显示出更强的抗肿瘤能力,尤其在CAR-T细胞输注的初期,二甲双胍诱导后的CAR-T细胞抑瘤效果反而不及对照组。究其原因可能是二甲双胍除了诱导Tscm产生外,在培养过程中也会导致CAR-T细胞的凋亡,进而可能影响CAR-T细胞的抗肿瘤作用,但二甲双胍对T细胞的作用仍需进一步深入研究。虽然二甲双胍体外可诱导产生更多的Tscm,但这种诱导产生的Tscm可能与人体内自然生成的Tscm功能上仍存在差异;即使未经二甲双胍诱导,CAR-T细胞中仍存在一定比例的Tscm,且具有显著的抑瘤效果,由此推测本研究所使用的动物模型中,Tscm起效的比例可能存在一定的阈值,在此范围内CAR-T细胞抑瘤效果差异不显著,但本研究数据仍然显示Tscm富集的CAR-T细胞治疗后的小鼠外周血中的CD8+T细胞存活数量显著增多,且治疗的小鼠具有一定的生存获益。因此,后续有必要针对不同靶点、不同肿瘤负荷、不同肿瘤模型来进一步深入研究。
本研究中主要发现,在体外一定浓度的二甲双胍可以诱导CAR-T细胞更多地分化为Tscm表型。有研究表明,二甲双胍能延长部分肿瘤合并糖尿病患者的生存期[35],且对肿瘤免疫微环境有积极地调节作用,因此推测体内实验中如果将二甲双胍与CAR-T细胞联合应用于治疗,是否也可诱导Tscm的富集进而增强CAR-T细胞的抗肿瘤能力?此外,也有研究报道,在动物实验中口服高浓度二甲双胍可抑制T细胞的增殖,对T细胞过继治疗产生不利影响[36]。因此,后续探究的重点是进一步明确体内不同浓度二甲双胍对T细胞分化和功能的不同作用,探索联合口服二甲双胍是否能增强Tscm富集的CAR-T细胞的疗效。
综上,本研究提供了一种体外可以诱导Tscm富集的方式,证明了二甲双胍体外可以诱导CAR-T细胞产生更多Tscm亚群,经Tscm富集型CAR-T细胞治疗后的荷瘤小鼠具有一定的生存优势,且外周血中CD8+T细胞的存活数量显著增多。整个实验过程中未观察到明显不良反应。本研究有望为更优的CAR-T细胞制备提供一种新的途径,具有一定的理论指导价值。
