E1B-55kDa基因缺陷型溶瘤腺病毒H101体外和体内抑制结肠癌HCT-116细胞增殖
2021-10-28卞京李夏伊郑于铭徐文晖朱美玲郑磊贞
卞京,李夏伊,郑于铭,徐文晖,朱美玲,郑磊贞
结直肠癌(colorectal cancer,CRC)是全球第3大常见的恶性肿瘤和第2大常见的肿瘤死亡原因[1],全球每年死于结直肠癌的病例数约90万[2],约占全部癌症及癌症相关死因的10%,严重威胁人类健康。近年来,我国结直肠癌的发病率和死亡率均呈快速上升的趋势,传统化疗药物的使用效果进入瓶颈期。结肠癌的治疗经历了从单纯化疗到分子靶向药物和免疫治疗药物的过渡。因此,寻求新的、更加有效的针对晚期结肠癌的治疗方案变得刻不容缓。随着个体化、精准化医疗时代的到来,溶瘤病毒治疗方案正成为结肠癌研究的新方向[3]。
溶瘤病毒是一种具有高效复制能力的肿瘤杀伤型病毒,能特异性识别并感染杀伤肿瘤细胞。2006年,经改良的腺病毒溶瘤病毒缺陷型溶瘤腺病毒H101在中国被批准用于治疗头颈部鳞状细胞癌[4]。缺陷型溶瘤腺病毒H101是世界上首个被批注上市的溶瘤病毒类药物[5],其能特异性地杀灭肿瘤细胞,但对正常组织并不会不造成伤害,避免了常规放疗和化疗等由于选择性差而引起的造血功能抑制、脱发以及肝肾功能损害等不良反应。缺陷型溶瘤腺病毒H101由5型腺病毒通过基因工程改造而成,通过删除E1B区编码的55 kDa蛋白的序列(E1B-55kDa)和E3区78.3~85.8 μm的基因片段,降低了病毒的复制能力。
既往研究发现,缺陷型溶瘤腺病毒H101在体外可抑制食管癌[6-7]、葡萄膜黑素瘤[8-9]、肝癌[10-12]以及肺癌[13]等肿瘤细胞的增殖并诱导肿瘤细胞的死亡。然而,缺陷型溶瘤腺病毒H101对结肠癌细胞的抗肿瘤作用目前尚不清楚。因此,本研究选择结肠癌HCT-116、SW480和RKO细胞作为研究对象,用E1B-55kDa基因缺陷型溶瘤腺病毒H101感染各株细胞后,检测缺陷型溶瘤腺病毒H101对结肠癌细胞的增殖、细胞形态、迁移、侵袭和细胞周期等的影响,以评估其在体外的抗肿瘤作用;并通过建立结肠癌HCT-116细胞的裸鼠皮下移植瘤模型,进一步验证其在体内的抗肿瘤作用。本研究为阐明溶瘤腺病毒缺陷型H101参与结直肠癌发生和发展的生物学机制提供重要的理论依据,并为今后采用新的、有效的结直肠癌治疗方法提供了新的方向。
1 材料与方法
1.1 细胞和实验动物
结肠癌HCT-116、SW480和RKO细胞购自中国科学院典型培养物保藏委员会细胞库。BALB/c裸鼠、3~4周龄、雄性购自上海吉辉实验动物饲养有限公司[实验动物生产许可证号:SCXK(沪)2017-0012]。
1.2 试剂和仪器
重组人5型腺病毒注射液(H101)由上海三维生物技术有限公司惠赠。胎牛血清(fetal bovine serum,FBS)、青链霉素、含EDTA的胰蛋白酶和二甲亚砜(DMSO)购自美国Gibco公司,DMEM高糖培养液购自美国HyClone公司。CCK-8试剂盒、BCA蛋白定量试剂盒、细胞周期检测试剂盒、4%多聚甲醛溶液、结晶紫染液、RIPA裂解液、PMSF、快速封闭液、抗体稀释液、SDS-PAGE凝胶配制试剂盒购自中国碧云天公司。预染蛋白Marker购自美国Thermo公司。鼠抗人Hexon单克隆抗体购自美国Santa公司,兔抗人GAPDH(内参照)多克隆抗体购自美国Bioworld公司。TBST购自生工生物工程(上海)股份有限公司,PVDF膜和电化学发光液购自美国Millipore公司,Transwell小室购自美国Corning公司,基质胶购自美国BD公司。
流式细胞分析仪(型号:B49007AD)为美国BD公司产品,化学发光成像仪(型号:ChemidocXRS+Gel 3004081)为美国Bio-Rad公司产品。
1.3 细胞培养
结肠癌HCT-116、SW480和RKO细胞株用含10% FBS和1%青链霉素的DMEM高糖培养液,置于37 ℃、CO2体积分数为5%的细胞培养箱中进行培养。待细胞融合度达80%~90%时,用胰蛋白酶消化细胞,离心重悬后进行传代处理,取对数生长期、状态良好的细胞用作后续实验。
1.4 病毒感染
将细胞接种于96孔、6孔、12孔板或直径为60 mm的培养皿中,置于37 ℃、CO2体积分数为5%的细胞培养箱中培养过夜,第2天换成含不同效价(1.0×106、2.5×106、5.0×106、7.5×106和1.0×107vp/mL)缺陷型溶瘤腺病毒H101的培养液,对照组为加入不含病毒的培养液。
1.5 CCK-8法检测细胞的生存能力
将对数生长期的HCT-116、SW480和RKO细胞接种于96孔板中,5×103个细胞/孔。将96孔板置于37 ℃、CO2体积分数为5%的细胞培养箱中培养过夜,至细胞贴壁生长。实验设立实验组、对照组及空白组:实验组为待细胞贴壁生长后,除去培养液,换为含不同效价(1.0×106、2.5×106、5.0×106、7.5×106和1.0×107vp/mL)缺陷型溶瘤腺病毒H101的培养液处理细胞;对照组为待细胞贴壁生长后,除去培养液,加入不含病毒的培养液处理细胞;空白组中不接种细胞仅加入不含病毒的培养液;每孔培养液的体积为100 μL,每组设置3个复孔。病毒感染24、48和72 h后,分别除去培养液,加入10 μL CCK-8试剂;在培养箱中避光处理2 h后取出96孔板,在酶联免疫检测仪波长450 nm波长处测量各孔的D值,并计算各组细胞的存活率。细胞存活率(%)=(实验组D值-空白组D值)/(对照组D值-空白组D值)×100%。
1.6 细胞形态学分析
取处于对数生长期的HCT-116细胞(5×105个)接种到直径为60 mm的培养皿中,待细胞贴壁后,将细胞分为实验组和对照组,实验组中加入含效价为1.0×107vp/mL的缺陷型溶瘤腺病毒H101培养液,对照组中加入不含病毒的培养液;将细胞置于37 ℃、CO2体积分数为5%的细胞培养箱中培养72 h后,在光学显微镜下观察各组细胞的形态,并对实验结果进行拍照。
1.7 细胞集落形成实验
将处于对数生长期的HCT-116细胞(5×105个)接种至60 mm 的培养皿中,待细胞贴壁后,将细胞分为实验组和对照组,实验组中加入含效价为1.0×106和2.5×106vp/mL的缺陷型溶瘤腺病毒H101培养液,对照组中加入不含病毒的培养液。将细胞置于37 ℃、CO2体积分数为5%的细胞培养箱中培养48 h后,将细胞接种于6孔板中(500个细胞/孔)。将6孔板置于培养箱中培养,每天在光学显微镜下观察细胞集落形成情况。待观察到大部分细胞集落所含细胞数>50个时,终止培养。弃去培养液,用PBS清洗2次后,加入4%多聚甲醛溶液固定细胞15 min;除去4%多聚甲醛溶液,用PBS清洗2次后,加入结晶紫染液染色15 min;除去结晶紫染液,清水洗净,空气干燥后,拍照并计数细胞集落数。
1.8 蛋白质印迹法检测Hexon蛋白的表达水平
取处于对数生长期的HCT-116细胞(5×105个)接种至60 mm 的培养皿中,待细胞贴壁后,将细胞分为实验组和对照组,实验组中加入含效价为1.0×107vp/mL的缺陷型溶瘤腺病毒H101培养液,对照组中加入不含病毒的培养液。将2组细胞置于37 ℃、CO2体积分数为5%的细胞培养箱中培养72 h后,提取细胞总蛋白,并用BCA试剂盒检测蛋白浓度。每孔加入20 μg蛋白样品,进行SDS-PAGE(分离胶浓度为10%)分离蛋白。电泳结束后,采用湿转法将分离后的蛋白转移至PVDF膜上,然后用快速封闭液封闭15 min。随后,分别加入一抗[鼠抗人Hexon单克隆抗体(体积稀释比例为1∶1 000),兔抗人GAPDH(内参照)多克隆抗体(体积稀释比例为1∶5 000)] 4 ℃条件下反应过夜;次日用TBST清洗膜3次,每次10 min,室温下加入二抗[辣根过氧化物酶标记的羊抗鼠或羊抗兔IgG(体积稀释比例均为1∶5 000)],置于摇床上室温条件下孵育1 h,再用TBST清洗3次,每次10 min。配制并滴加电化学发光液,经Bio-Rad成像系统显影,采用Image Lab 5软件对蛋白条带进行灰度值分析。
1.9 Transwell小室实验检测缺陷型溶瘤腺病毒H101对HCT-116细胞迁移和侵袭能力的影响
取处于对数生长期的HCT-116细胞(5×105个)接种至60 mm 的培养皿中,待细胞贴壁后,将细胞分为实验组和对照组,实验组加入含效价为1.0×106和2.5×106vp/mL的缺陷型溶瘤腺病毒H101培养液,对照组中加入不含病毒的培养液。将各组细胞置于37 ℃、CO2体积分数为5%的细胞培养箱中培养48 h后,消化计数,调整细胞密度为2.5×105个/mL;在小室的上室中接种200 μL不含FBS的细胞悬液,小室的下室中加入600 μL含FBS的培养液。将小室置于胞培养箱中培养24 h后,取出小室,除去上层液体,加入4%多聚甲醛溶液固定细胞20 min后,PBS清洗2次。用棉签将上室中未穿过小室膜的细胞轻柔擦去,加入结晶紫染液染色15 min。清水洗净,空气干燥后,拍照,每个小室选取3个视野。
细胞侵袭实验中,提前将基质胶与无血清培养液按1∶7的体积稀释比例稀释后,以每孔100 μL的体积均匀铺于Transwell小室的上室膜上,置于37 ℃细胞培养箱中静置4~5 h,待其凝固成膜后行小室侵袭实验,其余操作同细胞迁移实验。
1.10 FCM法检测缺陷型溶瘤腺病毒H101对细胞周期的影响
取处于对数生长期的HCT-116细胞(5×105个)接种至60 mm 的培养皿中,待细胞贴壁后,将细胞分为实验组和对照组,实验组加入含效价为1.0×107vp/mL的缺陷型溶瘤腺病毒H101培养液,对照组中加入不含病毒的培养液。将2组细胞置于37 ℃、CO2体积分数为5%的细胞培养箱中培养72 h后消化细胞,离心后收集细胞,用预冷的PBS洗涤细胞2遍;缓慢加入700 μL预冷的无水乙醇溶液,于-20 ℃条件下固定过夜。收集细胞,用预冷的PBS洗涤细胞,加入碘化丙啶染色液,37 ℃避光处理30 min后上流式细胞仪检测细胞周期。
1.11 构建裸鼠皮下移植瘤模型
14只3~4周龄的雄性BALB/c裸鼠在室温25 ℃、相对湿度为40%~70%、12 h光-暗交替的环境下适应性喂养7 d后,构建皮下移植瘤模型。将处于对数生长期且生长状态良好的结肠癌HCT-116细胞消化和离心后,用无血清的DMEM高糖培养液重悬细胞,并将细胞悬液调整为5×107个/mL,置于冰上备用。选取裸鼠右侧臀部上方皮下位置作为进针点,常规皮肤消毒后,缓慢推注100 μL肿瘤细胞悬液(5×106个HCT-116细胞),观察并记录裸鼠皮下移植瘤的生长情况。细胞接种4 d后,皮下种植瘤体积达到80 mm3时开始给药,采用随机分组的方法,将小鼠分为2组,每组7只。根据既往研究结果给药:实验组每天瘤内注射缺陷型溶瘤腺病毒H101(1×1010vp/只),第5~第9天;对照组每天瘤内注射等体积的PBS,第5~第9天。每2 d用体重计测量裸鼠的体质量,每2 d用游标卡尺测量肿瘤长径(a)和肿瘤短径(b),并计算肿瘤体积(VT)(VT=0.5×a×b2)。治疗结束后,第14天时处死所有裸鼠,从皮下尽可能完整地剥取肿瘤组织,电子天平上称取肿瘤质量,并计算抑瘤率,抑瘤率(%)=(对照组平均肿瘤质量-实验组平均肿瘤质量)/对照组肿瘤质量×100%。
将取得的新鲜肿瘤组织置于甲醛溶液中固定,由上海睿宝和生物科技有限公司进行HE染色,并采用免疫组织化学法检测Ki-67和血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达情况。
1.12 统计学方法
所有实验数据采用GraphPad Prism 7软件进行统计处理分析。所有实验均独立重复3次,计量资料以表示。2组间比较采用独立样本t检验;多组间首先采用单因素方差分析,再行组内两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 缺陷型溶瘤腺病毒H101降低结肠癌HCT-116细胞的生长活力
用不同效价(1.0×106、2.5×106、5.0×106、7.5×106和1.0×107vp/mL)的缺陷型溶瘤腺病毒H101作用于HCT-116、SW480和RKO细胞24、48和72 h后,采用CCK-8法检测对结肠癌增殖的影响。结果(图1A)显示,缺陷型溶瘤腺病毒H101能明显抑制HCT-116细胞的存活率(P均<0.05),且呈一定的浓度依赖性和时间依赖性;而SW480和RKO细胞中,相较与对照组,仅在缺陷型溶瘤腺病毒H101效价较高(1.0×107vp/mL)和作用时间较长(72 h)的情况下,细胞的增殖被抑制,差异有统计学意义(P<0.05)。因此,本研究选用更敏感的结肠癌HCT-116细胞进行后续实验。
采用效价为1.0×107vp/mL的缺陷型溶瘤腺病毒H101处理HCT-116细胞72 h后,在光学显微镜下观察细胞形态学变化。结果(图1B)显示,对照组中HCT-116细胞呈贴壁生长状态且生长迅速,细胞与细胞间的间隙较窄,细胞的胞质饱满,胞膜清晰;而缺陷型溶瘤腺病毒H101感染后HCT-116细胞与细胞间的间隙增宽,细胞密度降低,细胞数目不断减少,细胞失去正常形态,悬浮细胞数目增多,并出现细胞破裂导致膜内容物流出的现象。
为进一步观察缺陷型溶瘤腺病毒H101对HCT-116细胞增殖的抑制作用,根据CCK-8法检测结果,采用低效价的缺陷型溶瘤腺病毒H101(1.0×106和2.5×106vp/mL)进行细胞集落形成实验。检测结果(图1C)显示,对照组、缺陷型溶瘤腺病毒(1.0×106vp/mL)组、缺陷型溶瘤腺病毒(2.5×106vp/mL)组的克隆形成数分别为(438.67±16.50)个、(196.67±18.77)个 和(72.67±2.08)个。与对照组相比,不同效价的缺陷型溶瘤腺病毒H101的集落形成能力均受到不同程度的抑制,差异有统计学意义(P均<0.001)。
为进一步验证缺陷型溶瘤腺病毒H101在结肠癌HCT-116细胞中的感染效率,用效价为1.0×107vp/mL的缺陷型溶瘤腺病毒H101感染HCT-116细胞72 h后,采用蛋白质印迹法检测HCT-116细胞中腺病毒衣壳蛋白Hexon的表达情况。结果(图1D)显示,与对照组相比,Hexon在缺陷型溶瘤腺病毒H101感染的HCT-116细胞中高表达,差异具有统计学意义(P<0.001)。这一结果提示,缺陷型溶瘤腺病毒H101可在结肠癌HCT-116细胞中有效表达。
2.2 缺陷型溶瘤腺病毒H101抑制HCT-116细胞的迁移与侵袭
用效价为1.0×106和2.5×106vp/mL的缺陷型溶瘤腺病毒H101处理HCT-116细胞48 h后,采用Transwell小室实验检测细胞的迁移和侵袭能力(图2)。细胞迁移实验检测结果显示,对照组中每视野下发生迁移的细胞数为(203.67±10.21)个,而效价为1.0×106vp/mL和2.5×106vp/mL缺陷型溶瘤腺病毒H101感染组中发生迁移的细胞数为(123.50±15.63)个和(79.50±2.63)个;与对照组相比,缺陷型溶瘤腺病毒H101感染组发生迁移的细胞数均明显降低,差异有统计学意义(P均<0.001)。
细胞侵袭实验检测结果显示,对照组中每视野下发生侵袭的细胞数为(156.00±14.11)个,而效价为1.0×106vp/mL和2.5×106vp/mL缺陷型溶瘤腺病毒H101感染组中发生侵袭的细胞数为(86.33±8.50)个和(37.33±5.86)个;与对照组相比,缺陷型溶瘤腺病毒H101感染组发生侵袭的细胞数均明显降低,差异具有统计学意义(P均<0.001)。上述结果提示,缺陷型溶瘤腺病毒H101感染结肠癌HCT-116细胞后,能明显抑制结肠癌细胞的迁移及侵袭能力。
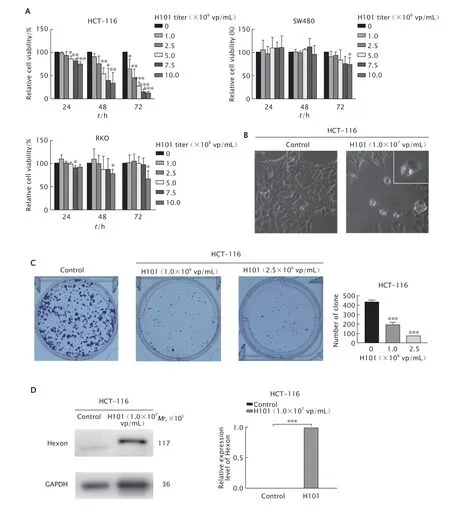
Fig.1 The cell viabilities of colon cancer HCT-116,SW480 and RKO cells treated with different virus titers (1.0×106,2.5×106,5.0×106,7.5×106 and 1.0×107 vp/mL) of defective oncolytic adenovirus H101 for 24,48 and 72 h were detected by CCK-8 assay (A).The cell morphology of HCT-116 cells treated with defective oncolytic adenovirus H101 (1.0×107 vp/mL) for 72 h was observed under a light microscope (B).The colony formation ability of HCT-116 cells treated with defective oncolytic adenovirus H101 (1.0×106 and 2.5×106 vp/mL) for 48 h was detected by colony formation assay (C).The expression level of adenovirus Hexon protein in HCT-116 cells treated with defective oncolytic adenovirus H101 (1.0×107 vp/mL) for 72 h was detected by Western blotting (D).HCT-116 cells were treated without any drugs as the control.*P<0.05,**P<0.01,***P<0.001,vs the control group (n=3).图1 分别采用CCK-8法(A)、细胞形态学分析(B)和细胞集落形成实验(C)检测缺陷型溶瘤腺病毒H101对结肠癌细胞增殖的影响以及蛋白质印迹法检测腺病毒衣壳蛋白Hexon在HCT-116细胞中的表达情况(D)
2.3 缺陷型溶瘤腺病毒H101阻滞HCT-116细胞的细胞周期
采用FCM法检测缺陷型溶瘤腺病毒H101对HCT-116细胞周期的影响。用效价为1.0×107vp/mL的缺陷型溶瘤腺病毒H101处理HCT-116细胞72 h后,结果(图3)显示对照组中S期细胞所占百分比为(6.82±3.33)%,而缺陷型溶瘤腺病毒H101感染组S期细胞所占百分比为(20.85±2.04)%;与对照组相比,缺陷型溶瘤腺病毒H101感染组S期细胞所占百分比明显升高,差异具有统计学意义(P<0.01)。这一结果提示,缺陷型溶瘤腺病毒H101可将HCT-116细胞的细胞周期阻滞在S期。
2.4 缺陷型溶瘤腺病毒H101抑制裸鼠皮下移植瘤的生长
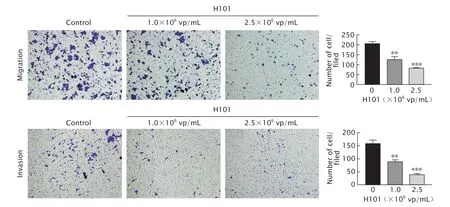
Fig.2 The migration and invasion abilities of HCT-116 cells treated with defective oncolytic adenovirus H101 (1.0×106 and 2.5×106 vp/mL) for 48 h were detected by Transwell chamber assay (crystal violet staining,×100).HCT-116 cells were treated without any drugs as the control.**P<0.01,***P<0.001,vs the control group (n=3).图2 Transwell小室实验检测缺陷型溶瘤腺病毒H101处理后对结肠癌细胞HCT-116细胞迁移和侵袭能力的影响
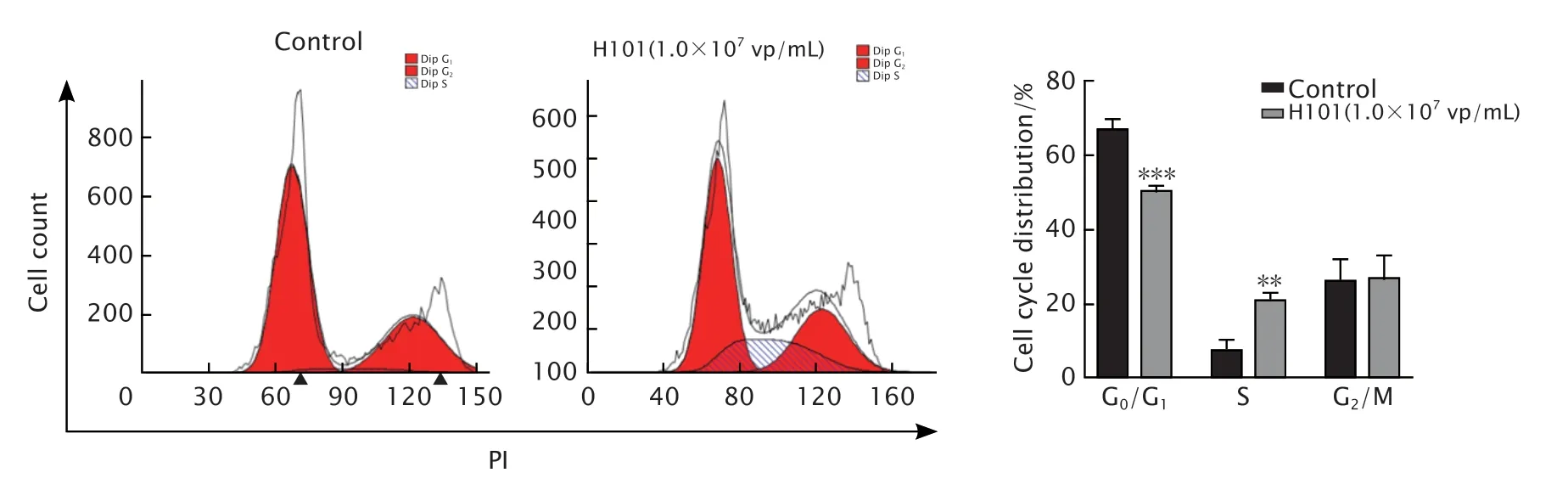
Fig.3 The cell cycle distribution of HCT-116 cells treated with defective oncolytic adenovirus H101(1.0×107 vp/mL) for 72 h was detected by FCM method.HCT-116 cells were treated without any drugs as the control.**P<0.01,***P<0.001,vs the control group (n=3).图3 FCM法检测缺陷型溶瘤腺病毒H101对HCT-116细胞周期的影响
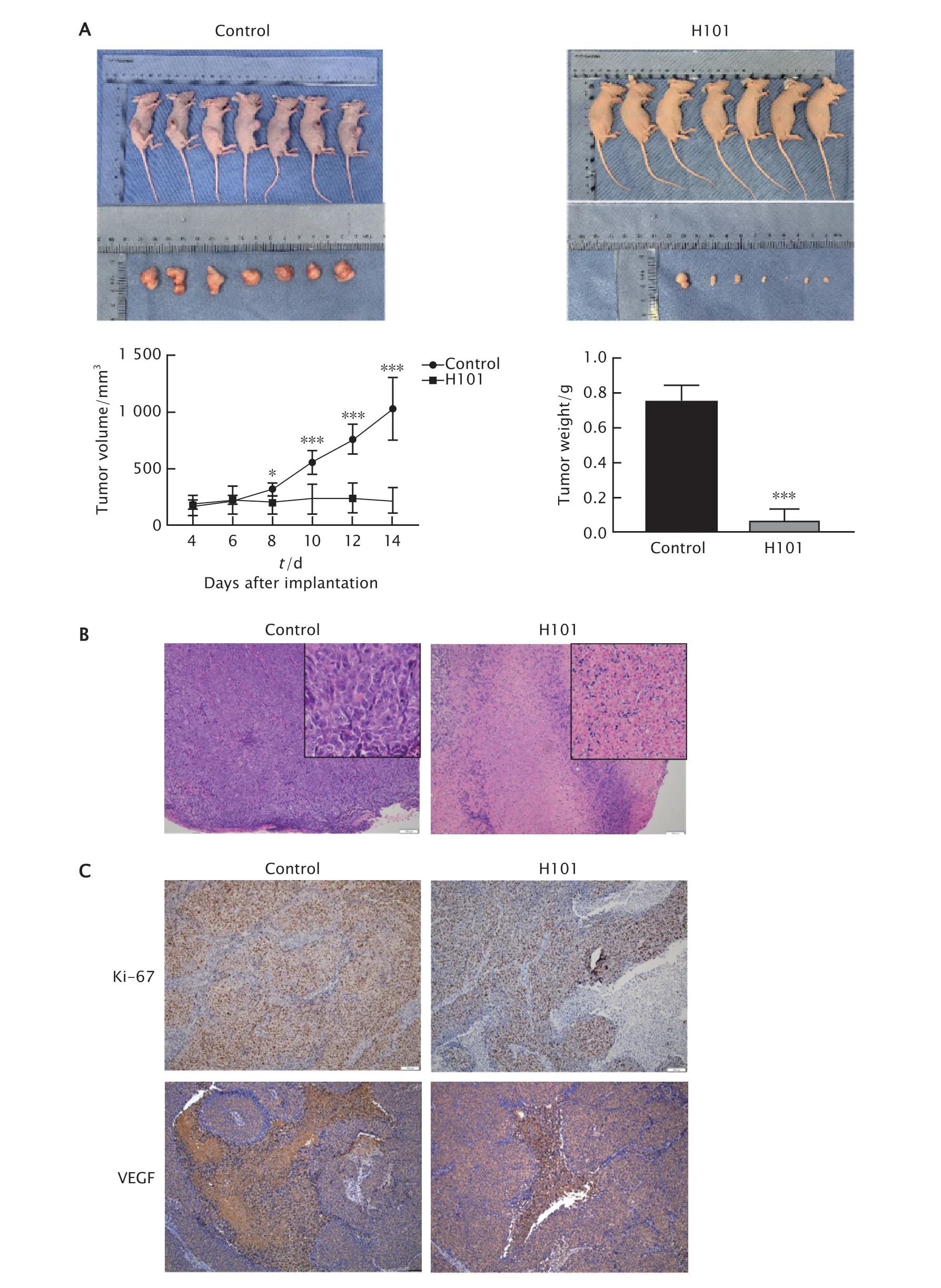
Fig.4 The growth of HCT-116 cell xenograft tumor in nude mice was inhibited by defective oncolytic adenovirus H101.A: The gross picture of HCT-116 cell xenograft tumor mice;The tumor volume and tumor weight of HCT-116 cell xenograft tumor mice;B: The HE staining result (×100) of tumor tissues;C: The expression levels of Ki-67 and VEGF were detected by immunohistochemistry (DAB staining,×100).H101 group: The nude mice bearing HCT-116 cell xenograft tumor treated with defective oncolytic adenovirus H101 (intratumoral injection,1.0×107 vp/piece);Control group: The nude mice bearing HCT-116 cell xenograft tumor treated with PBS (intratumoral injection,1.0×107 vp/piece).*P<0.05,***P<0.001,vs the control group (n=7).图4 缺陷型溶瘤腺病毒H101抑制裸鼠皮下移植瘤的生长
构建裸鼠皮下移植瘤模型,进一步观察缺陷型溶瘤腺病毒H101对结肠癌抑制作用。结果(图4A)显示,与对照组相比,缺陷型溶瘤腺病毒H101能明显抑制HCT-116细胞裸鼠皮下移植瘤的生长。绘制裸鼠皮下移植瘤生长曲线图,结果显示,第14天时缺陷型溶瘤腺病毒H101治疗组裸鼠皮下移植瘤体积为(221.76±119.40)mm3,明显小于对照组的(1 027.86±277.54)mm3,差异具有统计学意义(P<0.001)。缺陷型溶瘤腺病毒H101组裸鼠皮下移植瘤质量为(0.054 9±0.080 1)g,明显小于对照组的(0.711 2±0.125 5)g,差异具有统计学意义(P<0.001)。计算结果显示,缺陷型溶瘤腺病毒H101的抑瘤率为92.28%。上述结果表明,缺陷型溶瘤腺病毒H101显著抑制裸鼠皮下移植瘤的体内生长,具有很好的体内抗肿瘤作用。
皮下移植瘤组织经HE染色后,光学显微镜镜下观察发现(图4B),对照组肿瘤组织中以实体肿瘤组织为主,肿瘤细胞弥漫分布,有大量炎症细胞浸润,坏死区域极少,肿瘤组织中心可见大量血管增生。而缺陷型溶瘤腺病毒H101治疗组肿瘤组织中可见细胞大面积坏死,细胞核异型性明显,大量细胞核消失留下残影,可见大面积炎症细胞浸润。
应用免疫组织化学法检测移植瘤中Ki-67和VEGF的表达情况(图4C)。结果显示对照组肿瘤组织中Ki-67蛋白阳性细胞分布较广,而缺陷型溶瘤腺病毒H101干预后,肿瘤组织中Ki-67蛋白阳性表达的细胞数明显减少;这一结果说明,缺陷型溶瘤腺病毒H101能明显抑制肿瘤细胞增殖,使肿瘤组织生长减弱。应用免疫组织化学法检测移植瘤中VEGF蛋白的表达情况,结果显示对照组结肠癌移植瘤内VEGF表达阳性细胞的分布较广,而缺陷型溶瘤腺病毒H101干预后,VEGF阳性表达的细胞数明显减少;这一结果说明,缺陷型溶瘤腺病毒H101明显抑制肿瘤组织中血管生成。
3 讨论
溶瘤腺病毒是一种直径为70~90 nm、基因组大小为25~45×103bp的无包膜的双链DNA病毒[14]。在正常细胞被腺病毒感染时,会表达与病毒复制有关的早期基因E1A和E1B。其中E1A可调节视网膜母细胞瘤相关蛋白(retinoblastoma associated protein,Rb)。E1B编码的一种大小为55 kDa的蛋白(E1B-55kDa),其可以使细胞抑癌基因p53失活,从而有利于病毒复制。缺陷型溶瘤腺病毒H101是一种重组人5型腺病毒,删除了E1B区编码55kD蛋白的序列和E3区78.3~85.8 μm的基因片段,降低了病毒的复制能力[5]。
细胞增殖与细胞死亡的调控失衡是细胞发生恶变的核心。正常细胞可以通过调控促生长信号的产生和释放,维持正常的结构和功能;而肿瘤细胞逃避正常的信号调控,呈现无限增殖的状态。因此,抑制肿瘤细胞增殖、促进肿瘤细胞死亡是治疗肿瘤的重要方式。本研究结果显示,缺陷型溶瘤腺病毒H101感染HCT-116细胞后,细胞的生长活力和集落形成能力被显著抑制,提示肿瘤细胞的增殖能力被大大减弱。进一步检测其迁移及侵袭能力,发现缺陷型溶瘤腺病毒H101感染后HCT-116细胞的迁移及侵袭能力明显降低。破坏宿主细胞的复制周期,是许多病毒用来创建有利于病毒复制的细胞环境的常用策略。研究发现,异常的细胞周期控制和E1A的表达与溶瘤腺病毒活性之间关系密切,功能失调的细胞周期有利于提高溶瘤腺病毒的功效[15]。LEI等[13]研究发现,H101可通过细胞周期停滞和细胞坏死诱导对肺癌XWLC-05细胞的细胞毒性作用;SONG等[16]研究发现,H101在视网膜母细胞瘤HXO-RB44细胞中大量复制,其杀伤肿瘤和抑制生长的作用与H101导致的细胞G2/M期停滞并直接裂解肿瘤细胞有关,这与CHERΜBINI等[17]的研究结果一致。本研究发现,缺陷型溶瘤腺病毒H101感染过的HCT-116细胞,S期细胞所占百分比明显增加,提示H101可能通过使细胞停滞在S期抑制结肠癌细胞的增殖,从而达到抗肿瘤的作用。上述结果表明,E1B-55kDa缺陷型溶瘤腺病毒H101对HCT-116细胞具有明显的体外抗肿瘤作用。
根据体外研究结果,本研究进一步构建了裸鼠皮下移植瘤模型,以观察缺陷型溶瘤腺病毒H101对结肠癌细胞体内抗肿瘤作用。采用BALB/c裸鼠作为荷瘤动物,剔除了免疫系统对病毒抗肿瘤效能的影响,可直接观察病毒的抗肿瘤作用。溶瘤病毒的给药途径通常包括瘤内注射、静脉内注射和腹膜内注射等[18]。瘤内注射多用于实体肿瘤的治疗,是溶瘤病毒最常用的给药方式,目前已在多项Ⅲ期临床试验中证明有效[19],但该方法存在操作复杂、介入昂贵和不良反应多等缺点。静脉内注射多用于转移性肿瘤患者、血液治疗患者或者对血清中的抗体有抵抗力的患者,但该方法的不足之处在于,溶瘤病毒不能直接到达病灶,需经过血液的稀释且易被肝脏、脾脏等器官和血清中的抗体中和杀伤,导致其在病灶中难以达到有效浓度,此外,静脉内注射还可能引起全身扩散,引发严重感染。一项针对瘤内注射及静脉内注射有效性和安全性进行分析的Meta分析发现,瘤内注射的给药方式对疗效有显著改善(P=0.000 2),而静脉注射无显著改善(P=0.99)[20]。因此,本实验选用瘤内注射进行H101的治疗。
缺陷型溶瘤腺病毒H101瘤内注射的裸鼠瘤体的生长速度明显比对照组减缓。肿瘤组织HE染色后观察发现,对照组肿瘤组织以实体肿瘤组织为主,肿瘤组织内未见明显坏死;而缺陷型溶瘤腺病毒H101治疗组中可见大面积细胞坏死,细胞核异型性明显,大量细胞核消失留下残影,其内可见大量炎性细胞浸润。缺陷型溶瘤腺病毒H101瘤内注射组肿瘤组织中Ki-67阳性表达细胞分布明显降低,这一结果表明缺陷型溶瘤腺病毒H101能显著抑制肿瘤细胞的增殖,这一结果与体外细胞实验结果相符。有研究发现,溶瘤病毒可影响肿瘤的脉管系统,促进肿瘤内血管萎缩,并具有抗血管生成作用[21]。被病毒感染的肿瘤细胞分泌促炎细胞因子,其中中性粒细胞的浸润可导致血栓形成、急性缺血和肿瘤细胞死亡[22]。此外,痘苗病毒株能够在肿瘤相关的内皮细胞内感染并复制,从而直接导致内皮细胞的破坏和血管塌陷,肿瘤内出现缺氧和大量坏死[23],这在晚期肝细胞癌临床实验中得到了证实。除了促进肿瘤内血管萎缩外,溶瘤病毒具有抗肿瘤血管生成特性,被感染的肿瘤内VEGF表达水平被明显降低[24]。有研究显示,一种新型的,表达FP3(VEGF诱饵受体)的溶瘤腺病毒(RdB/FP3/Ad)可大大降低VEGF的表达水平和血管密度并增加肿瘤内皮细胞和肿瘤细胞的凋亡,有效抑制VEGF介导的肿瘤血管生成作用[25]。本研究发现,经缺陷型溶瘤腺病毒H101瘤内注射后的肿瘤组织中VEGF蛋白阳性表达细胞的分布明显降低,这一结果同样提示缺陷型溶瘤腺病毒H101具有抗肿瘤血管生成的作用。因此,通过体内实验同样表明,E1B-55kDa基因缺陷型溶瘤腺病毒H101可抑制结肠癌HCT-116细胞的增殖,具有抗肿瘤作用。
综上所述,E1B-55kDa基因缺陷型溶瘤腺病毒H101对结肠癌HCT-116细胞具有显著的体内和体外抗肿瘤作用,是一个潜在的抗肿瘤药物,其在结肠癌临床治疗中可能有良好的应用前景。
