用Ion Torrent半导体测序技术对血友病B家系F9基因行突变分析及产前诊断
2021-10-28刘安马定远刘刚林颖李璃许争峰钟天鹰
刘安,马定远,刘刚,林颖,李璃,许争峰,钟天鹰
(南京医科大学附属妇产医院&南京市妇幼保健院a.产前诊断中心,b.检验科,南京210004)
血友病B(hemophilia B, HB)是一种X连锁隐性遗传性出血性疾病,其发病机制为凝血因子Ⅸ(coagulation factor Ⅸ, FⅨ)的编码基因F9缺陷所导致的凝血功能障碍[1]。在男性人群中HB的发病率为1/30 000;女性血友病患者罕见,通常为携带者[2]。根据症状的轻重及凝血因子Ⅸ活性(factor Ⅸ coagulant activity, FⅨ:C),临床上将HB分为轻型(FⅨ:C 5%~40%)、中型(FⅨ:C 1%~5%)和重型(FⅨ:C<1%)。HB的主要表现为出血,出血部位为皮肤黏膜、关节、肌肉及深部组织器官,可危及生命[3]。目前临床上尚无有效的根治方法,患者主要以输注FⅨ制剂或新鲜全血的替代治疗为主。因此,开展F9基因诊断、携带者筛查及产前诊断具有重要的临床应用价值[1,3]。本研究应用Ion Torrent半导体测序技术对11个HB家系进行F9基因突变分析,以期明确遗传病因,为进一步指导妊娠提供实验依据。
1 材料与方法
1.1研究对象 收集2014年2月至2018年10月于南京市妇幼保健院遗传咨询及产前诊断门诊就诊的11个HB家系,其中家系3有3例患者。13例患者在本院或者外院诊断为HB,其中11例患者在本院进行了基因诊断,其余2例患者在外院进行基因诊断。对11个家系中的女性成员进行携带者筛查,并为7个家庭提供了产前诊断。家系成员非近亲结婚,染色体核型和微阵列检测未发现染色体结构异常或拷贝数变异,并对其进行Ion Torrent半导体测序检测以寻找致病基因及位点。本研究获得南京市妇幼保健院医学伦理委员会批准(宁妇伦字[2019]-KY086),患者本人或患儿家属均签署知情同意书。
1.2主要仪器及试剂 Lab-Aid 820核酸提取仪(厦门致善公司),ABI A3500Dx基因分析仪(美国Applied Biosystems公司)。血液DNA提取试剂盒(美国Omega公司),Lab-Aid核酸(DNA)分离试剂盒(厦门致善公司),21-三体和性染色体多倍体检测试剂盒(广州达安基因公司)。Ion AmpliSeq Library Kit 2.0试剂盒、Ion PGM Sequencing 200试剂盒、Ion OneTouch系统、Ion Torrent 316芯片及Ion Torrent PGM测序仪均由美国Life technologies 公司提供,Sanger测序试剂和配套仪器由美国Applied Biosystems公司提供,PCR扩增试剂购自南京诺唯赞公司,SALSA mLPAPO95染色体非整倍体检测试剂盒(荷兰MRC Holland公司)。
1.3标本采集和DNA提取 采集所有受检者就诊时EDTA-K2抗凝的新鲜静脉血2 mL;按照全血DNA提取试剂盒说明书提取外周血基因组DNA;采用羊膜腔穿刺术采集胎儿羊水样本10 mL,2 000×g离心,PBS洗涤2次,按照Lab-Aid核酸(DNA)分离试剂盒说明书提取胎儿羊水细胞DNA。所得样本浓度均>10 ng/μL,总DNA量>2.0 μg,吸光度(A260/A280 nm)值为1.8~2.0,外周血、羊水细胞沉淀与基因组DNA样本均置于-20 ℃保存。
1.4羊水标本母体污染检测及胎儿性别鉴定 按照21-三体和性染色体多倍体检测试剂盒说明书扩增胎儿及其父母基因组DNA,扩增产物经A3500Dx基因分析仪进行毛细管电泳,对7个STR位点(D21S11、D21S1411、D21S1435、DXS6809、DXS981、X22和AMXY)进行分析,排除母体DNA污染并确定亲源关系。采用SALSA MLPA P095染色体非整倍体检测试剂盒对胎儿基因组DNA进行多重连接依赖探针扩增(multiplex ligation dependent probe amplification, MLPA)分析,参考文献[4]进行数据分析以判断胎儿性别。
1.5Ion Torrent半导体测序 Ion Torrent半导体测序参照本实验室建立的方法[5]进行。文库构建:采用Ion AmpliSeq Library Kit 2.0试剂盒进行文库构建,对扩增产物加入序列标签及测序接头,制备的文库平均片段大小约为300 bp;乳液PCR和ISPs富集:采用Ion PGM Xpress Template 200试剂盒在Ion OneTouch系统上进行乳液PCR,对模板阳性磁珠颗粒(Ion Sphere Particles,ISPs)在Ion OneTouch ES模块上进行富集;Ion Torrent测序:采用Ion PGM Sequencing 200试剂盒及Ion Torrent 316芯片在Ion Torrent PGM测序仪上进行测序,用Ion Torrent Suite v3.0软件进行数据提取、参考基因组(UCSC hg19)序列比对及SNVs和Indels提取。
1.6生物信息学分析 通过dbSNP137(http://www.bioinfo.org.cn/relative/dbSNP%20Home%20Page.htm)、Genome Aggregation Database(http://gnomad-old.broadinstitute.org/)、the 1000 Genomes Project(http://www.internationalgenome.org/)等数据库获得变异的最小等位基因频率,SIFT(http://sift.jcvi.org/)、Mutation Taster(http://www.mutationtaster.org)、Polyphen2(http://genetics.bwh.harvard.edu/pph2/)及CADD(http://cadd.gs.washington.edu/等软件进行危害性预测,再结合HGMD、NCBI等数据库[6],根据美国医学遗传学与基因组学学会(ACMG,2015)分级标准[7]对突变位点进行致病性判断。
1.7Sanger测序 对F9基因(NM_000133.4)突变位点进行家系验证。使用NCBI在线软件(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计PCR引物,由苏州金唯智公司合成,引物序列见表1。PCR反应体系为50 μL,包括25 μL PCR mix,10 μmol/L上、下游引物各2 μL,DNA模板2 μL,ddH2O 19 μL。循环参数:95 ℃ 10 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s,72 ℃ 10 min,共35个循环。PCR扩增产物送苏州金唯智公司测序验证。

表1 Sanger测序验证引物序列
2 结果
2.1各HB家系基因突变检测结果 13例HB患者均存在F9基因致病性突变,共发现10种突变,其中错义突变7种,无义突变2种,整码突变1种。Sanger 测序结果与高通量测序结果完全一致,结果见图1。基于先证者的突变位点,对11个家系中的20名女性受检者进行携带者筛查检测,其中15例女性为F9基因突变携带者,其突变类型及检测结果见表2。

表2 11例家系HB患者及女性成员F9基因突变检测结果
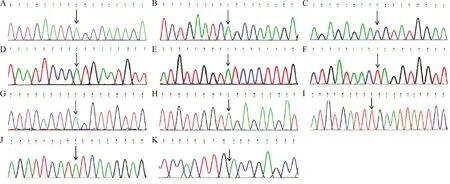
注:A,患者P1a的Sanger测序结果,箭头示c.128G>A突变;B,患者P2a的Sanger测序结果,箭头示c.128G>A突变; C,患者P3a的Sanger测序结果,箭头示c.190T>C 突变; D,患者P4a的Sanger测序结果,箭头示c.343T>C突变; E,患者P5a的Sanger测序结果,箭头示c.356G>A突变;F,患者P6a的Sanger测序结果,箭头示c.454A>T突变; G,患者P7a的Sanger测序结果,箭头示c.677G>A突变; H,患者P8a的Sanger测序结果,箭头示c.688G>A突变; I,患者P9a的Sanger测序结果,箭头示c.892C>T突变; J,患者P10a的Sanger测序结果,箭头示c.1220G>A突变; K,患者P11a 的Sanger测序结果,箭头示c.1130_1132del突变。
2.2产前诊断结果 依据F9基因检测结果,对7个家系中的高危胎儿进行产前诊断,其中为6个家庭提供了1次产前诊断,1个家庭孕妇两次妊娠,并提供了2次产前诊断,羊膜腔穿刺术后无出血、感染、流产及胎死宫内等并发症。8例胎儿中1例为半合子突变,判断其罹患HB,经遗传咨询,胎儿家属选择终止妊娠。2例为杂合突变,为HB女性携带者,5例不携带母源致病突变,为正常胎儿。
3 讨论
人F9基因定位于Xq27.1,全长约为34 000 bp,由8个外显子和7例内含子组成,编码461个氨基酸的FⅨ[8]。F9基因突变类型多种多样,且无明显的突变热点,其中点突变占73.1%,其中单个碱基的突变约占80%,点突变的错义突变约占64%,无义突变约占15 %[9]。
在本研究中,13例HB患者共发现10种突变,其中错义突变7种,无义突变2种,整码突变1种,错义突变发生率占70%,是F9基因的主要突变方式,与文献[9]报道的结果基本相符。本研究发现有3种突变发生在第8外显子,约占30%,该区域发生突变的频率较高,提示第8外显子是FIX基因的突变高发区[10],P10a患者c.1220G>A导致407位上的半胱氨酸被酪氨酸取代,P11a患者c.1130_1132del使377位上的缬氨酸缺失,突变均发生在丝氨酸蛋白酶催化区域,使FIX蛋白催化活性降低,影响其在FX向FXa的转化中发挥功能,而P9a患者c.892C>T导致298位上的精氨酸突变为终止密码子,使FIX蛋白多肽链合成提前终止,无义突变产生缩短的蛋白质分子不能进入血液循环。此外,第2外显子编码前肽区域,通过形成谷氨酰基羧化酶的结合位点触发γ-羧基谷氨酸区(GLA区域)的羧化,进而形成与磷脂结合的部位;第4外显子编码与钙离子结合的表皮样生长因子1区(EGF-1区域)部位,第2号、第4号外显子突变发生率也稍高[11]。本研究发现,有3种(30%)突变类型发生在CpG位点,这进一步证实了CpG二核苷酸是人类生殖细胞FIX热点突变位点[9]。同时,笔者还发现有3种(30%)突变类型导致精氨酸密码子发生改变,这可能是由于精氨酸密码子中的胞嘧啶因甲基化容易发生脱氨基作用,变成胸腺嘧啶或腺嘌呤,从而导致精氨酸突变为其他类型的氨基酸[12]。然而,由于本研究中的样本量较少,无法进行HB临床表型与基因型的相关性分析,需要后期在更大样本量的研究中进行分析验证。
经数据库检索,笔者发现1种新突变(c.343T>C, p.Tyr115His),且未见文献和数据库报道,该位点不位于CpG二核苷酸。PolyPhen软件和SIFT 软件预测该突变表型均为有害突变。同一位点多个其他类型的突变(p.Tyr115Asn,p.Tyr115Ser和p.Tyr115Cys)被报道可致病[13-15]。根据ACMG原则,判定该突变为可疑致病突变位点。根据家属要求,基于此突变位点进行产前基因检测,发现胎儿不携带该突变,选择继续妊娠,在后续的随访中新生儿表型无异常。研究发现,约10%~15%的F9基因突变女性携带者也可表现出血症状,这主要是由于女性的1条X染色体随机失活导致的[16]。在本研究的15例女性F9基因突变携带者中,有1例(6.7%,1/15)表现为HB症状。有血友病症状的女性F9基因突变携带者比例略低于其他文献报道,这可能与本研究中样本量较少有关。
基于Ion Torrent半导体测序技术具有简便、快速、通量大的优势,可有效检测出点突变和微小缺失重复,再对检测出的致病突变用Sanger测序进行验证,可建立有效可靠的F9基因检测方法,便于临床应用及推广。本研究中的13例HB患者经基因测序均发现F9基因突变的存在,并发现了F9基因新的突变类型。综上所述,本研究不仅丰富了F9基因的突变谱,还对临床进行F9基因突变的携带者的产前诊断具有一定的指导意义。
