下调NLRP3在2型糖尿病中表达对胰岛素抵抗模型脂肪细胞炎症反应及自噬的影响*
2021-10-28沙依拉海米提阿地拉阿里木阿不拉江玉孙王新玲张穗乡
沙依拉·海米提 阿地拉·阿里木 阿不拉江·玉孙 王新玲 张穗乡
(1.新疆自治区人民医院内分泌科,新疆 乌鲁木齐 830000;2.新疆医科大学基础医学院,新疆 乌鲁木齐 830000)
寡聚化结构域样蛋白受体3(NOD family,pyrin domain containing-3,NLRP3)是NOD家族中研究最为成熟的成员之一,同时也是生物体内表达最为广泛、生物作用作为多样的一类炎性小体[1-2]。近年来大量研究证实NLRP3在2型糖尿病(type-2 diabetes mellitus disease,T2DM)的发病机制中起着至关重要的作用[3-6]。T2DM是以胰岛素抵抗(insulin resistance,IR)与慢性炎症为主要特征的代谢紊乱性疾病[7]。其中,机体的脂肪组织作为体内最大的能量储备系统,其不仅在血糖控制及脂类代谢过程中发挥着重要的作用,还能通过内分泌功能参与调节机体的免疫代谢过程[8-11]。但关于NLRP3对T2DM中发生IR的脂肪细胞的作用尚不明确。本文研究了NLRP3在脂肪细胞发生IR条件下的作用,有望为靶向NLRP3的T2DM治疗提供新的启迪。
1 材料与方法
1.1 研究对象 选取2018年3月~2019年5月在新疆自治区人民医院内分泌科初诊为T2DM的患者60例,设为T2DM组。另选取同期本院体检中心的健康正常体检者60例作为正常对照组(Normal组)。T2DM的诊断标准参考中华医学会糖尿病分会制定的《中国2型糖尿病防治指南(2017年)》[12]。T2DM组纳入标准:①符合上述糖尿病诊断标准。②无合并心脑血管、肝肾、呼吸系统及胃肠等其他系统疾病或恶性肿瘤。③非妊娠期或哺乳期妇女。④3月内未发生酮症酸中毒或高渗性昏迷。⑤6月内未服用任何降糖药物治疗。本研究对象均签署知情同意书,并经新疆自治区人民医院伦理委员会审核、批准。
1.2 细胞系及主要试剂 前脂肪细胞3T3-L1株购自中国科学院上海细胞库;地塞米松,胰岛素(insulin)、异丁基甲基黄嘌呤(isobutylmethylxanthine,IBMX)(美国Sigma公司);Trizol、BCA试剂盒、逆转录试剂盒(美国Thermo 公司);实时定量PCR试剂盒(广州瑞博生物公司);转染试剂脂质体Lipofectamine3000 (美国Invitrogen公司);靶向下调NLRP3表达的小干扰RNA(si-NLRP3)及其阴性对照序列(si-negative control,si-NC)(上海吉玛生物公司);油红O染色试剂盒(武汉博士德生物公司);葡萄糖氧化酶试剂盒(江苏碧云天生物公司);大鼠抗Beclin1、GAPDH单克隆抗体(美国Santa Cruz公司);大鼠抗LC3B多克隆抗体、大鼠抗p62单克隆抗体(美国Cell Signaling Technology公司);辣根过氧化酶标记(HRP)的兔抗大鼠IgG(武汉博士德生物科技公司);PCR引物(上海生工);其他试剂均为国产分析纯。电泳槽、电泳仪及化学发光荧光成像系统(美国Bio-Bad公司)。
1.3 检测方法
1.3.1 生化指标检测 所有研究对象均隔夜禁食8~10 h后采集肘静脉血进行检测各项生化指标。采用全自动生化分析仪检测所有患者的血糖指标:空腹血糖值(FPG)、餐后2 h血糖(2 h PG),糖化血红蛋白(HbA1c);。采用放射免疫法测定空腹胰岛素水平(FINS)。根据FPG与FINS计算IR指数(HOMA-IR),计算公式:HOMA-IR =[(FPG×FINS)/22.5];根据受试者身高体重计算体质量(BMI),BMI=体重(kg)/身高2(m2)。
1.3.2 酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA) 参考NLRP3、白介素1β(interlukin-1β,IL-1β)、白介素18(interlukin-18,IL-18)的ELISA检测试剂盒使用说明方法检测相应样本中的上述细胞因子表达。实验单独进行3次。
1.3.3 细胞的培养及诱导分化 参照文献[13]培养前脂肪细胞3T3-L1并诱导其分化为成熟脂肪细胞,方法如下:常规复苏3T3-L1前脂肪细胞,使用含有10%FBS的DMEM/HG培养基进行培养,置于37 ℃、5% CO2饱和湿度的培养箱中培养。当细胞生长融合至90%以上时,在上述培养基中加入0.5 mmol/L IBMX、1 μmol/L地塞米松、10 μg/mL Insulin进行诱导分化,同上条件培养48 h,更换为10 μg/mL Insulin与10% FBS的DMEM/HG培养基继续培养48 h,再将培养基更换为10% FBS的DMEM/HG培养基进行持续培养,48 h更换培养基1次。选择诱导分化8 d至12 d的3T3-L1细胞进行成熟脂肪细胞的鉴定。
1.3.4 油红O染色 收集生长状态良好的经诱导分化后的3T3-L1细胞,PBS离心洗涤细胞后,在室温下将其固定于1 mL 10%的甲醛溶液中2 h,PBS再次洗涤细胞后,室温下晾干细胞,加入0.3%油红染色溶液250 μl于室温下避光染色1 h,60%异丙醇充分漂洗后置于显微镜下观察,拍照。
1.3.5 IR模型的建立 将方法1.3.3中诱导分化的成熟脂肪细胞3T3-L1分为正常对照组(记为A组)与IR模型组(记为B组),A组使用含10% FBS DMEM/HG的常规培养基进行培养,B组使用含1 μmol/L地塞米松与10% FBS的DMEM/HG培养基进行诱导IR,两组细胞按上述条件培养48 h后,收集两组细胞培养上清液。使用含100 nmol/L Insulin的常规培养基处理上述不同条件培养48 h后的A、B组细胞30 min,收集各组细胞培养上清液。参考葡萄糖氧化酶试剂盒使用方法检测所收集的上清液中葡萄糖含量,以未接种细胞的空白培养基作为葡萄糖含量的基础值,所测结果减去每组基础值即为每组葡萄糖消耗量。
1.3.6 细胞转染及分组 分别取生长状态良好的3T3-L1脂肪细胞,细胞计数后,按2×105个/mL接种于24孔板中进行IR模型诱导后,加入100 μl Opti-MEM溶液,并根据LipofectamineTM3000说明书方法将si-NLRP3、si-NC转染入细胞中。将转染后的细胞置于37 ℃、5% CO2恒温培养箱中进行培养8 h后即可进行检测转染效率及后续相关实验。将转染后的3T3-L1脂肪细胞分为四组,分别为si-NC组,即转染si-NC的3T3-L1细胞;si-NLRP3组,即转染si-NLRP3的3T3-L1细胞;IR-si-NC组,即在IR模型中转染si-NC的3T3-L1细胞;IR-si-NLRP3组,即在IR模型中转染si-NLRP3的3T3-L1细胞。
1.3.7 实时荧光定量PCR(RT-PCR) 取方法1.3.6不同处理的各组3T3-L1细胞,TRIzol法提取细胞中总RNA,分光光度计检测浓度与纯度后,根据逆转录试剂说明书逆转录为cDNA,再按照RT-PCR试剂说明书及预实验确定的反应时间与温度进行实时定量,RT-PCR反应条件为:95 ℃(30 s)预变性后,变性95 ℃(7 s)→退火60 ℃(30 s)→72 ℃(15 s),40个循环周期。RT-PCR引物序列为:NLRP3-上游:5′-AGAAGAGACCACGGCAGAAG-3′,NLRP3-下游:5′-CCTTGGACCAGGTTCAGTGT-3′;GAPDH-上游:5′-GCATTGTGGAAGGGCTCATG-3′,GAPDH-下游:5′-TTGCTGTTGAAGTCGCAGGAG-3′。以GAPDH为内参,采用2-ΔΔCt方法分析NLRP3 mRNA的表达。上述实验单独重复3次。
1.3.8 Western blot实验 取方法1.3.6不同处理的各组3T3-L1细胞,RIPA细胞裂解液及蛋白酶抑制剂进行提取细胞中的总蛋白。BCA法进行蛋白定量后,将蛋白样品进行加热变性。取30 μg的蛋白进行聚丙烯酰胺凝胶(SDS-PAGE)电泳进行蛋白分离,采用湿转法将分离的蛋白转至PVDF膜上,5%的脱脂牛奶于室温下封闭2 h后,分别加入LC3B(1∶300)、Beclin1(1∶300)、p62(1∶300)、GAPDH (1∶1000)一抗,4 ℃摇床孵育过夜。TBST溶液清洗3次,5 min/次,以辣根酶标记的二抗(1∶5000)室温孵育1 h,以TBST溶液清洗3次,5 min/次。最后均匀滴加ECL发光液后于凝胶成像仪进行曝光拍照。Image J软件测定条带灰度值,以目标蛋白与内参GAPDH的比值作为其相对含量。以上实验单独重复3次。
2 结果
2.1 两组受试者一般资料比较 T2DM组与Normal组在性别、年龄及BMI方面相比,差异均无统计学意义(P>0.05),而FPG、2 h PG、HbA1c、FINS及HOMA-IR相比,T2DM组较Normal组均明显增加,差异均具有统计学意义 (P<0.05),见表1。

表1 两组受试者的一般临床资料比较Table 1 General clinical data of the two groups
2.2 NLRP3在T2DM患者血清中的表达 与Normal组相比,NLRP3在T2DM组血清中的表达显著增加 (P<0.01),见图1。

图1 NLRP3在两组患者血清中的表达Figure 1 The expression level of NLRP3 in serum of T2DM patients increased significantly注:与Normal组相比,①P<0.01
2.3 成熟脂肪细胞分化的鉴定 油红O染色进行鉴定诱导后3T3-L1细胞,观察显示前脂肪细胞3T3-L1呈长梭形贴壁生成,而诱导后细胞形状变圆,体积增大,经油红O染色观察可见细胞核周围有大量脂滴环绕,呈“戒环状”。见图2。

图2 油红O染色观察3T3-L1前脂肪细胞诱导分化Figure 2 Induced differentiation of 3T3-L1 pre-adipocytes was observed by oil red O staining注:黑色箭头指示3T3-L1脂肪细胞中脂滴呈“戒环状”
2.4 脂肪细胞IR模型的鉴定 应用葡萄糖氧化酶法鉴定3T3-L1细胞的IR模型,结果显示3T3-L1脂肪细胞经DEX培养48 h后与Normal组相比,IR模型组细胞的上清液中葡萄糖消耗量显著降低 (P<0.05),再经胰岛素刺激后与Normal组相比,IR模型组细胞的上清液中葡萄糖消耗量亦明显降低 (P<0.05)。提示成功建立了3T3-L1脂肪细胞的IR模型,见图3。

图3 3T3-L1脂肪细胞IR模型的鉴定Figure 3 Identification of insulin resistance model of 3T3-L1 adipocytes注:A.Normal组;B.IR模型组。与Normal组相比,①P<0.01
2.5 转染si-NLRP3后IR模型中脂肪细胞对NLRP3的表达 RT-PCR结果显示,与si-NC组相比,si-NLRP3组与IR-si-NLRP3组的3T3-L1细胞中NLRP3 mRNA的表达均显著降低 (P<0.05),而IR-si-NC组细胞中NLRP3 mRNA的表达明显升高 (P<0.05),提示IR能够促进NLRP3 mRNA的表达,而转染si-NLRP3后能够显著降低其表达,见图4。

图4 RT-PCR检测各组细胞中NLRP3 mRNA的表达Figure 4 The expression level of NLRP3 mRNA in each group was detected by RT-PCR注:与si-NC组细胞相比,①P<0.05
2.6 下调NLRP3表达对IR模型中脂肪细胞炎症因子表达的影响 ELISA检测各组3T3-L1细胞种炎症因子IL-1β、IL-18的表达水平,结果显示与si-NC组相比,IR-si-NC组与IR-si-NLRP3组中IL-1β、IL-18表达均显著增加 (P<0.05),而si-NLRP3组无显著变化(P>0.05);与IR-si-NC组相比,IR-si-NLRP3组中IL-1β、IL-18表达均明显降低 (P<0.05),见表2。
表2 各组脂肪细胞对炎症因子IL-1β、IL-18的表达Table 2 The expression of IL-1β and IL-18 in adipocytes of each group
2.7 下调NLRP3表达对IR模型中脂肪细胞对葡糖糖摄取的影响 葡萄糖氧化酶-过氧化物酶法检测结果显示,与si-NC组细胞相比,IR-si-NC组与IR-si-NLRP3组中葡萄糖消耗量显著降低 (P<0.05),而si-NLRP3组无显著变化(P>0.05);但与IR-si -NC组相比,IR-si-NLRP3组中脂肪细胞对葡萄糖消耗量显著增加 (P<0.05),见图5。

图5 各组脂肪细胞对葡萄糖消耗量的检测Figure 5 The detection of glucose consumption in adipocytes注:与si-NC组相比,①P<0.05;与IR-si-NC组相比,②P<0.05
2.8 下调NLRP3表达对IR模型中脂肪细胞自噬的影响 Western blot检测各组细胞中自噬相关蛋白LC3B与Beclin1和p62的表达,结果表明在si-NC组与si-NLRP3组3T3-L1细胞中自噬标志性分子LC3-Ⅱ/LC3-Ⅰ比值及Beclin-1蛋白较IR-si-NC组与IR-si-NLRP3组显著增加 (P<0.05),而p62蛋白明显降低 (P<0.05);但与IR-si-NC组相比,IR-si-NLRP3组细胞中LC3-Ⅱ/LC3-Ⅰ比值及Beclin-1蛋白明显增加 (P<0.05),p62蛋白显著降低 (P<0.05),见图6。
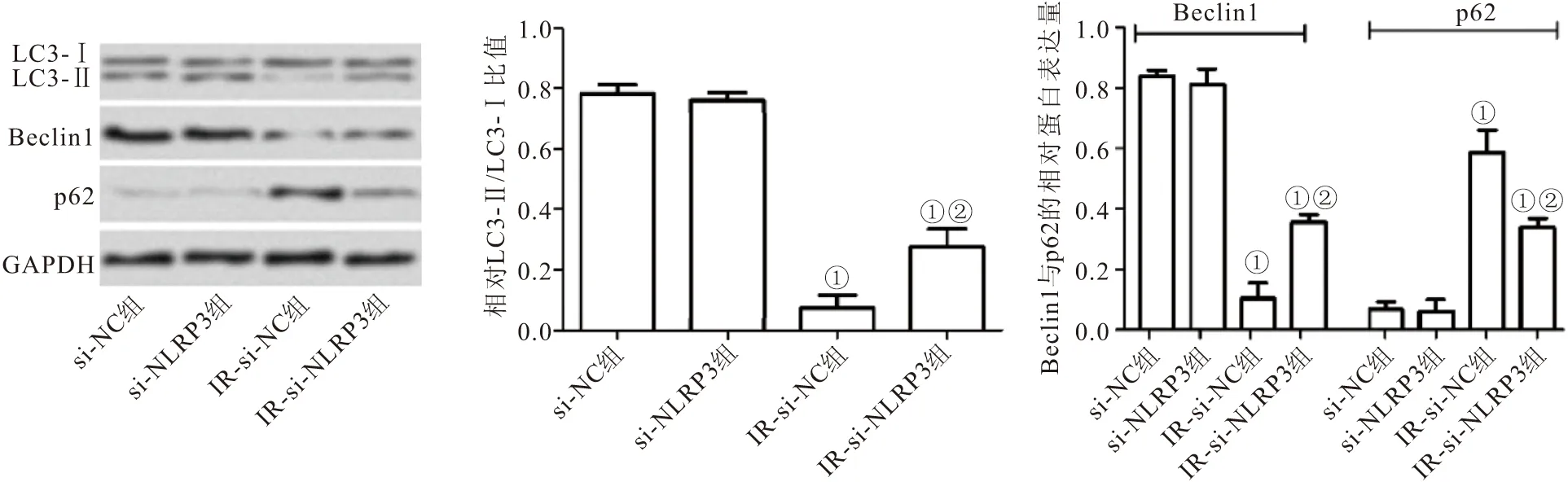
图6 Western blot检测各组脂肪细胞中自噬相关蛋白表达Figure 6 The expression of autophagy related proteins in adipocytes was detected by Western blot注:与si-NC组细胞相比,①P<0.05;与IR-si-NC组细胞相比,②P<0.05
3 讨论
T2DM作为一种能量代谢障碍相关的代谢综合征,其同样也是一种由慢性炎症引起的炎症性疾病,胰岛β功能损害及IR是引起T2DM的两大重要病理特征[14]。目前T2DM在全世界范围内呈流行现象,尤其在我国,有数据报道每10个成年人中就有1个糖尿病患者,严重危害人们的健康及社会经济的发展[15]。而NLRP3作为能够在细胞内与凋亡相关斑点蛋白(caspase recruitment domain,ASC)和半胱氨酸蛋白酶1(caspase-1)相互结合形成具有生物活性炎性小体,并激活下游促炎因子IL-1β与IL-18等的分泌,从而参与T2DM的发生发展。同时,Oslowski团队与Lenner团队发现由代谢紊乱而引起的内质网应激能够诱导胰岛β细胞中硫氧还原蛋白相互作用蛋白的表达,而后者又能通过抑制NLRP3炎症小体的活化及下游IL-1β的分泌,从而促进胰岛β细胞的存活[16-17]。此外,大量学者在NLRP3炎性小体活化的信号通路上利用基因敲除小鼠研究证实,饮食诱导的NLRP3炎症小体活化是引起IR及糖耐量受损的主要“幕后推手”[18-19]。本实验通过观察对比T2DM患者与正常对照组血清NLRP3的表达,结果表明NLRP3在T2DM患者血清中的表达异常增加,这与上述文献的结果一致,提示NLRP3可能与T2DM的发生发展具有相关性。
机体脂肪细胞主要通过调控葡萄糖的运输能力来影响脂质的存储及相关细胞因子的分泌,而脂肪细胞的功能障碍会造成其对胰岛素的敏感性降低[20]。大量研究证实在T2DM中脂肪细胞发生了IR[9]。同时,脂肪细胞的IR将显著降低其对葡萄糖的吸收及利用,进一步促进脂肪组织在其他组织或器官的异常累积,降低其对胰岛素的敏感性,最终形成系统性的IR[21]。有学者报道在肥胖及高脂血症患者的脂肪组织中NLRP3的表达较健康人群明显增加,通过降低NLRP3炎性小体的表达能够下调脂肪细胞对促炎因子IL-1β及IL-18表达[10-11],而IL-1β与IL-18是T2DM中重要的促炎因子[5]。本研究通过诱导前脂肪细胞3T3-L1分化为成熟脂肪细胞,并利用地塞米松诱导其形成IR模型以模拟T2DM中脂肪细胞的状态,并应用siRNA技术下调NLRP3在脂肪细胞中的表达,ELISA实验证实下调脂肪细胞中NLRP3的表达能显著降低IR模型中的脂肪细胞对IL-1β、IL-18的分泌,并促进其对葡萄糖的摄取,这与其他学者的研究报道相似,均表明下调脂肪细胞中NLRP3表达能抑制其对下游IL-1β、IL-18的分泌水平,并促进其对葡萄糖的利用。
自噬是广泛存在于真核细胞内的一种具有自我保护作用的生理现象,其基本的功能是保证细胞的活力,负责细胞器的更新。Zhang Y等[22]学者最近提出NLRP3可以通过其特殊的分子结构域与自噬启动蛋白Beclin1相互作用,负向调控细胞的自噬水平。在本研究中我们检测IR模型的脂肪细胞的自噬水平,结果表明下调细胞中NLRP3表达能够显著促进细胞的自噬水平,同时自噬相关蛋白Beclin1表达显著增加。LC3-Ⅰ脂质化并形成膜结合的LC3-Ⅱ是自噬体形成的关键步骤,同时也被用来作为自噬发生的检测标准,而LC3-Ⅱ与LC3-Ⅰ比值能够有效反应两者之间的动态转换过程。p62是细胞内自噬过程中特异性底物及调节蛋白,同时也被用来作为衡量自噬的完成情况[23]。下调IR模型中脂肪细胞的NLRP3表达能显著促进LC3-Ⅱ/LC3-Ⅰ比值的增加及降低p62蛋白水平,这提示下调NLRP3能够促进IR模型中脂肪细胞的自噬水平。
4 结论
NLRP3在T2DM中的表达显著增加,通过下调胰岛素抵抗模型中脂肪细胞NLRP3表达能够有效降低其对炎症因子IL-1β、IL-18的分泌,促进其对葡萄糖的摄取,并增加细胞的自噬水平。
