厌氧氨氧化UASB系统对氨氮的超量去除机制研究
2021-10-26袁林杰袁林江于丽萍贺向峰杨江伟
袁林杰,袁林江*,陈 希,杨 睿,于丽萍,王 刚,贺向峰,杨江伟
厌氧氨氧化UASB系统对氨氮的超量去除机制研究
袁林杰1,袁林江1*,陈 希2,杨 睿1,于丽萍1,王 刚1,贺向峰1,杨江伟1
(1.西安建筑科技大学环境与市政工程学院,陕西省环境工程重点实验室,西北水资源与环境生态教育部重点实验室,西安 710055;2.西安工程大学城市规划与市政工程学院,西安 710048)
采用UASB反应器在改变NO2--N/NH4+-N比条件下,考察厌氧氨氧化系统对NH4+-N的超量去除特征、相关酶的催化活性以及污泥菌群结构.结果表明,随着进水NO2--N浓度降低,反应器对NH4+-N的去除量相比理论较大,在停供NO2--N情况下,反应器内NH4+-N去除可达55 mg/L.反应器内NH4+-N的去除并不是是来自进水中SO42-和Fe3+/EDTA络合物,而是存在NH4+-N的好氧硝化.过氧化氢酶测定联合分子生物学技术分析显示,好氧硝化的所需氧量分别来自进水和过氧化氢酶产氧.反应器底部污泥层的氨氧化菌(AOB)、厌氧氨氧化菌(AnAOB)活性优于上部污泥层,相反,上部污泥层的异养反硝化菌(HDB)活性优于底部污泥层,二者协同将NH4+-N转化为N2.
厌氧氨氧化;氮超量去除;过氧化氢;过氧化氢酶
相比传统硝化反硝化,厌氧氨氧化工艺对低碳氮比污水具有无需添加碳源、污泥产量少等特点,在污水生物脱氮领域得到广泛应用[1-3].厌氧氨氧化工艺是指在厌氧条件下,厌氧氨氧化菌以NO2--N为电子受体将NH4+-N转化为N2的过程.根据Strous[4]研究理论上厌氧氨氧化反应器中NO2--N与NH4+-N消耗量之比(Rs)和NO3--N的产量与NH4+-N的消耗量之比(Rp)分别为1.32、0.26.然而,在实际运行厌氧氨氧化反应器时,还原单位质量的NO2--N所消耗的NH4+-N通常是高于理论值,即存在所谓的“氨的超量去除”现象[5-8].
李祥等[9]对厌氧氨氧化污泥中氨氧化的潜在电子受体进行研究,发现除NO3--N、SO42-和Fe3+之外,还可能存在着导致过量NH4+-N转化的其他物质.此外,Sabumon等[10]发现在有机条件下厌氧氨的去除可能通过过氧化氢酶产氧将氨氧化.厌氧氨氧化菌为化能自养型细菌,那么在常规无机条件下,是否也存在类似情况,尚不清楚.关于厌氧氨氧化系统中,NH4+-N超量去除过程及影响机制仍未被充分揭示,有待进一步研究.
本研究不仅从UASB厌氧氨氧化系统中可能电子受体SO42-、Fe3+/EDTA进行研究,而且通过反应器内过氧化氢(H2O2)含量和过氧化氢酶活性进行测定,论证了过氧化氢酶产氧将氨氧化的可能性.此外,本研究通过原位荧光杂交技术,微生物群落结构的解析及不同高度污泥层的微生物活性,揭示了系统中NH4+-N超量去除途径及机制.
1 材料与方法
1.1 试验装置及接种污泥
反应器实际体积10.5L,有效体积6.3L,内径100mm,有效高度800mm(图1),反应器的温度由水浴夹层控制在(32±2)℃,水力停留时间(HRT)为12h,原接种污泥为城市污水处理厂A2/O工艺的缺氧池污泥与少量课题组前期培养的厌氧氨氧化颗粒污泥.接种量为4L,MLSS、MLVSS分别为7.889g/L、4.131g/L.
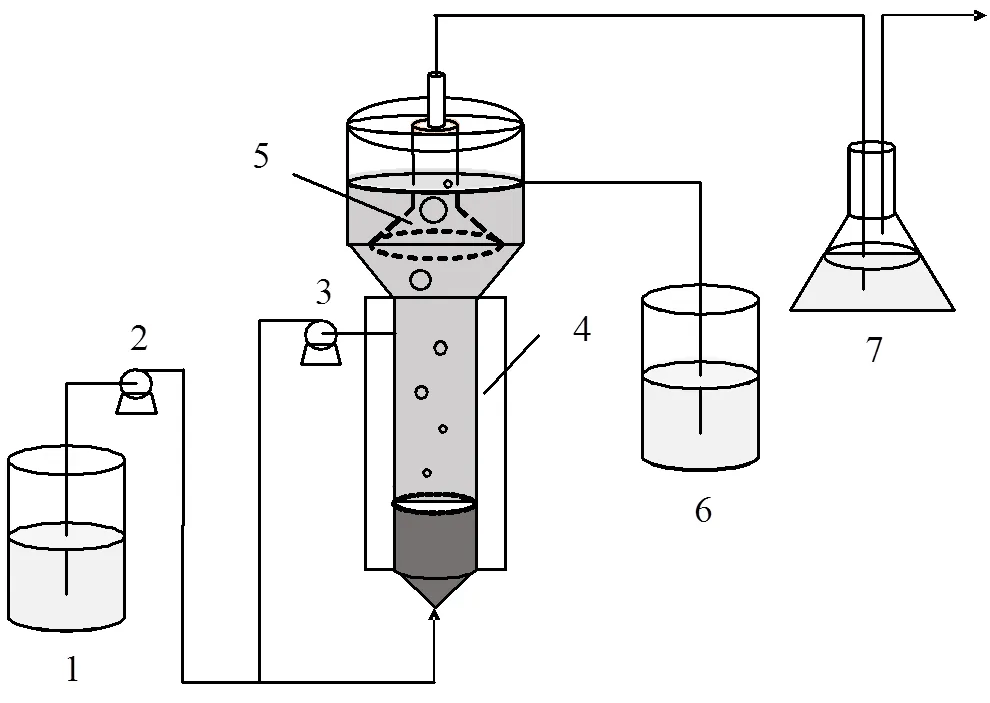
图1 试验装置示意
1.进水桶;2.进水泵;3.回流泵;4.水浴保温层;5.三相分离器;6.出水桶;7.水封瓶
1.2 模拟废水
实验采用人工模拟废水,主要以NH4Cl、NaNO2、Na2SO4按需配制,具体见表1,其他成分含量(mg/L):KHCO31250,KH2PO427.2,MgCl2·6H2O 165,CaCl2·2H2O 250;微量Ⅰ、Ⅱ各1mL/L.其中微量元素Ⅰ成分含量(g/L):EDTA 5,FeSO45;微量元素Ⅱ成分含量(g/L):EDTA 15,ZnSO4·7H2O 0.43, CuSO4·5H2O 0.25,NiCl2·6H2O 0.19,MnCl2·4H2O 0.99,CoCl2·6H2O 0.24,NaMoO4·2H2O 0.22,H3BO40.014[11].

表1 反应器内进水各组分浓度
1.3 分析方法
1.3.1 常规指标 常规水质指标参照《水和废水监测分析方法》[12]进行分析:NH4+-N采用纳氏试剂分光光度法;NO2--N采用N-(1-萘基)-乙二胺光度法;NO3--N采用紫外分光光度法;SO42-采用离子色谱法(ICS1100);MLSS、MLVSS采用重量法.溶解氧采用HQ40d型溶氧仪测定,污泥粒径采用激光粒度分布仪(LS230/SVM),TOC总有机碳测定仪(耶拿multi N/C),H2O2采用钛-硫酸钛法[13],常规指标测定均为一式三份.
1.3.2 活性测定 AOB、硝化细菌(NOB)活性的测定方法和频率:从反应器污泥层上部和底部分别取10mL的泥水混合物,用磷酸盐缓冲液(PBS)冲洗3次并离心(4000r/min),置于100mL的血清瓶,分别同时加入NH4+-N 60mg/L、NO2--N 40mg/L模拟废水至100mL,在33℃条件下充分曝空气至饱和溶解氧(DO)每间隔1h取样,通过分析水质NH4+-N、NO2--N和NO3--N浓度变化计算AOB、NOB活性[14].
AnAOB活性的测定方法和频率:从反应器污泥层上部和底部分别取10mL的泥水混合物,用磷酸盐缓冲液(PBS)冲洗3次并离心(4000r/min),置于100mL的血清瓶,同时加入NH4+-N 60mg/L、NO2--N 85mg/L模拟废水至100mL,曝氮气10min,使DO控制在0.06mg/L以下,随后置于摇床,摇床设定参数分别为33℃、150r/min, 每间隔6h取样,通过分析水质NH4+-N、NO2--N和NO3--N浓度变化计算AnAOB活性[14].
HDB活性的测定方法和频率:从反应器污泥层上部和底部分别取10mL的泥水混合物,用磷酸盐缓冲液(PBS)冲洗3次并离心(4000r/min),置于100mL的血清瓶,同时加入COD 300mg/L、NO3--N 60mg/L模拟废水至100mL,曝氮气5min,随后置于摇床,摇床设定参数分别为33℃、150r/min, 每间隔3h取样, 通过分析水质COD、NH4+-N、NO2--N和NO3--N浓度变化计算HDB活性[15].
1.3.3 过氧化氢酶定性、过氧化氢酶活性分析测定 过氧化氢酶定性:从反应器内取一定量污泥,转入一个干净的显微镜载玻片上,载玻片上先滴数滴去离子水,再加入少量3%的H2O2,静观20s,若20s内出现气泡,表明该污泥表现出过氧化氢酶活性,在没有污泥的相似条件下也进行空白对照实验[10].
过氧化氢酶活性的测定方法和频率:取5mL泥水混合液于离心管中,离心5min(4000r/min)并倒掉上清液,将离心后的污泥样品置于三角瓶中,依次加入40mL超纯水和0.3%的H2O2溶液,随后放入恒温摇床计时20min,摇床设定参数分别为25℃、150r/min,然后将其取下立即加入饱和明矾溶液0.5mL,随后进行过滤,滤液置于盛有5mL硫酸溶液(浓度为1.5mol/L)三角瓶,在波长为240nm处测定其吸光度S,过滤后的污泥样品放入烘箱(105℃,2h)烘干,进行称重,取25mL无污泥样品溶液用0.002mol/ L高锰酸钾溶液滴定,同时做空白实验0和对照实验k,一式三份[16].
计算如下:

(2)

式中:为过氧化氢酶活性,mg H2O2/(g·h);为单位吸光度;为污泥的干重,g;为振荡时间,min;e为消耗过氧化氢样品溶液的吸光度0为空白溶液的吸光度;s为剩余过氧化氢样品溶液的吸光度;k为无基质对照溶液的吸光度;为高锰酸钾溶液的浓度, mg/L;为高锰酸钾溶液的体积,mL;0为空白溶液的体积,mL.
1.3.4 微生物测序分析 采用上海生工的Illumina Miseq平台对污泥样品进行测序,使用E.Z.N. ATMMag-Bind Soil DNA Kit试剂盒(OMEGA)提取DNA,利用细菌V3-V4区域通用引物341F (CCTACGGGNGGCWGCAG)和805R(GACTACH- VGGGTATCTAATCC)对提取的合格DNA样品进行PCR扩增及测序,进行OTU聚类分析和物种分类学分析.以上工作均由上海生工生物工程有限公司(上海,中国)完成,微生物多样性分析于生工生物工程有限公司所提供的I-Sanger生信分析云平台上完成.
1.3.5 荧光原位杂交(FISH) 采用荧光原位杂交[17]对反应器内颗粒污泥中的总菌、AnAOB、优势AOB()进行观察,通过激光共聚焦显微镜(TCS SP8,徕卡)在10倍物镜下采集图像.本研究所用探针如表2所示.
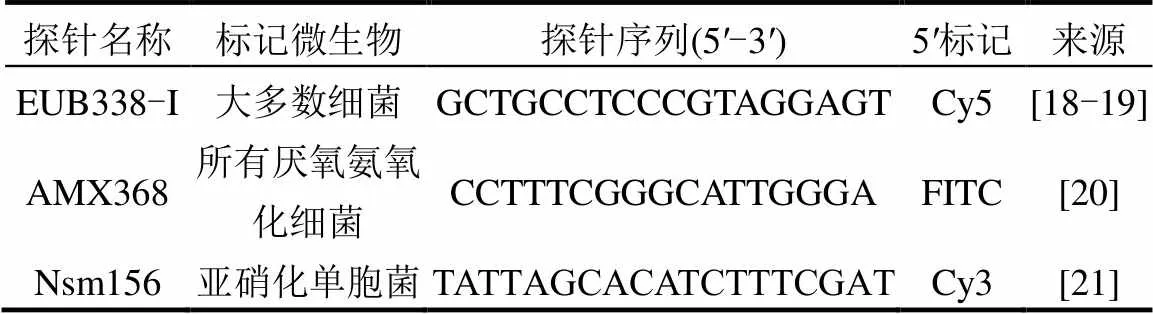
表2 研究中所用FISH探针
2 结果与讨论
2.1 反应器运行状况
由图2可见,随着进水NO2--N浓度的不断降低直至为0,反应器出水NH4+-N浓度逐渐上升,相反,反应器内部分NH4+-N超量去除更加明显.当进水不提供NO2--N的情况下,反应器内NH4+-N仍有去除,这与之前研究者[9-11]发现厌氧氨氧化反应器出现NH4+-N超量去除现象相似.按照Strous等[4]所推导出的厌氧氨氧化反应方程式,以停供亚硝酸盐氮期间最大NO3--N产生量3mg/L计算,消耗反应器内NH4+-N也只有11.54mg/L.同时,通过对反应器产生的气体进行收集及测定,发现反应器内产生的气体主要为N2(82.09%)和CO2(17.91%),反应器内NH4+-N被氧化后的存在状态主要为N2.因此,反应器内可能存在其他途径将NH4+-N去除.
2.2 反应器内氨氮去除途径研究
2.2.1 反应器内的潜在电子受体研究 研究者对厌氧氨氧化的深入研究,发现厌氧氨氧化微生物可以利用多种基质进行代谢[22-25].结合本研究反应器含有的潜在电子受体SO42-和Fe3+/EDTA进行探究.

图2 厌氧氨氧化反应器NH4+-N、NO2--N、NO3--N的去除变化
由于本研究通过以亚硝酸盐型厌氧氨氧化为基础启动硫酸盐型厌氧氨氧化,以SO42-逐步替代NO2--N作为电子受体的方式进行厌氧氨氧化研究.硫酸盐型厌氧氨氧化是在厌氧条件下,以SO42-作为电子受体将氨转化为N2[26-27].推测反应器内可能发生硫酸盐型厌氧氨氧化,由图3可见,反应器长期运行140d,并未发现SO42-有去除,说明反应器内未出现硫酸盐型厌氧氨氧化,换言之,以SO42-作为电子受体氧化氨的反应在本系统中并未发生.
研究报道[23]以NH4+-N作为电子供体,同时以Fe3+/EDTA形成的络合物作为电子受体,无机碳为碳源的情况下进行氨氧化试验.本研究通过不添加微量Ⅰ来研究反应器的NH4+-N去除途径.在第120~140d,发现在不添加微量Ⅰ反应器内NH4+-N仍有去除.说明反应器未出现铁氨氧化反应,以Fe3+/EDTA形成的络合物作为电子受体氧化氨的反应在本系统中并未发生.
2.2.2 反应器内部其他途径导致氨氧化研究 根据上述试验,反应器内的潜在电子受体SO42-和Fe3+/EDTA并不能将NH4+-N转化,对此,NH4+-N的转化可能由其他物质引起.Sabumon等[10,28]研究有机物存在情况下厌氧氨的去除途径,发现氨是被氧化成NO2--N或NO3--N,然后通过自养或异养途径脱氮,同时,也指出过氧化氢酶产氧可能发挥了重要作用.下面对本研究中反应器内在无机条件下是否存在同种情况进行探讨和研究.

图3 厌氧氨氧化反应器内SO42-的去除变化
由图4可见,本研究发现上部和底部污泥层过氧化氢酶活性分别为18.05mgH2O2/(gSS·min)、31.53mgH2O2/(gSS·min).对此,也证实了本研究的反应器中存在过氧化氢酶产氧的可能性.同时,本研究也针对反应器内过氧化氢含量进行测定,发现反应器内上部和底部污泥层H2O2含量分别为0.11mg/ L、0.33mg/L.研究表明[29]在存在微量氧的情况下,兼性微生物利用自身的氧化酶产生H2O2.同样,超氧自由基和H2O2是生物代谢不可避免的反应副产物(超氧自由基和H2O2都是由铁催化的芬顿反应和各种酶产生的,如过氧化物酶、NADPH氧化酶等,超氧化歧化酶将超氧阴离子转化成H2O2).在过氧化氢酶的作用下,将H2O2水解为H2O和O2[30-31].此外,也有研究报道[32-35]保护厌氧菌的抗活性氧的酶存在. 在本研究非严格厌氧的厌氧氨氧化系统中,反应器内的溶解氧浓度在0.06~0.14mg/L.因此,可以说明本实验的反应器内微生物通过产生过氧化氢酶将H2O2水解H2O和O2来免受H2O2的毒害,而AOB利用释放出的O2将部分NH4+-N氧化为NO2--N,与Anjali等研究报道相符[36].然而,由于实验的复杂性及时间限制,本研究未对H2O2分解释放的氧量与进水带入氧量的比例进行量化,后续还需进一步研究.

图4 反应器内不同高度污泥层过氧化氢酶活性、H2O2含量
2.3 反应器中颗粒污泥的FISH分析
通过FISH技术对运行后期(140d)反应器内颗粒污泥进行原位观察,由图5可见,整个颗粒污泥较为松散,然而,少部分AnAOB并未被蓝色标记,是因为少部分AnAOB不在探针标记的“大多数细菌”的覆盖范围之内.其中AnAOB为颗粒污泥的优势菌属.菌属丰度低,主要分布在颗粒污泥的外围,同时在颗粒污泥内部也存在少量菌属.意味着有少量O2通过颗粒污泥中的孔道进入颗粒污泥内部而被菌属利用,另外,过氧化氢酶分解H2O2产生O2也有助于菌属在污泥内部生长.这个结果与污泥中过氧化氢酶及产生有过氧化氢最终可能产氧的推断有一致性.
2.4 微生物菌群结构分析
为了探究在停供NO2--N前后微生物群落结构变化,采用16S rRNA基因高通量测序对X1(0d)、X2(140d)反应器内微生物群落结构进行解析.试验样品的Coverage数值均达到0.99,说明该样品的多样性分析结果是准确的.从表3可以看出,在停供NO2--N的情况下,反应器内群落的多样性在增加(高Shannon、低Simpson),这说明出现适应不同环境条件的菌群协同将反应器内的NH4+-N去除.Chao与Ace指数值均大于实验初期,说明在停供NO2--N的情况下,使反应器内物种丰度在增大.
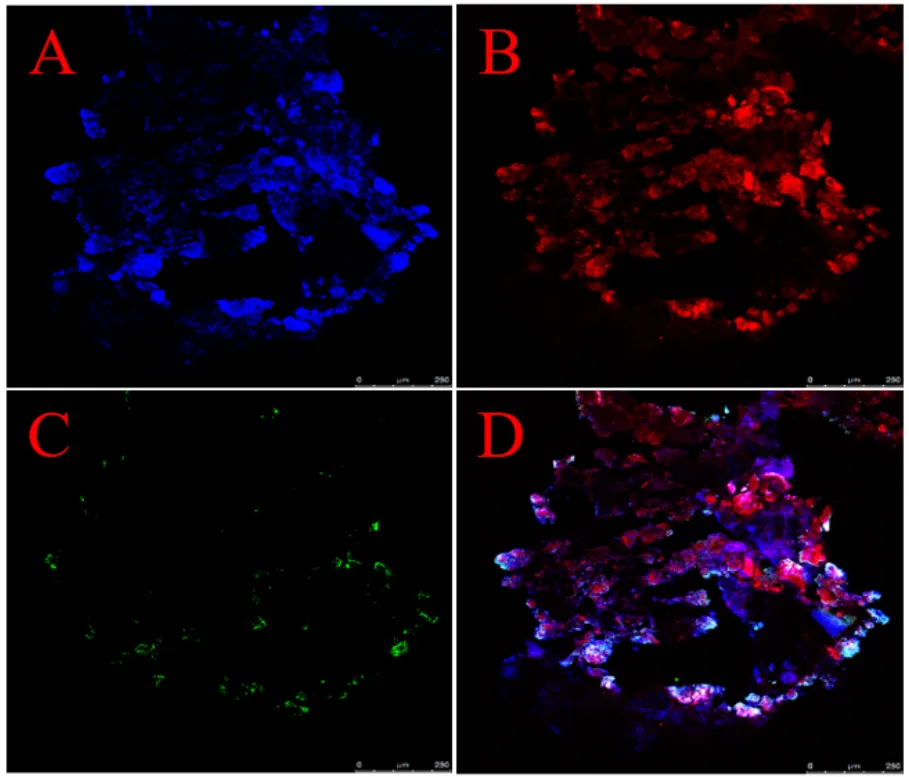
图5 反应器中颗粒污泥大多数细菌、AnAOB、优势AOB(Nitrosomonas)的FISH图
A:蓝色EUB338-Ⅰ;B:红色AMX368;C:绿色Nsm156; D:EUB338-Ⅰ+AMX368+Nsm156

表3 反应器内微生物群落多样性及丰度
由图6可见,在停供NO2--N前后,从7.36%降至6.14%、从0.84%降至0.71%、从0.03%降至0.01%,但仍以为优势,说明此时反应器仍存在厌氧氨氧化反应.然而,可以明显发现从0.06%升至16.17%、从0.26%升至0.37%、从0.01%升至0.14%、从0.01%升至0.14%,由于这些菌属具有反硝化功能,意味着存在一条NO2--N生成的途径,造成反应器内NH4+-N过量去除的原因之一.尤其注意的是属于异养硝化-好氧反硝化菌,据报道[37]异养硝化菌能够耐受更低的溶解氧的浓度.因此,反应器内NH4+-N过量去除与该菌属存在某种关联.同时,发现反应器内AOB中的从0.40%升至0.61%,相反,反应器内NOB中的从0.01%降至0.003%、从0.06%降至0.04%.研究报道[38-39],在低溶解氧的情况下AOB对氧的亲和力高于NOB,进而导致AOB相对丰度高于NOB相对丰度.另一方面可能是由于AOB产生的NO2--N迅速被AnAOB或HDB所利用导致NOB未能得到足够的底物,进而引起其相对丰度的下降.
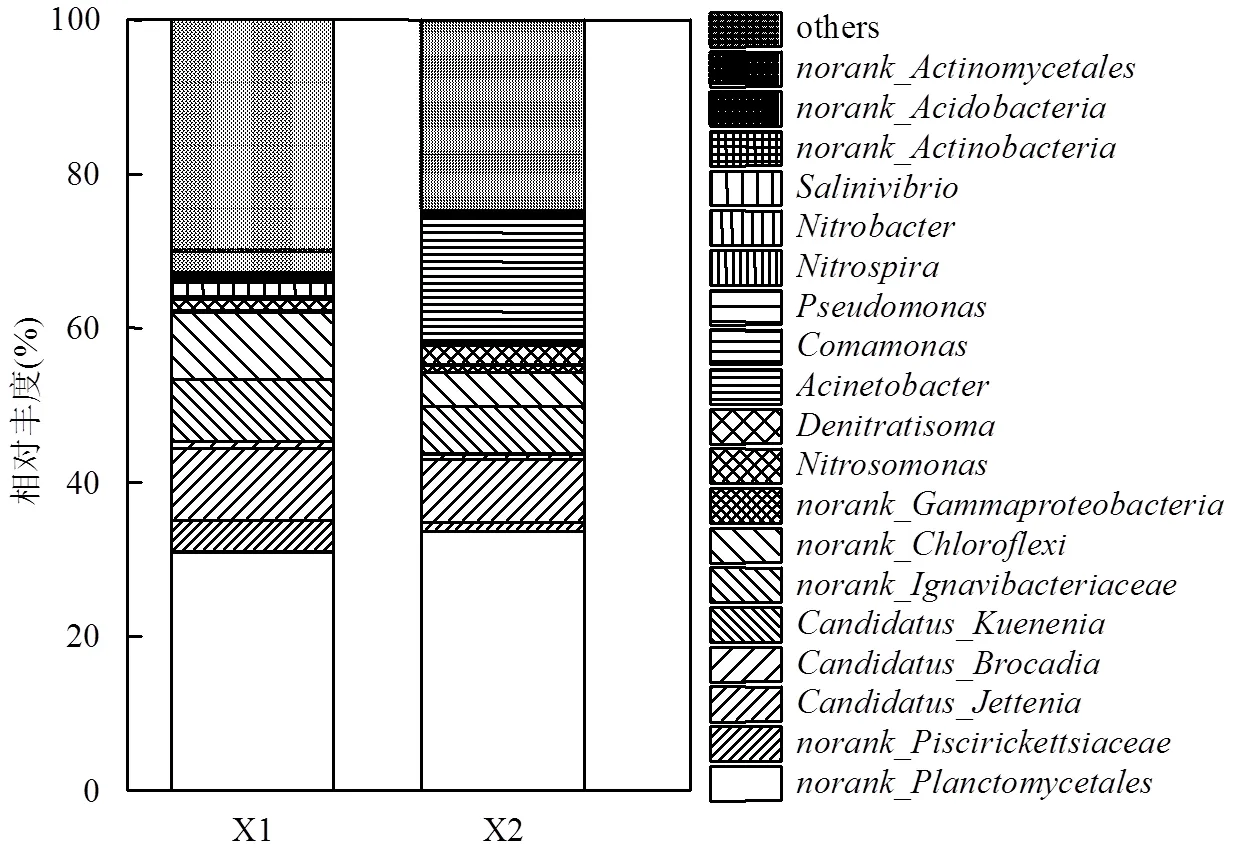
图6 反应器内主要微生物及丰度
2.5 反应器内不同高度污泥层特性分析
2.5.1 AOB、NOB、AnAOB、HDB活性研究 由于UASB反应器具有垂直分布特征,使得UASB反应器能够营造适合多种微生物共存的生长环境[40-41].对此,本研究分别对上部和底部污泥的AOB、NOB、AnAOB、HDB活性进行了测定.
在HDB活性测定中并未检测到NH4+-N的产生,说明没有异养硝酸盐还原氨(DNRA),另外,研究报道[42]厌氧氨氧化反应主要是以NO2--N而非NO3--N作为主要的电子受体,对此,由于这两个过程对NO3--N的去除影响较小,本研究未考虑通过DNRA和厌氧氨氧化过程消耗NO3--N,推断反应器内的NO3--N主要以反硝化作用进行.由图7可见,与反应器底部污泥层的相关微生物活性相比,上部污泥层的AOB、AnAOB活性较低,然而,上部污泥层HDB活性高于底部污泥层,而反应器内NOB活性极低,几乎检测不到.由于本研究中进水由底部进入反应器,进水桶未除氧及回流装置造成O2进入反应器,因此反应器底部的微生物能够优先获得进水中的溶解氧,从而促进AOB的生长,导致底部污泥层AOB活性高于上部[43].同时,由于实验前期接种混合污泥(反硝化污泥和少量厌氧氨氧化颗粒污泥),结合USAB反应器特征,绝大多数厌氧氨氧化颗粒污泥处于反应器底部,因而造成底部污泥层的AnAOB活性高于上部污泥层.同样,由于底部污泥层将进水中的溶解氧消耗殆尽,从而为上部污泥层创造一个缺氧或厌氧的环境,上部污泥层的HDB利用微生物衰亡释放的有机物将产生的NO3--N进行内源反硝化.
2.5.2 污泥层粒径分析 取反应器内不同高度的污泥层,对其粒径进行测定.Miao等[44]认为粒径小于200μm被视为絮状污泥,粒径大于200μm被视为颗粒污泥.由图8可见,上部污泥层的颗粒化程度小,絮状污泥较多,相反,底部污泥层的颗粒化程度明显.此外,据报道[45-46]颗粒污泥具有大量的生物群体,对复杂的环境条件具有更强的适应性.说明本研究的反应器内底部污泥层相比于上部污泥层对复杂的环境条件更具有适应性.

图7 不同高度污泥层的AOB、NOB、AnAOB、HDB活性

2.6 反应器内不同高度污泥层的氨氮转化
本研究测定反应器内不同高度的总有机碳(TOC)见图9,发现从反应器底部到污泥层上部,TOC浓度先增加后降低,结合2.3.1批式试验结果,说明反应器底部污泥层将部分NH4+-N氧化成NO2--N,随后被AnAOB所利用,同时也发生部分反硝化,为AnAOB提供NO2--N的补给;反应器上部污泥层通过底部污泥层产生的NO3--N完全反硝化或部分反硝化,同时也为AnAOB提供NO2--N的补给.因此,反应器底部和上部污泥层协同最终将NH4+-N转化为N2.

图9 反应器内氨氮去除途径
3 结论
3.1 随着进水NO2--N浓度相对不足,厌氧氨氧化反应器对NH4+-N的去除含量相对增加,发生了NH4+-N超量去除的现象.
3.2 反应器内NH4+-N超量去除主要是通过氨氧化和厌氧氨氧化途径,氨氧化所需的O2一部分是来自于进水,另一部分通过微生物自身的过氧化氢酶降解H2O2获取;厌氧氨氧化所需的NO2--N是通过氨氧化以及部分反硝化所获得.
3.3 由于UASB反应器的自身特征,造成不同高度污泥层的微生物活性及污泥粒径的不同,通过底部和上部污泥层协同作用,将反应器内NH4+-N最终以N2的形式转化.
[1] Kartal B, Kuenen J G, Van Loosdrecht M C M. Sewage Treatment with Anammox [J]. Science, 2010,328(5979):702-703.
[2] Ali M, Okabe S. Anammox-based technologies for nitrogen removal: Advances in process start-up and remaining issues [J]. Chemosphere, 2015,141(12):144-153.
[3] Wu P, Zhang X, Wang X, et al. Characterization of the start-up of single and two-stage Anammox processes with real low-strength wastewater treatment [J]. Chemosphere, 2019,245.
[4] Strous M, Heijnen J J, Kuenen J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms [J]. Applied Microbiology and Biotechnology, 1998,50(5):589-596.
[5] Bae H, Park K S, Chung Y C, et al. Distribution of anammox bacteria in domestic WWTPs and their enrichments evaluated by real-time quantitative PCR [J]. Process Biochemistry, 2010,45(3):323-334.
[6] Xiong L, Wang Y Y, Tang C J, et al. Start-up characteristics of a granule-based Anammox UASB reactor seeded with anaerobic granular sludge [J]. Biomed Res Int, 2013,2013:1-9.
[7] Lotti T, Kleerebezem R, Lubello C, et al. Physiological and kinetic characterization of a suspended cell anammox culture [J]. Water Research, 2014,60:1-14.
[8] 闾 刚,李 田,徐乐中,等.基于不同接种污泥复合型厌氧氨氧化反应器的快速启动特征[J]. 环境科学, 2017,38(10):4324-4331.
Lu G, Li T, Xu LZ, et al. Quick start-up characteristics of a composite anammox reactor based on different inoculated sludge [J]. Environmental Science, 2017,38(10):4324-4331.
[9] 李 祥,林 兴,王 凡,等.厌氧氨氧化污泥中氨氧化的潜在电子受体[J]. 环境科学, 2017,38(7):2941-2946.
Li X, Lin X, Wang F, et al. Potential electron acceptors for ammonia oxidation in anammox sludge [J]. Environmental Science, 2017,38(7): 2941-2946.
[10] Sabumon P C. Anaerobic ammonia removal in presence of organic matter: A novel route[J]. Journal of Hazardous Materials, 2007,149(1): 49-59.
[11] 张 蕾,郑 平,何玉辉,等.硫酸盐型厌氧氨氧化性能的研究[J]. 中国科学, 2008,(12):1113-1119.
Zhang L, Zheng P, He YH, et al. Study on the performance of sulfate-type anammox [J]. Chinese Science, 2008,(12):1113-1119.
[12] 国家环境保护总局.水和废水监测分析方法[M]. 北京:中国环境科学出版社, 2004.
State Environmental Protection Administration. Water and wastewater monitoring and analysis methods [M]. Beijing: China Environmental Science Press, 2004.
[13] 李亚琪,王弘恺,朱维晃,等.聚苯胺/蒽醌修饰碳毡作为阴极在电芬顿中的应用[J]. 环境科学学报, 2020,40(11):3905-3912.
Li Y Q, Wang H K, Zhu W H, et al. Application of polyaniline/ anthraquinone modified carbon felt as a cathode in electro-Fenton [J]. Acta Scientiae Circumstantiae, 2020,40(11):3905-3912.
[14] 赵良杰,彭党聪,吕 恺,等.一段式部分亚硝化-厌氧氨氧化工艺处理中低浓度模拟氨氮废水 [J]. 环境工程学报, 2020,15(1):143-151.
Zhao L J, Peng D C, Lyu K, et al. Treatment of simulated medium ammonia wastewater by single-stage partial nitritation-anammox process [J]. Journal of Environmental Engineering, 2020,15(1):143- 151.
[15] 郑照明,刘常敬,郑林雪,等.不同粒径的厌氧氨氧化颗粒污泥脱氮性能研究 [J]. 中国环境科学, 2014,34(12):3078-3085.
Zheng G M, Liu C J, Zheng L X, et al. Study on the denitrification performance of anaerobic ammonia oxidation granular sludge with different particle sizes [J]. China Environmental Science, 2014,34(12): 3078-3085.
[16] 崔璟宜.活性污泥中过氧化氢酶活性的测定及影响因素分析[D]: 吉林:吉林建筑大学, 2013.
Cui JY. Determination of catalase activity in activated sludge and analysis of influencing factors [D]. Jilin: Jilin Jianzhu University, 2013.
[17] Amann R I, Krumholz L R, Stahl D A. Fluorescent-oligonucleotide probing of whole cells for determinative, phylogenetic, and environmental studies in microbiology [J]. Journal of Bacteriology, 1990,172(2):762-770.
[18] Amann R I, Binder B J, Olson R J, et al. Combination of 16S rRNA-targeted oligonucleotide probes with flow cytometry for analyzing mixed microbial populations [J]. Appl. Environ. Microbiol., 1990,56(6):1919-1925.
[19] Daims H, Br Hl A, Amann R, et al. The domain-specific probe EUB338is insufficient for the detection of all Bacteria: development and evaluation of a more comprehensive probe set [J]. Systematic & Applied Microbiology, 1999,22(3):434-444.
[20] Kartal B, Rattray J, Niftrik L, et al. Candidatus "" a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria [J]. Systematic and applied microbiology, 2007,30(1):39-49.
[21] Mobarry B K, Wagner M, Urbain V, et al. Phylogenetic probes for analyzing abundance and spatial organization of nitrifying bacteria [J]. Applied & Environmental Microbiology, 1997,63(2):2156-2162.
[22] Liu S, Yang F, Gong Z, et al. Application of anaerobic ammonium- oxidizing consortium to achieve completely autotrophic ammonium and sulfate removal [J]. Bioresource Technology, 2008,99(15):6817- 6825.
[23] Sawayama S. Possibility of anoxic ferric ammonium oxidation [J]. Journal of bioscience and bioengineering, 2006,101(1):70-72.
[24] Kartal B, Rattray J, Niftrik L A V, et al. Candidatus "" a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria [J]. Systematic and applied microbiology, 2007,30(1):39-49.
[25] Hulth S, Aller R C, Gilbert F. Coupled anoxic nitrification/manganese reduction in marine sediments [J]. Geochimicaet Cosmochimica Acta, 1999,63(1):49-66.
[26] Zhang D, Cui L, Zhu H, et al. Treatment performance and microbial community under ammonium sulphate wastewater in a sulphate reducing ammonium oxidation process [J]. Environmental technology, 2020.
[27] Fdz-Polanco F, Fdz-Polanco M, Fernandez N, et al. New process for simultaneous removal of nitrogen and sulphur under anaerobic conditions [J]. Water Research, 2001,35(4):1111-1114.
[28] Sabumo P C. Effect of potential electron acceptors on anoxic ammonia oxidation in the presence of organic carbon [J]. Journal of hazardous materials, 2009,172(1):280-288.
[29] Fu, Huihui, Gao,et al. Microbial oxidative stress response: Novel insights from environmental facultative anaerobic bacteria [J]. Archives of Biochemistry & Biophysics, 2015,584:28-35.
[30] Blokhina O, Virolainen E, Fagerstedt K V. Antioxidants, oxidative damage and oxygen deprivation stress: A review [J]. Annals of Botany, 2003,91(2):179-194.
[31] Davydova M N, Sabirova R Z. Anti-oxidant defense of the cell Desulfovibrio desulfuricans B-1388 [J]. Anaerobe, 2003,9(1):39-41.
[32] G D S W, I P, Y L M,et al. Purification and characterization of an iron superoxide dismutase and a catalase from the sulfate-reducing bacterium Desulfovibrio gigas [J]. Journal of bacteriology, 2000, 182(3):796-804.
[33] A B, A N, M S, et al. Protection of Methanosarcina barkeri against oxidative stress: identification and characterization of an iron superoxide dismutase [J]. Archives of microbiology, 2000,174(3): 213-216.
[34] M L, M F, D T, et al. Reaction of the desulfoferrodoxin fromwith superoxide anion. Evidence for a superoxide reductase activity [J]. The Journal of biological chemistry, 2000,275(1):115-121.
[35] L L H, V S N, O S A, et al. Rubrerythrin and rubredoxin oxidoreductase in: A novel oxidative stress protection system [J]. Journal of bacteriology, 2001,183(1):101-108.
[36] Anjali G, Sabumon P C. Development of simultaneous partial nitrification, anammox and denitrification (SNAD) in a non-aerated SBR [J]. International Biodeterioration & Biodegradation, 2017,119.
[37] Jetten M S M, Logemann S, Muyzer G, et al. Novel principles in the microbial conversion of nitrogen compounds [J]. Antonie van Leeuwenhoek, 1997,71(1/2).
[38] Guisasola A, Jubany I, Baeza J A, et al. Respirometric estimation of the oxygen affinity constants for biological ammonium and nitrite oxidation [J]. Journal of Chemical Technology & Biotechnology Biotechnology, 2010,80(4):388-396.
[39] Liu X, Kim M, Nakhla G. Operational conditions for successful partial nitrification in a sequencing batch reactor (SBR) based on process kinetics [J]. Environmental technology, 2016,38(6):694-704.
[40] Wang J, Lei Z, Wang L, et al. Insight into using up-flow anaerobic sludge blanket-anammox to remove nitrogen from an anaerobic membrane reactor during mainstream wastewater treatment [J]. Bioresource Technology, 2020,314.
[41] Yue H, Zhang Y, He Y, et al. Keystone taxa regulate microbial assemblage patterns and functional traits of different microbial aggregates in simultaneous anammox and denitrification (SAD) systems [J]. Bioresource Technology, 2019,290.
[42] Graaf A A, Van De, Mulder A, Bruijn P, De, et al. Anaerobic oxidation of ammonium is a biologically mediated process [J]. Applied & Environmental Microbiology, 1995,61(4):1246-1251.
[43] 付昆明,苏雪莹,王会芳,等.内回流对厌氧氨氧化UASB反应器脱氮性能的影响 [J]. 中国环境科学, 2016,36(12):3560-3566.
Fu K M, Su X Y, Wang H F, et al. Influence of internal reflux on the denitrification performance of UASB reactor[J]. China Environmental Science, 2016,36(12):3560-3566.
[44] Miao Y, Peng Y, Zhang L,et al. Partial nitrification-anammox (PNA) treating sewage with intermittent aeration mode: Effect of influent C/N ratios [J]. Chemical Engineering Journal, 2018,334:664-672.
[45] Lu H-F, Zheng P, Ji Q-X, et al. The structure, density and settlability of anammox granular sludge in high-rate reactors [J]. Bioresource Technology, 2012, 123(123):312-317.
[46] 许冬冬,康 达,郭磊艳,等.厌氧氨氧化颗粒污泥研究进展 [J]. 微生物学通报, 2019,46(8):1988-1997.
Xu D D, Kang D, Guo Ly, et al. Research progress of anammox granular sludge [J]. Microbiology Bulletin, 2019,46(8):1988-1997.
Mechanism of excessive removal of ammonia nitrogen by anammox UASB system.
YUAN Lin-jie1, YUAN Lin-jiang1*, CHEN Xi2, YANG Rui1, YU Li-ping1, WANG Gang1, HE Xiang-feng1, YANG Jiang-wei1
(1.Key Laboratory of Northwest Water Resources and Environmental Ecology, Ministry of Education, Key Laboratory of Environmental Engineering of Shaanxi Province, School of Environmental and Municipal Engineering, Xi'an University of Architecture and Technology, Xi'an, 710055, China;2.School of Urban Planning and Municipal Engineering, Xi'an Polytechnic University, Xi'an, 710048, China)., 2021,41(10):4686~4694
The UASB reactor was used to investigate the excess removal characteristics of NH4+-N by the anaerobic ammonia oxidation system, the catalytic activity of related enzymes, and the bacterial communitystructure of the sludge with changing ratio of NO2--N / NH4+-N. The results showed that as the concentration of influent NO2--N decreaseed, the removal of NH4+-N by the reactor increaseed compared to the theory. When the supply of nitrite was stopped, the removal of NH4+-N in the reactor reached up to 55mg/L. The removal of NH4+-N was not due to the anaerobic ammonia oxidization by the SO42-and Fe3+/EDTA complex from the feed water, but the aerobic nitration of NH4+-N. The analysis of catalase determination combined with molecular biology technology showed that the oxygen required for aerobic nitrification came from influent water and catalase oxygen production. The activity of ammonia oxidizing bacteria (AOB) and anaerobic ammonia oxidizing bacteria (AnAOB) in the bottom sludge bed was better than that in the upper sludge bed. On the contrary, the activity of heterotrophic denitrifying bacteria (HDB) in the upper sludge bed was better than that in the bottom sludge bed, and the two parts of sludge bed synergistically converted NH4+-N into N2.
anaerobic ammonia oxidation;nitrogen excess removal;hydrogen peroxide;catalase
X703
A
1000-6923(2021)10-4686-09
袁林杰(1995-),男,安徽合肥人,西安建筑科技大学硕士研究生,主要从事城市污水处理理论与技术.
2021-03-10
国家自然科学基金资助项目(51878538);陕西省自然科学基金资助项目(2021JQ-690)
* 责任作者, 教授, yuanlinjiang@xauat.edu.cn
