漂浮型BiOCl0.6I0.4/GO光催化剂的制备及其除藻性能
2021-10-26杨留留陈厚望
杨留留,刘 宏,陈厚望,陈 猛,张 鹏
漂浮型BiOCl0.6I0.4/GO光催化剂的制备及其除藻性能
杨留留,刘 宏*,陈厚望,陈 猛,张 鹏
(苏州科技大学环境科学与工程学院,江苏 苏州 215009)
通过以膨胀珍珠岩(EP)为载体,水浴加热原位合成漂浮型BiOCl0.6I0.4/GO光催化剂,并研究其在可见光下对铜绿微囊藻的去除效果.利用X射线衍射(XRD)、扫描电镜(SEM)、傅里叶红外光谱(FT-IR)、紫外可见漫反射光谱(UV-Vis DRS)、X射线能谱(XPS) 等方法对合成样品的组成和形貌结构进行了表征.结果显示,BiOCl0.6I0.4/GO/EP复合材料比BiOCl0.6I0.4/EP和GO/EP具有更强的光催化除藻效果,且在4次循环使用之后仍有较好的光催化活性.此外,自由基捕获实验证明光催化反应中光生空穴(h+)是藻类失活的主要活性物质.最后,根据能带分析和自由基捕获试验提出BiOCl0.6I0.4/GO/EP复合材料的反应机理.
BiOCl0.6I0.4/GO;可见光;光催化;藻类去除
近些年来,随着城市化发展、工农业废水的大规模排放等因素的影响,大量的氮、磷营养物质进入水体,导致水体富营养化,从而引起蓝藻水华等环境危机频发[1].日益严重的蓝藻水华已经成为全球性的生态问题[2].藻类过度繁殖不仅影响景观环境,而且多数有害藻类如铜绿微囊藻产生的毒素会对水源造成污染,进而威胁饮水安全[3].
目前控藻抑藻的方法主要有物理法(如机械打捞[4]、超声波除藻[5])、化学法(如投加杀藻剂[6])、生物法(如引入食藻生物)等.然而,这些传统的方法或多或少存在着缺陷,如成本高、处理效果不稳定、易造成二次污染等,在实际应用方面受到相应的制约[7].相较于当前主流治理技术中存在的不足,光催化技术以其环境友好、高效且成本低、降解效果好等优点,近年来逐渐应用于环境领域,同时也被认为是最具发展前景的控藻、除藻技术[8-9].
在众多的光催化材料中,二氧化钛因其稳定性好,无毒且制作成本低等优点被广泛研究.Liu等[10]发现TiO2被光激发能产生强羟基自由基,从而能实现对微囊藻毒素的光降解.Wang等[11]曾通过在TiO2中掺杂N和P来调整光吸收能力和光生电子-空穴对的分离速率.在可见光照射6h后,藻细胞结构被破坏,最终失活率达到81.5%.然而,TiO2作为半导体,因为其禁带宽度较大、光电子寿命短等缺点,严重限制了其在除藻方面的应用[12-13].因此,设计新型光催化材料高效去除藻类已是当务之急.
氯氧化铋作为半导体材料中的一种,以其独特的层状晶体结构和高光学稳定性受到学者们的广泛关注[14].BiOCl特殊的层状结构能够使层与层之间形成内部静电场,可以有效促进光生电子空穴对的分离,进而增加其光催化活性[15].但是由于其具有较大的带隙值(3.4eV),所以仅能在紫外线下显示良好的活性[16].因此,为了提高BiOCl在可见光下的光催化性能,研究人员发现可以通过形成固溶体的方式来拓宽光响应范围[17].由于BiOI具有较小的禁带宽度值(约1.8eV),对可见光有响应且与BiOCl的结构相似,所以两者可以形成光催化性能优异的固溶体.Xu等[18]通过合成BiOClxI1-x固溶体降解罗丹明B的实验发现,合成材料在可见光下降解效果远高于单一的BiOI和BiOCl.此外,通过和其他材料复合构成异质结,也可以进一步提高BiOCl的可见光响应性[19].氧化石墨烯(GO)具有较大的比表面积、良好的热化学稳定性和优秀的电荷转移能力等优点,是一种理想的光电子转移和接收材料[20],其可以在改善光生电子空穴对复合等方面发挥重要作用[21].由此,将 BiOCl的固溶体与GO复合,可有助于光催化材料催化性能的进一步提升.
现阶段对BiOCl型光催化剂的研究大多数集中于染料的降解[22]、废水中污染物处理[23]等方向,对抑藻控藻方面的研究报道十分有限.原因可能是一方面光催化剂易沉淀、难回收;另一方面因为藻类的趋光性使其常漂浮于水层表面,从而使光催化剂难以与藻类充分接触,影响去除效率.膨胀珍珠岩(EP)以其多孔漂浮、易于回收等优点可选作为光催化剂的漂浮载体,将有助于光催化材料与藻细胞接触.
因此,通过水浴加热法原位合成BiOCl0.6I0.4/GO光催化材料,并负载于膨胀珍珠岩(EP)上,以此制备一种漂浮型光催化剂.采用一系列的表征方法对其形貌结构、元素组成等进行了分析.研究其在可见光下对铜绿微囊藻的去除效果.考察了投加量、腐殖酸等因素对光催化效果的影响,并分析光催化作用下铜绿微囊藻的藻胆蛋白含量变化、膜透性的变化.最后,对其除藻的机制进行了探讨.
1 材料与方法
1.1 主要试剂及材料
五水合硝酸铋 (Bi(NO3)3·5H2O,分析纯,国药集团化学试剂有限公司);碘化钾(KI,分析纯,天津博迪化工股份有限公司);氯化钾(KCl,分析纯,天津博迪化工股份有限公司);氧化石墨烯(GO,天津博迪化工股份有限公司);铜绿微囊藻(FACHB-930,中国科学院水生生物研究所);膨胀珍珠岩(EP,信阳中科矿业有限公司).
1.2 主要仪器
X-射线衍射仪(D8advance,德国布鲁克公司);扫描电镜(Quanta FEG 250,美国FEI公司);红外光谱仪(VERTEX70,德国布鲁克公司);紫外可见分光光度计(UV2700,日本岛津);电感耦合等离子体原子发射光谱仪(ICPOES730,日本安捷伦).
1.3 催化剂的制备
1.3.1 膨胀珍珠岩(EP)预处理 选取30-40目的膨胀珍珠岩(EP),将其在5%稀硝酸中浸泡24h,静置前搅拌2~3次以去除表面杂质.之后收集上层的漂浮材料,用去离子水清洗至中性,于60℃下烘干.
1.3.2 BiOCl0.6I0.4/GO/EP的制备 首先称取6mmol的五水合硝酸铋分散到50mL乙二醇中,充分搅拌至形成均匀溶液,记为溶液A.称取2.4mmol碘化钾和3.6mmol氯化钾充分溶解在50mL去离子水中,记为溶液B.称取不同质量的GO(0.1g、0.2g、0.3g和0.4g)分散于30mL去离子水中,超声形成分散液,记为溶液C.
将A溶液转移到90℃恒温水浴锅中,加入溶液C,再称取3g EP加入溶液A.在不断搅拌下,将溶液B缓慢滴加入溶液A中.滴加完成后在水浴条件下继续反应1h.将所得的样品离心分离,于60℃下真空干燥12h,筛去粉末,得到不同GO质量的BiOCl0.6I0.4/ GO/EP样品,分别记为BG/EP-1, BG/EP-2,BG/EP-3, BG/EP-4,储存备用.按上述步骤,不加GO,制得对照样品BiOCl0.6I0.4/EP.
1.4 催化剂的表征
采用X射线衍射仪对样品进行物相组成分析,扫描角度为10°~80°.使用扫描电镜SEM对样品的微观形貌进行分析.采用VERTEX70型红外光谱仪对材料的结构和化学键组成进行分析.利用UV-Vis DRS对材料的禁带宽度进行分析.XPS分析样品的元素组成、价态等.
1.5 光催化除藻
1.5.1 藻种的培养 本实验将对蓝藻水华中最典型的藻类铜绿微囊藻进行实验研究.将BG-11培养液先高压灭菌,然后将铜绿微囊藻接入培养液中,放置在光照培养箱中培养.培养箱设置参数为:光照强度2000lx,光暗比12h:12h,温度(25±1)℃,每天摇动2~3次.
1.5.2 光催化实验 实验所需的初始藻溶液是取对数增长期的藻培养液,在5000r/min下离心分离5min,弃去上清液,用超纯水清洗离心3次,最后稀释至OD680=0.2备用[24].用300W氙灯模拟太阳光(采用滤光片滤去420nm以下的紫外光),氙灯外围接回流水,以便消除实验过程中温度对实验造成的影响.用低转速磁力搅拌装置模拟自然水体的湍流流动[25].
取0.1g的光催化材料加入到100mL铜绿微囊藻溶液中,避光暗反应30min后,打开氙灯及外接的回流水,每隔1h取5ml藻液,通过Gongduan Fan等[26]方法测量溶液中叶绿素a含量,按(1)式验证光催化材料对铜绿微囊藻的去除效果.
去除率=(1-C/0)´100% (1)
式中:C为时刻藻细胞中叶绿素a浓度;0为光催化处理前的叶绿素a浓度.
1.6 分析方法
1.6.1 藻胆蛋白的测定 铜绿微囊藻中的藻胆蛋白(PB)一般分为藻蓝蛋白(PC)、藻红蛋白(PE)和别藻蓝蛋白(APC)三种[27].实验采用Padgett等[28]方法提取:在光催化反应过程中,每隔1h取10mL藻液,离心后用磷酸缓冲液洗涤2~3次,然后加入10mL缓冲液摇晃均匀.在-20℃/25℃的温度条件下冻融3次,之后用细胞破碎仪处理10min使细胞完全破裂.然后离心取上清液,分别测其在OD565、OD620和OD650下的吸光度值,计算出PC、PE、APC的含量.
1.6.2 膜透性分析 通过测定藻细胞中K+、Ca2+、Mg2+离子的释放量来研究材料在光催化过程中对膜透性的影响[29].在光催化反应过程中,每隔1h取10mL藻液,离心后用0.45μm的滤器过滤上清液.加入适量硝酸,使硝酸含量达到1%,酸化上清液.然后用电感耦合等离子发射光谱仪测定离子浓度,按照(2)式计算离子释放量.
离子释放量=(C-0)/(max-0)´100% (2)
式中:C为时刻离子含量,mg/L;0为光催化处理前离子含量,mg/L;max为藻细胞完全破裂时离子最大释放含量,mg/L.
1.6.3 自由基捕获实验 为了确定光催化过程中主要的活性物质,利用异丙醇(IPA)、对苯醌(BQ)和草酸铵(AO)分别作为羟基自由基(·OH)、超氧自由基(·O2-)和空穴(h+)的捕获剂.在光催化实验中,分别在藻液中加入1mmol的IPA、BQ和AO,其他条件相同的条件下测定叶绿素a的变化.
2 结果与分析
2.1 光催化剂的表征
2.1.1 X-射线衍射分析 从图1中可以看出,载体EP在2为20°~30°时有较宽的衍射峰,但在制得的光催化剂样品中,并无明显的特征衍射峰,这说明EP作为载体对于所负载的光催化材料无明显影响.对照BiOCl标准卡片JCPDS NO.06-0249,可以发现合成的BG/EP系列的衍射峰向2减少的方向有轻微移动,这可能是由于BiOCl中引入了I-形成固溶体造成的[30].由于氧化石墨烯的特征衍射峰在10.8°左右,而在合成的BG/EP系列样品中发现衍射角2为10.8°时,该处的衍射峰峰强随着GO的添加量增大而明显增强,这说明GO与BiOCl0.6I0.4成功复合[31].此外,合成材料特征衍射峰值尖锐,证明材料的结晶度较好.

图1 样品的XRD图谱
2.1.2 SEM分析 图2为EP、BiOCl0.6I0.4/EP和BG/EP-3的SEM图.从图2(a)中可以看出,膨胀珍珠岩作为载体,表面有着凹凸不平的表面和沟壑,这为光催化材料提供较大的负载面积.图2(b)可以清楚的看到合成的BiOCl0.6I0.4大量的负载在EP表面褶皱内.复合材料BG/EP-3如图2(c)和图2(d)所示,可以看到BiOCl0.6I0.4与GO紧密结合在一起,并负载于膨胀珍珠岩上.BiOCl0.6I0.4呈现微球形状,微球的直径在1~2μm左右,这说明合成的固溶体形貌并没有被复合的GO所改变.

图2 光催化剂的SEM图
(a) EP ;(b) BiOCl0.6I0.4/EP; (c) (d) BG/EP-3
2.1.3 FT-IR图谱分析 如图3所示为GO/EP、BiOCl0.6I0.4/EP、BG/EP-3的FT-IR图.从图中可以看出,1706cm-1处为氧化石墨烯的C=O伸缩振动吸收峰,1048cm-1处为C—O伸缩振动吸收峰[32]. 525cm-1和1383cm-1处的吸收峰是由Bi—O伸缩振动[33]和Bi—Cl不对称伸缩振动产生的[34].在525cm-1附近有强峰位于878cm-1,其代表是I—O伸缩振动[35].而480cm-1和788cm-1处的吸收峰则是由膨胀珍珠岩组分中Si—O(Si—O—Si、Si—O—Al)的弯曲伸缩振动引起的[36].2932cm-1处的吸收峰为材料表面大气碳氢化合物的C—H伸缩振动产生的[37].所有样品位于3425cm-1和1627cm-1处的吸收峰是由材料表面吸附水的羟基伸缩振动产生[35].结果表明,本实验成功制备了漂浮型BG/EP-3光催化材料.
2.1.4 X射线光电子能谱分析 如图4(a)为BG/ EP-3的全谱扫描,从图中可以清楚看到Bi、O、Cl、I、C五种元素的存在.图4(b)是C 1谱图,主要是对复合材料GO中碳原子不同状态的结合能加以分析.其中,284.8eV对应于sp2杂化的C—C键的结合能[38], 286.54eV和287.64eV分别对应C—O键和O—C=O键的结合能[39],这些说明材料中含氧官能团比例高.样品中Bi 4图谱中位于Bi 47/2和Bi 45/2轨道处可以拟合成两组峰[40].

图3 光催化剂的FT-IR图谱
如图4(c)所示,158.21eV和163.52eV结合能处的主峰对应Bi3+,而159.81eV和165.13eV的峰对应Bi5+[30].图4(d)为O 1的高分辨率光谱,可以看到位于531.46eV和532.97eV两个拟合峰,其中531.46eV处对应层状结构[Bi2O2]2+中的Bi—O键,而532.97eV处属于材料表面吸附的H2O或OH-[41].
图4(e)显示Cl 2在结合能为196.88eV和198.64eV处具有Cl 23/2和Cl 21/2两个拟合峰[42].I 3的高分辨率光谱如图4(f)所示,在I 33/2和I 35/2处可以拟合成两组峰,618.03eV和629.57eV对应I-,619.59eV和631.13eV对应I3-[30].

(a)全图;(b)C 1;(c)Bi 4;(d)O 1;(e)Cl 2;(f)I 3
2.1.5 紫外可见漫反射吸收光谱分析 如图5(a)所示,单一的GO最大的吸收带边约为468nm,单一的BiOCl0.6I0.4的吸收带波长小于590nm,而BG/ EP-3复合材料可以吸收最大波长为635nm的可见光.这说明膨胀珍珠岩作为载体,随着GO的加入,材料有更宽的可见光吸收范围.这同时也表明复合材料可见光响应能力的提高,比之前具有更高的光催化活性.
通过式(3)计算材料的带隙宽度:
=(-E)/2(3)
式中:表示吸收系数;表示普朗克常量;表示光频率;表示常数;E表示禁带宽度.
由于BiOCl0.6I0.4为间接带隙半导体,所以取4.以()1/2为轴,为轴作图,曲线的切线在轴上的截距即为禁带宽度.结果如图5(b)所示, BiOCl0.6I0.4和GO的带隙宽度分别为2.41eV和2.68eV.
如图5(c)和图5(d)所示,利用XPS价带谱确定了BiOCl0.6I0.4的VB(VBM)最大值为0.82eV,GO的VB(VBM)最大值为3.23eV.导带(CB)的位置可利用公式(4)得出:
CBM=E-VBM(4)
式中:E表示的是禁带宽度;CBM表示导带电位;VBM表示价带电位.
计算出BiOCl0.6I0.4和GO的导带分别为-1.59eV和+0.55eV,结果与文献中的实验结果相近[19,43].

(a)UV-vis DRS;(b)禁带宽度;(c)(d)价带谱
2.2 光催化除藻
2.2.1 掺杂量对光催化除藻的影响 通过藻细胞中叶绿素a含量的变化,分析材料的光催化性能.不同掺杂量对光催化除藻的影响如图6所示.在无催化剂条件下,对照组叶绿素a的含量在光照6h后无明显变化,说明可见光照射和搅拌对藻类影响不大.在仅投加膨胀珍珠岩(EP)条件下,经过30min的暗吸附,叶绿素a浓度有所降低,且光照6h前后浓度无明显变化,表明该漂浮载体对藻类具有一定的吸附效果.在光催化反应阶段可以看出,BG/EP-1、BG/ EP-2、BG/EP-3、BG/EP-4漂浮型复合材料对藻类的去除效果均大于BiOCl0.6I0.4/EP和GO/EP,且BG/EP-3对藻细胞去除效果最为显著,在光照6h后达到96.27%.从复合材料系列来看,随着GO的掺杂量增加,藻细胞的去除率先增大后减少.这可能是由于过多的GO在材料表面造成团聚,减少了活性位点,同时也减少负载于膨胀珍珠岩(EP)上的BiOCl0.6I0.4与藻细胞的接触面积,从而降低了光催化活性[39].
2.2.2 催化剂投加量对除藻效果的影响 如图7所示,用去除效率最佳的BG/EP-3考察投加量对光催化除藻的影响.对照组在不添加催化剂条件下,藻细胞生长正常.相较而言,实验组叶绿素a浓度在30min暗吸附和6h光催化反应下均有所降低.在暗吸附过程中,随着投加量的增大,叶绿素a浓度降低越明显,这是由于增大了材料与藻类的接触面积,提高了吸附效率.当投加量为3g/L时,暗吸附去除率达46.62%.在光催化反应过程中,随着投加量的增加,铜绿微囊藻的去除率先提高后下降,6h后的去除率分别为38.99%、79.48%、96.27%、93.07%、86.33%,其中当BG/EP-3投加量达到1g/L时,光催化去除率最高.这说明了提高投加量可以提供更多的活性位点,从而提高光催化效率[29].但过量光催化剂容易造成材料的光利用效率下降,从而导致除藻效率降低[44].
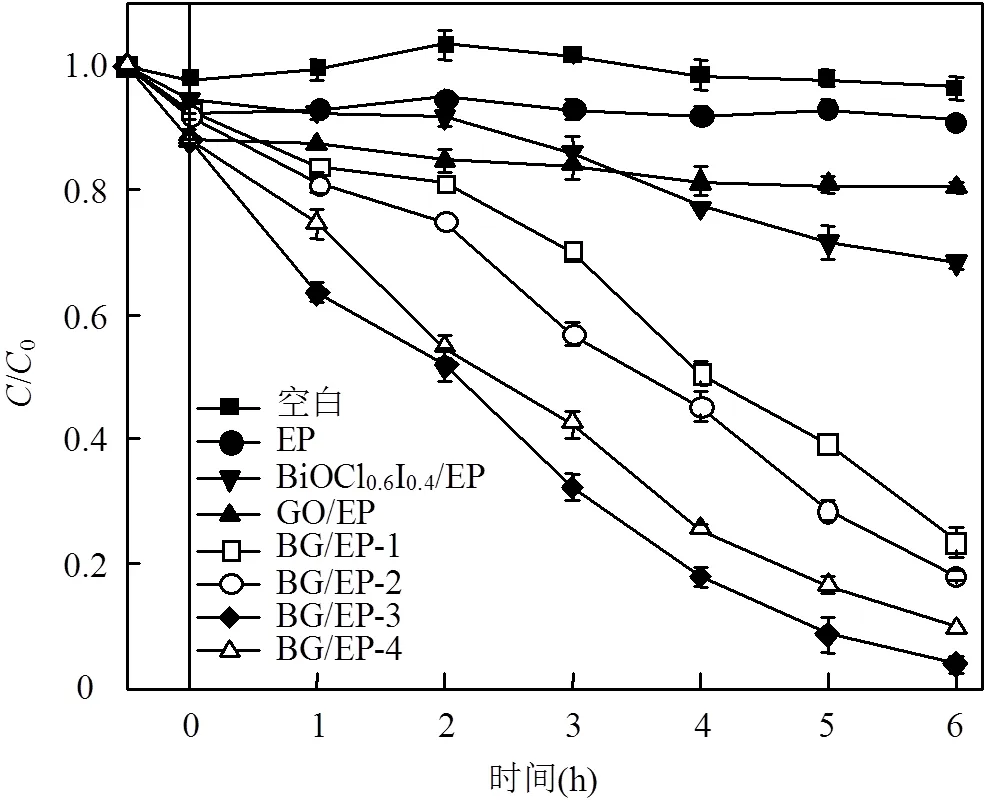
图6 光催化剂对叶绿素a的降解率

图7 不同投加量对除藻效果的影响
2.2.3 水环境中溶解有机物的影响 天然水体中的溶解物质很多,溶解性有机物(DOM)亦是复杂多样.其中,最典型的溶解性有机物包括腐殖酸(HA)和富里酸(FA)等,更是会影响光催化活性[45].如图8所示,探究了不同浓度的腐殖酸和富里酸对复合材料光催化效果的影响.当HA和FA浓度为5mg/L时,复合材料对藻类去除效率为88.69%和92.43%.随着浓度的升高到10mg/L时,去除效率进一步降低,为84.07%和87.89%.结果表明,HA和FA的存在,影响了材料的光催化效果,且浓度越高,对光催化抑制越明显.原因可能如下:一方面,溶解的HA和FA削弱了可见光的透过率[20].另一方面,HA和FA与藻类竞争光催化剂表面的活性位点和活性物质,导致去除率的下降[46].总体来说,DOM的存在并没有导致光催化剂性能的显著降低,该材料能够在水环境领域获得广泛的利用.

2.2.4 循环实验分析 为了探究催化剂的可重复使用性和稳定性,实验通过对BG/EP-3多次循环使用来判断该材料的性能.实验结果如图9所示,随着重复使用的次数增加,催化剂对藻类的去除效率有所下降.在经过4次循环使用后,BG/EP-3对铜绿微囊藻仍能保持82.44%的去除效率,说明该系列材料具有良好的可重复性和稳定性.

图9 BG/EP-3光催化剂的循环利用
2.3 藻类特性分析
2.3.1 藻胆蛋白分析 铜绿微囊藻中藻胆蛋白的作用主要与藻类细胞的光合作用有关[47].因此,可以通过分析光催化过程中PC、PE、APC含量变化来研究合成的光催化剂对藻类光合作用的影响.从图10(a)、图10(b)和图10(c)可以看出,藻类正常生长情况下,PC、PE、APC含量趋于稳定.在光催化过程中,PC、PE、APC含量在前1h内迅速下降,后下降缓慢或趋于稳定.6h后,PC、PE、APC相对浓度分别达到15.33、58.20、43.87.结果表明,BG/EP-3光催化剂能够有效的影响铜绿微囊藻中的藻胆蛋白,从而破坏藻类的光合作用,最终使得铜绿微囊藻失活.


图11 光催化过程中K+、Ca2+、Mg2+的释放量
2.3.2 膜透性分析 K+、Ca2+、Mg2+在维持藻细胞渗透压中起着重要作用[48].可以通过测定藻液中离子的释放量来判断藻细胞膜的破坏程度[49].如图11所示,在光催化反应过程中,这三种离子的释放量都呈现上升趋势.在反应6h后,K+、Ca2+、Mg2+释放量分别为94.54%、28.85%、84.60%.特别是在光催化反应的前两小时内,离子释放量大幅度上升,这表明藻细胞中大量K+、Ca2+、Mg2+被释放,藻细胞膜遭到破坏.结果显示,该光催化剂能够使藻类膜透性丧失,进而使铜绿微囊藻失活.

图12 不同捕获剂对光催化性能的影响
2.4 自由基捕获实验
通过在实验中加入不同的自由基捕获剂,以此考察BG/EP-3光催化过程中主要的活性基团[50].结果如图12所示,加入3种不同的自由基捕获剂后,光催化剂对铜绿微囊藻的去除率有一定程度的下降.其中,异丙醇对光催化反应的影响较小,去除率从96.27%降到86.56%,·OH的抑制贡献率为9.71%.而对苯醌和草酸铵的影响较大,去除率分别为55.82%和17.52%,·O2-、h+的抑制贡献率为40.45%和78.75%.活性基团的影响程度为:h+>·O2->·OH.结果表明,光生空穴(h+)是光催化反应中藻类失活的主要活性物质.
2.5 光催化除藻的机理分析
根据UV-vis DRS图谱和价带谱计算得到BiOCl0.6I0.4和GO的价带和导带,分析BG/EP-3光催化除藻的作用机理.对于BiOCl0.6I0.4,其价带VBM为0.82eV,导带CBM为-1.59eV,CB位置的电势相较于O2还原为·O2-的电势(-0.33eV vs. NHE)更负,因此可以将材料表面的O2还原[51].但VB处的电势比H2O氧化成·OH的电势(2.38eV vs. NHE)更负,所以其光生空穴不能将H2O氧化[52].同理以上论述,对于GO,其价带VBM为3.23eV,导带CBM为0.55eV,可以将H2O氧化成·OH但不能将O2还原为·O2-.

图13 BG/EP-3复合材料的光催化反应机理
基于上面所述,BG/EP-3光催化除藻机制如图13所示.BiOCl0.6I0.4在可见光的激发下光电子(e-)从价带向导带跃迁,产生了电子空穴对.由于GO的费米能级在1.4~1.6eV[31],而BiOCl0.6I0.4费米能级低于GO,所以GO导带中的自由电子将转移到BiOCl0.6I0.4的价带中,直至费米能级平衡.然后在BiOCl0.6I0.4中,转移过来的电子受光照激发也向导带跃迁.所以GO的价带中空穴(h+)氧化性能更强,其中大部分空穴用于对藻细胞的氧化,同时也有另外一部分将H2O氧化,产生了少量的·OH.而BiOCl0.6I0.4价带的空穴直接用于藻细胞氧化,导带中的电子将O2还原为·O2-.其同样参与藻细胞降解.由此可推断材料产生的光生空穴的量大于羟基自由基和超氧自由基的量,即光生空穴是光催化反应中主要的活性物质,这与上述自由基捕获实验结果相符.
最后,这些活性物质引起藻类细胞的氧化应激,从而导致藻类细胞的破裂和死亡,最终达到抑制藻类细胞生长的目的.
3 结论
3.1 以膨胀珍珠岩(EP)为载体,水浴加热原位合成漂浮型BiOCl0.6I0.4/GO光催化材料.通过XRD、SEM、FTIR、XPS和UV-Vis DRS等方法对材料进行表征,确定了BiOCl0.6I0.4/GO/EP光催化材料的成功合成.
3.2 通过光催化除藻实验证明,BiOCl0.6I0.4/GO/EP光催化剂比单一的BiOCl0.6I0.4/EP和GO/EP具有更好的光催化效果.当GO的量为0.3g时,制得的材料对铜绿微囊藻的去除效果最为显著,在光照6h后达到96.27%.投加量、腐殖酸等在一定程度上会影响光催化除藻效果.根据重复实验证明,该复合材料在经过4次重复利用后对藻类仍能保持82.44%的去除效率,说明该系列材料具有良好的稳定性.
3.3 通过UV-Vis DRS以及XPS价带谱确定了BiOCl0.6I0.4、GO和BG/EP-3的吸收光最大波长,以及BiOCl0.6I0.4与GO禁带宽度和能级位置.并根据自由基捕获试验得出,光生空穴(h+)是光催化反应中藻类失活的主要活性物质,分析了该光催化剂除藻的反应机理.
[1] Gobler C J, Doherty O M, Hattenrath-Lehmann T K, et al. Ocean warming since 1982has expanded the niche of toxic algal blooms in the North Atlantic and North Pacific oceans [J]. PNAS, 2017,114(19): 4975-80.
[2] Thees A, Atari E, Birbeck J, et al. Isolation and Characterization of Lake Erie Bacteria that Degrade the Cyanobacterial Microcystin Toxin MC-LR [J]. Journal of Great Lakes Research, 2019,45(1):138-49.
[3] 孙 凤,俞鸿飞,胥辰卉,等.蓝藻胞外聚合物对供水管网水质的影响[J]. 中国环境科学, 2020,40(12):5343-5351.
Sun F, Yu H F, Xu C H, et al. Influence of cyanobacterial extracellular polymeric substances on the water quality in water supply distribution system [J]. China Environmental Science, 2020,40(12):5343-5351.
[4] 宋靖珂,王学江,王佳忆,等.漂浮型Ag2CrO4-g-C3N4-TiO2/膨胀珍珠岩可见光催化材料除藻性能[J]. 复合材料学报, 2021,38(6):1914- 1921.
Song J, Wang X J, Wang J Y, et al. Photocatalytic inactivation of algae using floating visible-light-responsive photocatalyst Ag2CrO4-g- C3N4-TiO2/modified expanded perlite [J]. Acta Materiae Compositae Sinica, 2021,38(6):1914-1921.
[5] Park J, Church J, Son Y, et al. Recent advances in ultrasonic treatment: Challenges and field applications for controlling harmful algal blooms (HABs) [J]. Ultrasonics Sonochemistry, 2017,38(17):326-334.
[6] Wang X, Song J, Zhao J, et al. In-situ active formation of carbides coated with NP-TiO2nanoparticles for efficient adsorption- photocatalytic inactivation of harmful algae in eutrophic water [J]. Chemosphere, 2019,228(19):351-359.
[7] Fan G, Du B, Zhou J, et al. Stable Ag2O/g-C3N4p-n heterojunction photocatalysts for efficient inactivation of harmful algae under visible light [J]. Applied Catalysis B: Environmental, 2020,265:118610.
[8] He Y, Sutton N B, Rijnaarts H H H, et al. Degradation of pharmaceuticals in wastewater using immobilized TiO2photocatalysis under simulated solar irradiation [J]. Applied Catalysis B: Environmental, 2016,182:132-141.
[9] Reddy P A K, Reddy P V L, Kwon E, et al. Recent advances in photocatalytic treatment of pollutants in aqueous media [J]. Environment International, 2016,91:94-103.
[10] Liu I, Lawton L A, et al. Mechanistic studies of the photocatalytic oxidation of microcystin-LR: an investigation of byproducts of the decomposition process [J]. Environmental science & technology, 2003,37(14):3214-3219.
[11] Wang X, Wang X, Song J, et al. A highly efficient TiOX (X= N and P) photocatalyst for inactivation of Microcystis aeruginosa under visible light irradiation [J]. Separation and Purification Technology, 2019,222: 99-108.
[12] 郭 梅,任学昌,王建钊,等.TiO2/pg-C3N4复合催化剂的制备及光催化性能[J]. 中国环境科学, 2019,39(12):5119-5125.
Guo M, Ren X C, Wang J Z, et al. Preparation and photocatalytic properties of TiO2/pg-C3N4composite photocatalyst [J]. China Environmental Science, 2019,39(12):5119-5125.
[13] Wang C, Zhao Y, Xu H, et al. Efficient Z-scheme photocatalysts of ultrathin g-C3N4-wrapped Au/TiO2-nanocrystals for enhanced visible-light-driven conversion of CO2with H2O [J]. Applied Catalysis B: Environmental, 2020,263:118314.
[14] Zhang G, Cai L, Zhang Y, et al. Bi5+, Bi(3-x)+, and oxygen vacancy induced BiOClxI1-xsolid solution toward promoting visible-light driven photocatalytic activity [J]. Chemistry, 2018,24(29):7434-7444.
[15] 罗 伟,冯晓青,黄 影,等.微波水热合成花球状BiOCl光催化降解甲硝唑[J]. 中国环境科学, 2020,40(4):1545-1554.
Luo W, Feng X Q, Huang Y, et al. Photocatalytic degradation of metronidazole using flower-like BiOCl prepared by microwave hydrothermal method [J]. China Environmental Science, 2020,40(4): 1545-1554.
[16] Chen Y, Zhu G, Liu Y, et al. Preparation of hollow Ag/AgCl/BiOCl microspheres with enhanced photocatalytic activity for methyl orange under LED light irradiation [J]. Journal of Materials Science: Materials in Electronics, 2016,28(3):2859-2866.
[17] Liu Y, Son W J, Lu J, et al. Composition dependence of the photocatalytic activities of BiOCl1-xBrxsolid solutions under visible light [J]. Chemistry-A European Journal, 2011,17(34):9342-9349.
[18] Xu H Y, Lu D, Tan Q, et al. Visible-light-driven photocatalytic degradation of rhodamine B in water by BiOClxI1-xsolid solutions [J]. Water Science and Technology, 2020,81(5):1080-1089.
[19] Hu X, Zhang Y, Wang B, et al. Novel g-C3N4/BiOClxI1-xnanosheets with rich oxygen vacancies for enhanced photocatalytic degradation of organic contaminants under visible and simulated solar light [J]. Applied Catalysis B: Environmental, 2019,256:117789.
[20] Fan G, Chen Z, Hong L, et al. Simultaneous removal of harmful algal cells and toxins by a Ag2CO3-N:GO photocatalyst coating under visible light [J]. Science of the Total Environment, 2020,741:140341.
[21] 张志伟,徐 斌,张毅敏,等.GO/(CeO2-TiO2)改性复合膜紫外光催化去除氨氮、DOC [J]. 中国环境科学, 2020,40(3):1116-1122.
Zhang Z W, Xu B, Zang Y M, et al. Ultraviolet photocatalytic removal of ammonia nitrogen and DOC by GO/(CeO2-TiO2) modified composite membrane [J]. China Environmental Science, 2020,40(3): 1116-1122.
[22] Sun X, Du Y, Li Z, et al. Facile synthesis of g-C3N4/BiOClxI1-xhybrids with efficient charge separation for visible-light photocatalysis [J]. Ceramics International, 2020,46(8):10843-10850.
[23] Adenuga D O, Tichapondwa S M, Chirwa E M N. Facile synthesis of a Ag/AgCl/BiOCl composite photocatalyst for visible–light–driven pollutant removal [J]. Journal of Photochemistry and Photobiology A: Chemistry, 2020,401:112747.
[24] Song J, Wang X, Ma J, et al. Visible-light-driven in situ inactivation of Microcystis aeruginosa with the use of floating g-C3N4heterojunction photocatalyst: Performance, mechanisms and implications [J]. Applied Catalysis B: Environmental, 2018,226: 83-92.
[25] Wang X, Wang X, Zhao J, et al. Solar light-driven photocatalytic destruction of cyanobacteria by F-Ce-TiO2/expanded perlite floating composites [J]. Chemical Engineering Journal, 2017,320:253-263.
[26] Fan G, Chen Z, Wang B, et al. Photocatalytic removal of harmful algae in natural waters by Ag/AgCl@ZIF-8 coating under sunlight [J]. Catalysts, 2019,9(8):698.
[27] Vali Aftari R, Rezaei K, Mortazavi A, et al. The Optimized concentration and purity of spirulina platensis C-Phycocyanin: A comparative study on microwave-assisted and ultrasound-assisted extraction methods [J]. Journal of Food Processing and Preservation, 2015,39(6):3080-3091.
[28] Padgett M P, Krogmann D W. Large scale preparation of pure phycobiliproteins [J]. Photosynthesis Research, 1987,11(3):225-235.
[29] Fan G, Zhan J, Luo J, et al. Fabrication of heterostructured Ag/AgCl@g-C3N4@UIO-66(NH2) nanocomposite for efficient photocatalytic inactivation of Microcystis aeruginosa under visible light [J]. Journal of Hazardous Materials, 2021,404:124062.
[30] Ma X, Chen K, Niu B, et al. Preparation of BiOCl0.9I0.1/β-Bi2O3composite for degradation of tetracycline hydrochloride under simulated sunlight [J]. Chinese Journal of Catalysis, 2020,41(10): 1535-1543.
[31] Fan G, Hong L, Luo J, et al. Photocatalytic inactivation of harmful algae and degradation of cyanotoxins microcystin-LR using GO- based Z-scheme nanocatalysts under visible light [J]. Chemical Engineering Journal, 2020,392:123767.
[32] Bradder P, Ling S K, Wang S, et al. Dye adsorption on layered graphite oxide [J]. Journal of Chemical & Engineering Data, 2011, 56(1):138-141.
[33] Liu Z S, Wang J X. Face-to-face BiOCl/BiO2-xheterojunction composites with highly efficient charge separation and photocatalytic activity [J]. Journal of Alloys and Compounds, 2020,832:153771.
[34] Maisang W, Promnopas S, Kaowphong S, et al. Microwave-assisted hydrothermal synthesis of BiOBr/BiOCl flowerlike composites used for photocatalysis [J]. Research on Chemical Intermediates, 2020, 46(4):2117-2135.
[35] Zhang X, Wang D, Man X, et al. Influence of BiOIO3morphology on the photocatalytic efficiency of Z-scheme BiOIO3/g-C3N4heterojunctioned composite for Hg(0) removal [J]. Journal of colloid and interface science, 2020,558:123-136.
[36] 张 进,郭迎春,刘婵璐,等.漂浮型BiFeO3/膨胀珍珠岩的制备及其可见光催化性能[J]. 无机化学学报, 2021,37(5):905-913.
Zhang J, Guo Y C, Liu C L, et al.Synthesis and visible light driven photocatalytic properties of floating BiFeO3/expanding perlite photocatalysts [J]. Chinese journal of inorganic chemistry, 2021,37(5): 905-913.
[37] Asl E A, Haghighi M, Talati A. Sono-solvothermal fabrication of flowerlike Bi7O9I3-MgAl2O4pn nano-heterostructure photocatalyst with enhanced solar-light-driven degradation of methylene blue [J]. Solar Energy, 2019,184:426-439.
[38] Bayode A A, Vieira E M, Moodley R, et al. Tuning ZnO/GO p-n heterostructure with carbon interlayer supported on clay for visible- light catalysis: Removal of steroid estrogens from water [J]. Chemical Engineering Journal, 2020:127668.
[39] Qian S, Pu S, Zhang Y, et al. New insights on the enhanced non- hydroxyl radical contribution under copper promoted TiO2/GO for the photodegradation of tetracycline hydrochloride [J]. Journal of Environmental Sciences, 2021,100:99-109.
[40] Xu M M, Zhao Y L, Yan Q S. Efficient visible-light photocatalytic degradation of sulfadiazine sodium with hierarchical Bi7O9I3under solar irradiation [J]. Water Science and Technology, 2015,72(12): 2122-2131.
[41] Liu H, Su Y, Chen Z, et al. Bi7O9I3/reduced graphene oxide composite as an efficient visible-light-driven photocatalyst for degradation of organic contaminants [J]. Journal of Molecular Catalysis A: Chemical, 2014,391:175-182.
[42] Wu K, Qin Z, Zhang X, et al. Z-scheme BiOCl/Bi-Bi2O3heterojunction with oxygen vacancy for excellent degradation performance of antibiotics and dyes [J]. Journal of Materials Science, 2019,55(9):4017-4029.
[43] Shown I, Hsu H C, Chang Y C, et al. Highly efficient visible light photocatalytic reduction of CO2to hydrocarbon fuels by Cu- nanoparticle decorated graphene oxide [J]. Nano Lett, 2014,14(11): 6097-6103.
[44] Fan G, Zhou J, Zheng X, et al. Fast photocatalytic inactivation of Microcystis aeruginosa by metal-organic frameworks under visible light [J]. Chemosphere, 2020,239:124721.
[45] Tan L, Wang X, Tan X, et al. Bonding properties of humic acid with attapulgite and its influence on U(VI) sorption [J]. Chemical Geology, 2017,464:91-100.
[46] Yin K, Deng Y, Liu C, et al. Kinetics, pathways and toxicity evaluation of neonicotinoid insecticides degradation via UV/chlorine process [J]. Chemical Engineering Journal, 2018,346:298-306.
[47] Fan G, Chen W, Luo J, et al. Damaging effects of ultrasonic treatment on the photosynthetic system of Microcystis aeruginosa [J]. Desalination and Water Treatment, 2017,78:350-359.
[48] Zhou S, Yin H, Tang S, et al. Physiological responses ofagainst the algicidal bacterium Pseudomonas aeruginosa [J]. Ecotoxicology and environmental safety, 2016,127:214-221.
[49] Lu R, Liu P, Chen X. Study the toxicity toinduced by TiO2nanoparticles photocatalysis under UV light [J]. Bulletin of environmental contamination and toxicology, 2015,94(4): 484-489.
[50] Zhang Z, Pan Z, Guo Y, et al. In-situ growth of all-solid Z-scheme heterojunction photocatalyst of Bi7O9I3/g-C3N4and high efficient degradation of antibiotic under visible light [J]. Applied Catalysis B: Environmental, 2020,261:118212.
[51] Yang J, Liu Z, Wang Y, et al. Construction of a rod-like Bi2O4modified porous g-C3N4nanosheets heterojunction photocatalyst for the degradation of tetracycline [J]. New Journal of Chemistry, 2020, 44(23):9725-9735.
[52] Motlagh H F, Haghighi M, Shabani M. Sono-solvothermal fabrication of ball-flowerlike Bi2O7Sn2-Bi7O9I3nanophotocatalyst with efficient solar-light-driven activity for degradation of antibiotic tetracycline [J]. Solar Energy, 2019,180:25-38.
Preparation of floating BiOCl0.6I0.4/GO photocatalyst and its algae removal performance.
YANG Liu-liu, LIU Hong*, CHEN Hou-wang, CHEN Meng, ZHANG Peng
(School of Environmental Science and Engineering, Suzhou University of Science and Technology, Suzhou 215009, China)., 2021,41(10):4633~4644
Using expanded perlite(EP) as a floating carrier, the BiOCl0.6I0.4/GO photocatalyst was synthesized by water bath method and its removal efficiency onunder visible light was investigated as well. The composition and morphology of synthesized samples were characterized by XRD, SEM, FTIR spectra, UV-Vis DRS and XPS. Results indicated that the synthesized BiOCl0.6I0.4/GO/EP composite showed better algae removal performance than that of BiOCl0.6I0.4/EP and GO/EP. Even after four cycles reuse, the composite still showed better photocatalytic activity. Furthermore, free radical capture experiment proved that photo-generated holes (h+) were the main active species for the inactivation of algae in photocatalytic process. Finally, according to the energy band analysis and free radical capture experiment, the mechanism of BiOCl0.6I0.4/GO/EP composite was proposed.
BiOCl0.6I0.4/GO;visible light;photocatalysis;algae removal
X703
A
1000-6923(2021)10-4633-12
杨留留(1996-),男,江苏南通人,苏州科技大学硕士研究生,主要从事废水处理与资源化利用方面的研究.
2020-03-22
国家自然科学基金青年基金(51708381);江苏省自然科学基金项目面上项目(BK20181466);江苏省苏州市科技局民生科技项目(SS2019028);苏州市生态环保局环保项目(B201903)
* 责任作者, 副教授, hong.liu@usts.edu.cn
