骨植入医用钛合金表面改性涂层研究进展
2021-10-26江少群
唐 萍,江少群,2,王 刚
(1.河海大学力学与材料学院,江苏 南京 211100)(2.南通河海大学海洋与近海工程研究院,江苏 南通 226019)
1 前 言
随着社会的发展,老年人口和骨科疾病患者对可植入生物医用材料的需求量日益增加[1,2]。过去几十年间,研究者们对具有生物相容性可植入人体的骨科材料开展了广泛的研究。其中,钛及钛合金由于其优良的生物相容性[3],以及与其他金属材料相比具有的无磁性、高耐蚀性、高强度-模量比[4-7]等特点,成为骨科植入材料的研究热点。但由于Ti及TiO2是生物惰性的,未经处理的表面通常表现出较差的细胞粘附性[8,9],因此为了激发钛合金材料的生物活性,需要对其进行表面改性处理。本文对生物医用钛合金的发展过程进行了总结,并重点介绍了生物医用钛合金常见的几种表面改性涂层的研究进展,同时也对其未来相关研究进行了展望,以期为后续研究提供借鉴与思路。
2 医用钛合金发展概述
20世纪40年代,纯钛开始作为生物材料受到关注。20世纪60年代,Branemark将纯钛作为口腔植入材料后,纯钛开始部分取代不锈钢和CoCr合金作为生物植入材料[10],与此同时,医用钛合金也被研究开发。随着研究的深入,钛合金由第一代α型钛合金逐渐向耐腐蚀性能和强度更加优异的第二代α+β型钛合金发展,其中的代表性合金有Ti-6Al-4V、Ti-5Al-2.5Fe、Ti-6Al-7Nb。但第二代钛合金的弹性模量相对人骨弹性模量(0.2~32 GPa)仍比较高,植入物与骨组织的弹性模量不匹配时,应力将被弹性模量更高的植入物吸收,造成骨骼萎缩,产生应力屏蔽,导致植入物松动[11]。因此当前医用钛合金研发以弹性模量更加接近于人体骨骼的第三代亚稳β型和β型为主[12]。该型钛合金在合金元素的选用上还避免了对人体有害的或致敏的元素。目前,低弹性模量的β型钛合金已开发20余种,其中大多具有生物相容性[13]。如日本采用d-电子合金理论设计开发了Ti-29Nb-13Ta-4.6Zr(TNTZ)钛合金,其弹性模量低至50 GPa,生物活性优异,在人体模拟液(simulated body fluid,SBF)中浸泡后能够在其表面检测出磷和钙元素(磷酸钙的组成元素)[14,15];中国科学院金属研究所开发了新型Ti-24Nb-4Zr-7.9Sn合金(Ti2448),其弹性模量仅为45 GPa,强度达850 MPa,表面保护性钝化膜的生成可使其具有较高的耐腐蚀性[16-18]。
在逐渐找到医用钛合金植入材料弹性模量过高问题的解决途径后,研究者将目光集中在了钛合金对细胞增殖分化的影响上[19]。在植入早期阶段,Ti和TiO2表面骨整合能力弱,会导致成骨细胞分化不良,造成植入体周围形成纤维组织[20],进而造成植入物松动并由于摩擦等情况引发炎症。另一方面,目前商业应用成熟的Ti-6Al-4V植入物在体液中易释放对人体有毒害作用的Al离子和V离子。因此,为了增加钛合金植入物的生物活性,阻碍植入物中有毒害离子的释放,对钛合金进行表面改性成为医用钛合金的研究热点。目前,医用钛合金表面改性主要是通过在合金表面沉积相容性涂层或直接改变表面结构与成分[21-23],从而提高生物相容性、耐蚀性、抗菌性、细胞分化等骨整合能力。
3 骨植入医用钛合金表面改性涂层
研究表明,影响植入材料生物相容性以及骨整合能力的重要因素主要包括材料表面润湿性、粗糙度、成分以及晶体类型等[24]。体液环境中,植入材料表面润湿性好时,蛋白质容易吸附,更利于细胞粘附[25],此外,特定的表面形貌更有利于细胞分化生长。作为医用钛合金表面改性的重要方法,在合金表面构建合适的改性涂层,可以在保持合金耐腐蚀性能、力学性能的情况下对合金表面结构、表面成分、润湿性等予以调整,从而实现相容性和骨整合能力的提升。目前,骨植入医用钛合金表面改性涂层常见的主要包括羟基磷灰石(hydroxyapatite,HA)涂层[26]、壳聚糖涂层[27]、TiO2纳米管阵列涂层,其中TiO2纳米管阵列由于是原位自生长的多孔结构涂层,往往能与其它涂层进行复合,达到更好的功能性[28,29]。
3.1 羟基磷灰石涂层
HA作为人体骨骼主要的无机成分,具有良好的生物相容性,能够起到骨传导与骨诱导的作用[30]。HA与体液接触时,表面离子可以与水溶液中的离子发生交换作用,胶原蛋白和蛋白质等分子或离子可以吸附在它们的表面上,以产生生物膜和涂层[31]。纯HA的机械性能差,不太适用于承重环境中,但通过在其他植入物表面制备HA涂层进行复合可以解决这个问题。HA涂层不仅可以使骨骼/植入物界面处实现紧密的化学键结合,而且还可以充当体液与金属植入物之间的屏障[32]。
HA涂层的改性效果与其制备方法和制备工艺密切相关,不同方法制备的HA涂层与基体的结合强度、结晶度、致密度等均存在差异。HA涂层与基体的结合强度是决定改性效果的关键因素之一,低的结合强度易导致改性失效,HA涂层的剥落可能会造成发炎等问题[33]。相关研究表明,磁控溅射法制备的HA涂层粘附强度可达80 MPa,高于热等静压、脉冲激光沉积、等离子喷涂和溶胶-凝胶法制备涂层的结合强度(分别约为14,16,25和26 MPa[34])。目前,制备HA涂层采用较多的方法为等离子喷涂法和电泳沉积法,电泳沉积法能涂覆形状较为复杂的基体,但其结合强度较低[35]。对热喷涂法制备的HA涂层进行退火处理后,涂层的结合强度明显提升,这是由于热处理减少了残余应力[36]。此外,通过各种预处理技术,如电子束刻蚀、微球喷砂、酸蚀刻和砂纸研磨等方法使钛合金表面粗糙化,或者在HA涂层与钛合金基体之间沉积过渡层,均可以提高HA涂层的粘附强度。
HA涂层自身特性,如微观结构、HA晶粒尺寸、与基体结合强度等对植入材料的生物相容性都有一定影响。HA涂层结晶度差异会对细胞行为产生影响,与高度结晶HA涂层相比,低结晶HA涂层表现出较低的成骨细胞增殖速率。研究发现,不同结晶度的HA纳米涂层和微米涂层显示出不同的溶解和再沉淀特性[37],无定型HA在体内表现出高的溶解度,据推测早期骨骼形成动力学与HA涂层的溶解度有关[38]。通过退火或在高温(700~800 ℃)下沉积可以实现对HA涂层晶化程度的控制,退火过程将部分非晶涂层转变为结晶涂层,获得具有一定结晶度的结晶结构或离子取代的HA涂层。与片状HA涂层相比,针状结构涂层致密均匀,并且针状结构涂层提供了更多与周围液体的接触区域,因此更适合磷灰石的沉积[39]。HA涂层微观结构还可以通过加温烧结改变[40],Dikici等[41]发现在高于1050 ℃烧结时HA分解为磷酸三钙(tricalcium phosphate,TCP),1400 ℃烧结时HA完全分解;涂层的孔隙率随着烧结温度的上升而升高。Hulbert等[42]研究表明,多孔结构要使新的骨组织向内生长并为体液循环提供空间需要具有约100 μm的最小互连孔径,他们发现较小的孔径允许渗透组织的不完全矿化。对于HA涂层而言,完全致密的HA涂层并不利于细胞增殖分化,其诱导骨形成能力有限,主要用作骨形成支架[43]。与微米尺寸的HA相比,纳米尺寸的HA具有超细的结构和较高的表面活性。纳米HA类似于人类硬组织骨骼纹理中发现的矿物质,并具有相似的化学和晶体学结构,与微米HA相比,纳米HA更能改善细胞增殖和分化[44]。
3.2 掺杂羟基磷灰石涂层
人工合成HA的Ca和P化学计量数比为1.67,但生物磷灰石本质上是非化学计量的,它由小晶体组成,其特征在于结晶度差,并且相对于化学计量的HA具有相对高的溶解度[45]。为提高涂层抗菌、诱导分化等能力,基于生物HA结构,对人工合成的HA进行离子掺杂是表面改性的重要研究方向。将Mg2+,Zn2+,Sr2+,Ag+,Zr4+和F-等具有生物功能的离子作为掺杂剂,不仅能够改变沉积HA的Ca和P化学计量数比、调整晶体结构、提升涂层稳定性等,还可以吸附在晶体表面改善润湿性,达到提高植入物生物活性的效果[46]。
HA涂层的掺杂可分为单元素掺杂和多元素掺杂。在单元素掺杂中,Sr元素掺杂被广泛研究,Sr可以作为药物治疗骨质疏松症,随着Sr的增加,破骨细胞增殖减小[47,48],此外,Sr还能够提高HA的力学性能。Boyd等[49]通过磁控溅射法将Sr-HA涂层沉积在硅表面上,随着Sr掺杂量从5%增加到13%(质量分数),涂层表面粗糙度逐渐增加,提高了对细胞的附着力。F-可以通过产生较低的表面电势使细胞附着变得有利,另一方面实验表明F-的掺杂使HA的抗溶解性增加[39,50]。向HA结构中掺杂Mg2+可显著增加涂层的比表面积,Mg元素对HA的结晶具有一定抑制作用,这有利于另一种生物相容物质β型磷酸三钙(β-TCP)相的形成[51]。
多种离子共掺杂能够结合单离子掺杂的优势,多种元素的共掺杂协同作用更加明显,因此,为提升HA涂层性能,通常对其进行多种离子共掺杂。Samani等[52]利用溶胶-凝胶法制备了Zn/Ag共掺杂的HA涂层,发现1.5%Zn-0.6%Ag(质量分数)共掺杂样品在所有共掺杂样品中具有最小的菌落数,共掺杂样品表现出比2.5%Zn单掺杂HA和1.5%Ag单掺杂HA更好的抗菌结果。Qiao等[53]利用电沉积法制备了Si-Sr-Ag共掺杂HA/TiO2涂层,掺杂的Sr和Si离子增强了与成骨相关基因的表达水平,并成功抵消了Ag离子潜在的细胞毒性。共掺杂涂层的生物学特性优于HA和Ag-HA涂层,其抗菌功效与Ag-HA涂层相当,特定高含量的Si和Sr离子能够促进细胞和骨组织的良好增殖和再生,提高了细胞粘附性。含Si的HA具有更高的吸收速率,并存在促进成骨细胞附着的大量活性基团。Zhang等[54]利用电化学沉积法制备SiC纳米颗粒增强的Na和F共掺杂HA涂层,Na+替代HA中的Ca2+可以促进细胞附着和骨骼代谢;HA中的OH-被F-替代可以增加结构稳定性,刺激细胞外基质形成并增强骨结合,因此,共同掺杂Na和F的HA涂层可以表现出优异的生物学特性。大量研究表明,离子掺杂HA的抗菌效果在很大程度上取决于掺杂元素的浓度以及掺杂剂本身的性质[30],多种离子共掺杂比单一离子掺杂表现出更好的抗菌和骨整合效果。
目前,采用稀土元素如La,Ce,Nd,Gd等离子掺杂相关文献较少。La3+掺杂后的HA涂层溶解度低,且涂层力学性能提高[55];为提高HA涂层的抗菌性和耐磨性,Aditi等[56]利用等离子喷涂技术在钛合金HA涂层中添加了CeO2、Ag以及碳纳米管,结果发现涂层磨损常数和剪切应力都大幅度降低,抗菌性良好。
3.3 壳聚糖涂层
除了HA一类的生物陶瓷被用作钛合金植入物表面涂层,壳聚糖作为一种天然有机化合物,因具有良好的生物相容性、抗菌性[57,58]以及对细胞增殖分化的促进作用,也常常被用作钛合金植入物表面改性涂层[59]。壳聚糖还具有较好的吸附性能,可在体内生物降解,无毒害作用,且能够与HA等其他物质复合作为药物载体。通过控制壳聚糖涂层的厚度可以来调控药物的局部浓度,以便治疗术后感染、炎症而使植入物达到更好的骨整合[60]。壳聚糖能与带负电荷的细菌细胞相互作用,从而达到抗菌作用,减少植入失败的风险。虽然其相比一些金属离子抗菌性稍低,但对人体更加安全。
壳聚糖的抗菌机理主要是利用其官能团(氨基)和正电特性与细菌膜发生反应,抑制细菌生长,不同分子量的壳聚糖的抗菌性不尽相同,低分子量壳聚糖的亲水性比高分子量壳聚糖高[61]。郑连英等[62]发现当壳聚糖分子量在300 000以下时,其对大肠杆菌和金黄色葡萄球菌的抗菌作用随分子量变化相反,分子量越小,对大肠杆菌抗菌作用越明显,对金黄色葡萄球菌作用随之减弱。Kiroshka等[63]研究了壳聚糖-几丁质纳米涂层对大鼠骨细胞的影响,发现涂层孔隙率和孔径分布都与壳聚糖的分子量有关,并且分子量还影响细胞生长增殖的骨架结构;在其研究中,重均分子量(MW)为160 000的壳聚糖涂层孔隙率高、溶胀率低,细胞扩散较好。
壳聚糖涂层中存在大量的—OH,且带正电,能够加速PO43-的沉积,因此能够诱导体内HA形成,枝接壳聚糖涂层后的基体亲水性提高,在SBF中经过仿生沉积能够形成完整的HA涂层,与未枝接试样(钛试样)的沉积量有明显差异[64]。
由于壳聚糖难以与植入物形成化学结合,为提高其在钛合金表面的粘合强度,研究者们开展了进一步探究。Egemen等[64]在经过喷砂处理后的Ti-6Al-4V上电泳沉积了壳聚糖,研究发现,喷砂后的基体形貌影响壳聚糖涂层的粗糙度;且随着电压的上升,沉积量增加。Jugowiec等[66]向壳聚糖胶体中加入HA纳米粉和纳米颗粒,再将其在Ti-13Nb-13Zr合金表面电泳沉积,研究发现纳米颗粒的加入使得沉积的壳聚糖厚度更厚,与钛基材料的结合强度更优,且提高了材料的耐腐蚀性能和生物相容性。Zhang等[67]利用碱处理钛表面后,再将其依次在肝素钠和羧甲基壳聚糖溶液中浸泡,由于碱处理后的钛表面存在大量—OH,其粗糙表面能与壳聚糖紧密结合,试样亲水性优异,水接触角仅为8°。
壳聚糖涂层虽然具有好的生物相容性,但其力学性能相对较差,填补壳聚糖力学性能上的不足是其发展的关键。
3.4 钛合金表面原位生长TiO2纳米管阵列涂层
TiO2纳米管结构可阻止金属离子(如Al,V等)的释放,缓解植入反应,表现出比TiO2块体材料更好的耐腐蚀性能以及生物相容性。因此,在钛合金表面合成TiO2纳米管阵列涂层成为改善其医用性能的另一有效措施。
阳极氧化法[68]常被用于在钛基材料表面制备TiO2纳米管阵列,从而形成具有近似骨骼多孔结构的TiO2涂层,通过改变阳极氧化电压和时长能够对TiO2纳米管阵列的管长及管径进行调控。采用阳极氧化法制备的TiO2纳米管阵列为不定型态,经过退火,阵列可由不定型态转变为锐钛矿相或金红石相,在300~500 ℃退火后一般呈锐钛矿相[69],600 ℃退火后逐渐转变为金红石相。表面结晶度的增加降低了退火样品的水接触角,这让纳米管阵列表现出高的表面润湿性,使得蛋白质吸附以及细胞粘附更加容易[70],纳米管和晶体结构的协同作用加速了HA的沉积[71]。有研究表明,锐钛矿相表现出的诱导细胞分化或细胞增殖性能优于金红石相,锐钛矿相上更容易沉积HA[72]。此外,Yu等[73]发现直径相对较小的TiO2纳米管更有利于成骨细胞的粘附和增殖;而直径相对较大的TiO2纳米管表现出更好的成骨分化能力,大纳米管在细胞模拟氧化应激处理后拥有更出色的成骨潜力。当阳极氧化电压在一定范围内变化时,随着电压的上升,纳米管长度、管径增加;随着氧化时长的增加,试样表面粗糙度上升,水接触角也随之变小[74]。
Ti-6Al-4V合金是应用相对较多的生物医用材料,其由α+β相组成,在阳极氧化过程中两相的溶解速度不同,纳米管管长在不同相区域存在差异。Mansoorianfar等[75]利用二次阳极氧化于50~75 V的电压条件下在Ti-6Al-4V合金上成功制备了均匀性良好的TiO2纳米管阵列,其形貌如图1所示,纳米管的平均管长和管径随着电压的增大而上升。研究发现,在60 V电压下制备的试样显示出最佳的细胞活性,图2为在各试样上培养的MG63骨髓基质细胞的二苯基四氧唑溴盐(MTT)分析。
在低弹性模量的生物钛合金上制备TiO2纳米管阵列层,既保证了对植入材料力学性能的要求,也提高了其生物相容性。Li等[76]在Ti-24Nb-4Zr-7.9Sn(Ti2448)钛合金表面制备了TiO2纳米管阵列层,纳米管-Ti2448(NTi2448)对比纯Ti、纳米管-Ti(NT)和Ti2448,表现出更高的润湿性、耐腐蚀性、细胞相容性以及骨整合能力。低弹性模量钛合金中由于加入了Nb,Zr等元素,阳极氧化后形成的氧化膜提高了其耐腐蚀性能,此外合金元素的加入使得纳米管阵列的有序性降低,管径大小存在差异,也有研究表明有序度低的阵列表现出更好的相容性。
目前,利用阳极氧化法表面改性钛基材料主要集中在纯钛和Ti-6Al-4V合金的研究上,研究者们探究了钛基植入物表面制备的TiO2纳米管阵列形貌、成分、晶体结构等与表面粗糙度、润湿性、细胞增殖分化之间的关系。而新型医用钛合金的合金元素对阳极氧化法制备纳米管阵列涂层的形貌影响所获关注并不多。
3.5 基于TiO2纳米管阵列涂层的表面改性
对于钛合金的表面改性,研究者们往往会综合多种技术手段,根据特定要求进行设计。多种改性方法的结合极大程度上对各改性手段的优点进行了整合,改性效果也在不断优化。

图1 不同电压下阳极氧化Ti-6Al-4V的表面和截面形貌[75]:(a~c)50 V,(d~f)60 V ,(g~i)75 VFig.1 Surface and cross sectional morphologies of Ti-6Al-4V after anodizing process under different voltage[75]:(a~c)50 V,(d~f)60 V,(g~i)75 V
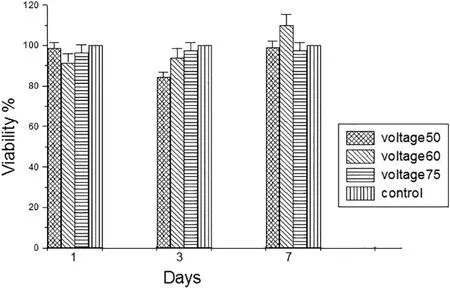
图2 Ti-6Al-4V在不同电压下阳极氧化试样与未处理试样表面培养MG63骨髓基质细胞的二苯基四氧唑溴盐(MTT)分析(细胞活力/%)[75]Fig.2 MTT analysis of MG63 nanocrystal cells on the surface of Ti-6Al-4V anodized flakes and non-anodized flakes under different voltages (cell viability/%)[75]
为提高植入物的耐磨性能,以往利用磁控溅射等方法在植入物表面制备TiN层,但基于TiO2纳米管,可以通过对TiO2纳米管持续还原氮化得到TiN纳米管阵列涂层[77],这样既保证了多孔结构满足生物相容性的要求,同时也提高了其耐磨性能。
TiO2纳米管阵列比表面积大,利用TiO2纳米管阵列作为过渡层能够增加HA涂层的粘合强度并改善HA涂层的沉积量。Lin等[78]通过真空钙化和水热处理在纳米管表面形成钛酸钙(CaTiO3),为HA提供了形核点,实现了纳米HA涂层和TiO2基体之间的化学键合。Fathyunes等[79]利用超声辅助电沉积在TiO2纳米管上制备了氧化石墨烯-HA涂层,石墨烯提高了HA涂层的力学性能,且石墨烯本身是生物相容的,之前有研究[80]表明石墨烯能够诱导干细胞分化,有刺激成骨细胞的作用。
TiO2纳米管阵列涂层在负载离子、缓释药物上也体现出独特的优势。目前,TiO2纳米管阵列涂层已经开始作为负载离子或抗菌消炎药物的多孔结构涂层[81,82],通过改变温度、pH值等条件达到药物智能释放的作用[83]。TiO2纳米管阵列负载Ag,Cu,Sr等离子可以作为生物体内持续缓慢释放的抗菌剂。陈毅等[84]利用磁控溅射法制备出TiAg薄膜后利用阳极氧化法制备出负载Ag的TiO2纳米管阵列,又采取水热法负载了SrTiO3,负载离子的试样在60 d后仍表现出良好的抗菌性及骨诱导能力。此外,TiO2纳米管常用来作为抗菌药物的容器,以便达到智能缓释药物的作用,但通过控制纳米管的长度和管径来控制药物释放的速度有一定局限性[85],因此往往在装载药物的纳米管阵列上采用生物聚合物封装,防止药物爆发释放。Zhong等[86]在负载诺氟沙星的TiO2纳米管阵列上涂覆了聚甲基丙烯酸,其表现出较小的突释量(34.4%)和较长的持续释放时间。Aw等[87]提出的采用纳米管负载载有药物的聚合物胶束以及采用壳聚糖等生物聚合物涂层包覆TiO2纳米管表面的方法,也使得TiO2纳米管的抗菌消炎等功能性提升。另一方面,有研究者通过改变纳米管管壁的粗糙度来改善载药量以及释放速度,对亲、疏水性药物都同样适用[88]。
基于当前TiO2纳米管阵列涂层的改性作用,在钛合金植入物表面制备TiO2纳米管阵列涂层在未来有望成为医用钛合金改性的基础步骤。
4 结 语
至今,研究者在新型医用钛合金设计和医用钛合金生物相容性提升方面均进行了大量尝试,新开发的医用钛合金弹性模量日益接近人体骨组织的弹性模量值,在钛合金表面构建改性涂层使得合金的生物相容性、骨整合能力、抗菌性等也得到了较大提升,但以下几方面研究仍需深入和加强:① 目前在钛合金表面制备TiO2纳米管阵列大多数仍是基于弹性模量较高的Ti-6Al-4V,对于新型β钛合金中合金元素对纳米管形貌和有序度的影响的研究有必要更加深入;② 生物相容性涂层与钛合金基体结合力的进一步提升;③ 在表面改性涂层中,离子掺杂对涂层形貌影响及对细胞分化影响研究。
