大蒜天然产物的提取及其抗茶轮斑病活性
2021-10-26饶家瑞余用秀
饶家瑞, 张 欣, 余用秀
(1.贵州省茶叶研究所, 贵州 贵阳 550006; 2.贵州省生物技术研究所, 贵州 贵阳 550006)
瑞士科学家PAUL于1938年发现合成化合物双对氯苯基三氯乙烷(DDT)具有杀虫活性后,使得农药进入了有机合成时代[1]。有机农药具有活性高、见效快等特点,但自然降解慢、毒副作用较大和生态破坏力较强[2]。随着人们对粮食安全生产问题的日益重视,研究对动植物及环境友好、安全的生物农药成为解决上述问题的重要途径之一[3]。植物产生的次生代谢产物超过40万种[4],是筛选抗菌活性化合物的天然宝库。植物源农药作为生物农药的重要组成部分,因其可降解、无残留和绿色安全的特点而受到重视。植物源农药可通过微波法[5]、牛津杯法[6]、超声波提取法[7]等提取植物有效成分,用于田间有关病害的绿色防治。研究表明,大蒜提取物对病原菌有一定的抑制作用,如大蒜素对伽师瓜贮藏过程中常致腐烂的毛霉菌、镰饱菌、链格孢菌和青霉菌4种病原菌的最小抑菌浓度分别为2.3 g/L、1.7 g/L、2.2 g/L和2.6 g/L[8];大蒜素对耐甲氧西林金黄色葡萄球菌的平均半抑制浓度为(0.30±0.09)mg/mL[9];大蒜素对真菌黑曲霉和绳状青霉的最低抑制生长浓度均为0.063%,对细菌大肠杆菌和金黄色葡萄球菌最低抑制生长浓度均为0.125%[10]。
茶轮斑病(Pestalotiopsistrachicarpicola)是一种广泛分布于世界各地茶园的茶树茶叶病害,为茶轮斑病的绿色高效防控提供参考,以威宁紫皮大蒜为材料,二氯甲烷、乙酸乙酯、甲醇和乙醇为溶剂,利用浸提法[11]提取威宁紫皮大蒜的天然产物,研究不同溶剂提取物对茶轮斑病病原菌的抑菌活性,现将研究结果报道如下。
1 材料与方法
1.1 试验材料
1.1.1 茶轮斑病病原菌 该病菌由张欣等[12]2020年7月采集于铜仁市石阡县茶园,经单孢分离、形态学鉴定和DNA测序等手段鉴定,病原菌为茶轮斑病(Pestalotiopsistrachicarpicola),由贵州省生物技术研究所提供。
1.1.2 药剂 二氯甲烷、乙酸乙酯、甲醇、乙醇,购于天津市富宇精细化工有限公司;吐温80,购于天津市大茂化学试剂厂;土豆培养基(PDA),购于广东环凯微生物科技有限公司;其他试剂,购于上海安耐吉化学试剂有限公司。
1.1.3 仪器 超净工作台(苏净集团安泰公司),电热鼓风干燥箱(上海一恒科技有限公司),电子天平(型号:BSA224S-CW),恒温培养箱(上海跃进医疗器械厂),高温蒸汽灭菌锅(上海沉汇仪器有限公司),BHC-1300II A/B3生物洁净安全柜,研钵80 mm(河北鼎盛隆华实验仪器有限公司),旋转蒸发仪(德国IKA),Mill-Q型超纯水制备仪,20~200 μL、100~1 000 μL和1~5 mL移液枪等。
1.2 试验方法
1.2.1 大蒜天然产物的提取 将威宁紫皮大蒜(购买于市场)去皮,在电子天平上分别称量4组,每组30 g。将称量好的大蒜切碎后分别放入4个研钵中反复研磨,参照浸提法[11],遵循溶剂与天然产物的相似相容性,将溶剂二氯甲烷、乙酸乙酯、甲醇、乙醇各30 mL分别加入4个研磨大蒜的研钵中,搅拌3 min后静置10 min。用滤纸过滤提取液,将过滤液分别装入100 mL圆底烧瓶中旋转蒸馏去掉溶剂,得到提取天然产物。
1.2.2 提取天然产物的抑菌活性试验
1) 培养基配制。按照购买的土豆培养基(PDA)配方,在2.5 L超纯水中加入PDA 100 g和琼脂32 g,搅拌均匀,然后在搅拌状态下以每瓶45 mL倒入100 mL锥形瓶中并封口,121℃高压灭菌 20 min,冷却后备用。
2) 药液配制。按1 mg天然产物加入20 μL二甲基亚砜的比例溶解后备用。称量提取天然产物配置成溶液,即处理1(二氯甲烷提取大蒜天然产物)、处理2(乙酸乙酯提取大蒜天然产物)、处理3(甲醇提取天大蒜然产物)、处理4(乙醇提取大蒜天然产物),另设阳性对照组处理5(CK1,药物为春雷霉素)、空白对照组处理6(CK2,等量灭菌吐温水)。在200 mL灭菌水中加入200 μL吐温80,搅拌均匀,然后依次在10 mL离心管中加入0.8 mL吐温水、200 μL对应天然产物配置液和4 mL吐温水。将配置好的5 mL药液倒入PDA培养基中混匀(使50 mL含药液的培养基终浓度为200 μg/mL),再平均倒入3个培养皿中冷却备用。
3) 接种真菌。提前打开超净工作台紫外灯杀菌30 min以上,将提前活化好的茶轮斑病病原菌饼置于工作台,用打孔器在其边缘打孔,制成直径为 4.0 mm的菌饼,再用无菌接种针将菌饼分别移动到含有药液的培养基中央,每组重复3次。最后将接种的培养皿置于25℃、80%湿度的恒温培养箱中培养5 d。待空白对照组菌丝长至6.0 cm左右时,采用十字交叉法测量生长菌丝的菌饼直径,并计算抑制率(I)。
I= [(C-T)/(C-0.4)]×100%
式中,C为空白对照菌饼直径,T为药物处理菌饼直径。
1.2.3 提取天然产物抗茶轮斑病的毒力测定 根据提取天然产物在200 μg/mL浓度下的初筛抑制率,选择处理1和处理2的浓度梯度为200 μg/mL、100 μg/mL、50 μg/mL、25 μg/mL和12.5 μg/mL,处理3和处理4的浓度梯度为1 600 μg/mL、800 μg/mL、400 μg/mL、200 μg/mL和100 μg/mL进行4组天然产物的EC50测定。另设阳性对照组处理5(CK1,药物为春雷霉素)、空白对照组处理6(CK2,等量灭菌吐温水)。利用菌丝生长速率法测定抑菌活性,采用十字交叉法测量生长菌丝的菌饼直径,抑制率计算方法同上,浓度取对数与抑制率做线性回归方程,从而计算得出EC50。
1.3 统计分析
数据采用Excel 2010和DPS软件进行统计分析。
2 结果与分析
2.1 大蒜提取天然产物的产率
从表1看出,不同溶剂提取大蒜天然产物的产率为甲醇>乙醇>乙酸乙酯>二氯甲烷,其产率分别为3.19%、1.61%、0.15%和0.22%。说明,甲醇、乙醇提取到的大蒜天然产物比乙酸乙酯和二氯甲烷提取的高且天然产物以亲水性为主。
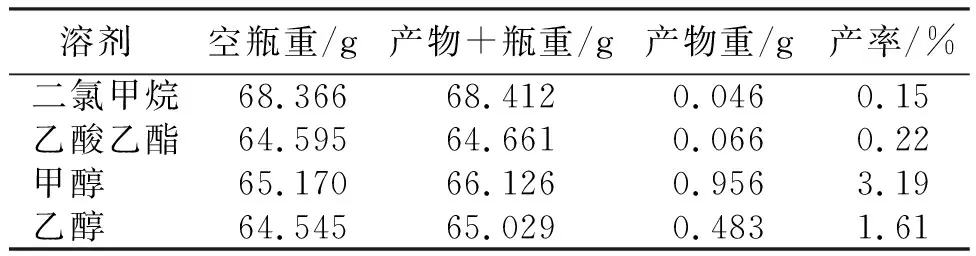
表1 4种溶剂提取大蒜天然产物的产率
2.2 不同处理茶轮斑病病原菌的抑制率
从表2看出,4种溶剂提取大蒜天然产物200 μg/mL对茶轮斑病病原菌的抑制率以处理1最高,为95.10%,较CK1高64.55百分点;处理2其次,为91.64%,较CK1高61.09百分点;且处理1和处理2均极显著高于CK1。处理3、处理4的抑制率分别为8.36%和15.27%,比CK1低22.19百分点和15.28百分点,且均极显著低于CK1。说明,大蒜中以脂溶性为主的天然产物对茶轮斑病病原菌的抑菌活性优于水溶性为主的天然产物。
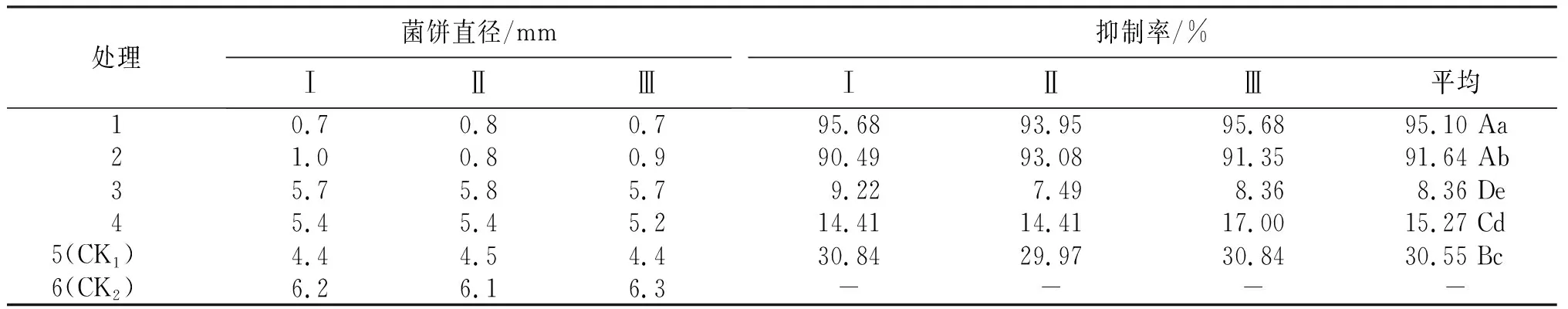
表2 不同处理茶轮斑病病原菌的抑制率
2.3 不同处理浓度对茶轮斑病的毒力强度与EC50
从表3可知,对应菌落的生长直径随提取大蒜天然产物浓度下降而增大,抑制率均随提取大蒜天然产物浓度的下降而降低,各浓度间差异均达极显著。说明,抑制率与其对应提取大蒜天然产物的浓度均呈较好的线性关系,测定EC50的可信度高。二氯甲烷提取大蒜天然产物(处理1)12.5~200 μg/mL对茶轮班病的抑制率为24.78%~93.95%,比对照药剂春雷霉素(CK1)800~50 μg/mL浓度的高27.67~11.24百分点;乙酸乙酯提取大蒜天然产物(处理2)的抑制率略低于处理1。乙醇提取大蒜天然产物(处理4)100~1 600 μg/mL对茶轮斑病病原菌的抑制率优于甲醇提取大蒜天然产物(处理3),处理3的抑制率低于CK1,处理4的抑制率略高于CK1。
2.4 不同处理对茶轮斑病的毒力强度
从表4可知,4种溶剂提取大蒜天然产物对茶轮斑病病原菌的毒力方程的相关系数(R2)均大于0.95,表明4种溶剂提取大蒜天然产物、对照药剂春雷霉素的浓度与抑制率间均存在良好的线性关系。处理1和处理2的EC50分别为31.58 μg/mL和47.59 μg/mL,分别比春雷霉素(382.08 μg/mL)减少用药量350.50 μg/mL和334.49 μg/mL;处理3和处理4的EC50分别为919.33 μg/mL和658.50 μg/mL,分别比春雷霉素增加用药量537.25 μg/mL和276.42 μg/mL。说明,二氯甲烷和乙酸乙酯溶剂提取大蒜天然产物抗茶轮斑病的效果均优于对照药剂春雷霉素,并以二氯甲烷提取的毒力强度最大。
3 结论
1) 用二氯甲烷、乙酸乙酯、甲醇和乙醇溶剂浸提威宁紫皮大蒜天然产物的产率分别为0.15%、0.22%、3.19%和1.61%,即不同溶剂提取的大蒜天然产物产率为甲醇>乙醇>乙酸乙酯>二氯甲烷。
2) 抑菌活性试验结果表明,4种溶剂提取大蒜天然产物200 μg/mL对茶轮斑病病原菌的抑制率为二氯甲烷>乙酸乙酯>乙醇>甲醇,并以二氯甲烷和乙酸乙酯溶剂提取大蒜天然产物的抑制率较高,分别为95.10%和91.64%,比对照药剂春雷霉素(30.55%)分别高64.55百分点和61.09百分点。在试验浓度下4种溶剂提取大蒜天然产物对茶轮斑病病原菌的抑制率均随浓度下降而降低,且各浓度间差异均达极显著。
3) 毒力强度试验结果表明,二氯甲烷和乙酸乙酯溶剂提取大蒜天然产物的EC50分别为31.58 μg/mL和47.59 μg/mL,分别比春雷霉素(382.08 μg/mL)减少用药量350.50 μg/mL和334.49 μg/mL,即2种溶剂提取大蒜天然产物抗茶轮斑病效果均优于对照药剂春雷霉素,并以二氯甲烷溶剂提取大蒜天然产物的毒力强度最大。
