关注外界条件对氧化性强弱的影响
2021-10-25马洁
马洁
摘 要:通过具体实例认识到物质氧化性、还原性的强弱受外界条件影响,并非一成不变。分析高考典型试题,试从高考题的功能价值引导平时的学习实践,概念学习要注重真实情境、发展学科思维、形成学科观念。
关键词:氧化还原反应;影响因素
一、问题的提出
事实1:制“消毒液”的原理是将氯气通入烧碱溶液,反应如下:
Cl2+2OH-=Cl-+ClO-+H2O
事实2:“消毒液”与“洁厕灵”不能混用,否则产生有毒的氯气,反应如下:
Cl-+ClO-+2H+=Cl2↑+H2O
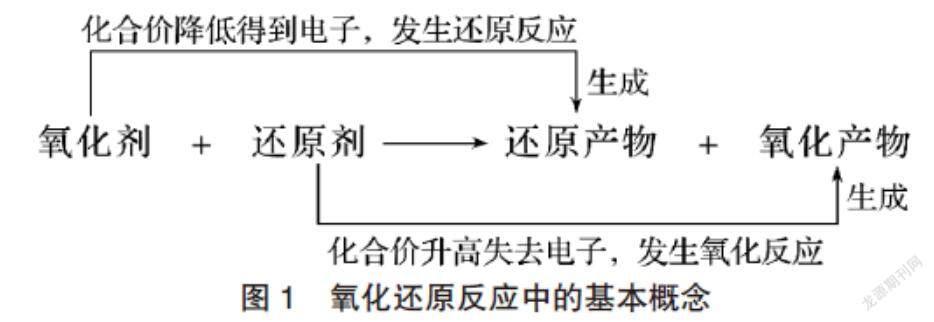
氧化还原反应是高中化学课程中的核心概念,高三学生通过对氧化还原本质的不断深入认识,已经能够清晰氧化还原反应中的各组概念(图1),并建立起氧化还原反应的认识模型。然而,面对上述两个反应事实,他们仍然十分困惑,根据氧化还原反应中的强弱规律,即氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。事实1中,氧化性:Cl2>ClO-;事实2中,氧化性:ClO->Cl2。
为何在以上两个反应中,Cl2与ClO-的氧化性强弱出现了反转?可见,物质氧化性、还原性的强弱受外界条件影响,并非一成不变。那么影响氧化还原反应发生的因素有哪些,高考题中又是如何考查的?
二、影响氧化性还原产物的因素
(一)溶液酸碱性
对比上述两个反应条件,不难发现溶液酸碱性不同。酸性环境中,Cl2的氧化性大于ClO-,而碱性环境中,ClO-的氧化性大于Cl2。又如:KMnO4是一种常见的氧化剂,它在酸性、中性及碱性溶液中表现出强弱不同的氧化性,还原产物也因此各不相同。酸性环境中,MnO4-是很强的氧化剂,可以氧化Fe2+、Cl-、I-、SO等离子,还原产物为Mn2+。
2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O
在中性、弱碱性溶液中,MnO氧化能力下降,反应时被还原为MnO2。
2MnO4-+3SO32-+H2O=2MnO2↓+3SO42-+2OH-
在弱碱性溶液中,MnO被还原为MnO42-。
2MnO4-+SO32-+2OH-=2MnO42-+SO42-+2H2O
例1(2012江苏卷第16题节选)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为 。
(2012江苏卷第18题节选)H2O2与KMnO4反应的离子方程式如下:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。若不加稀硫酸酸化,MnO4-被還原为MnO2,其离子方程式为 。
分析:以上两空均是信息给予型方程式书写,前者题给信息是酸性溶液中,NO2-发生歧化,不稳定。根据还原产物是NO,可推知氧化产物应为NO3-,可得:3NO2-+2H+=NO3-+2NO↑+H2O。后者已知MnO4-被还原为MnO2,且题中示范了H2O2的氧化产物为O2,可得:2MnO4-+3H2O2=2MnO2↓+3O2↑+2OH-+2H2O。
例2(2010 江苏卷第 18 题节选):正极材料为LiCoO2的锂离子电池被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而值得。共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合的原因是 。
分析:本题考查Fe2+在不同介质中还原性的强弱。有实验事实为证:在空气中,向含有Fe2+的溶液中滴加NaOH溶液,生成白色絮状沉淀,迅速变为灰褐色,最终变为红褐色。这一实验现象说明Fe2+在碱性环境中还原性更强。此处可回答Fe2+在碱性条件下更易被氧化。
上述例1中的两个方程式书写难度均不大,它们基于真实情境,取材源于教材、但又不同于教材,这个不同就是由于溶液酸碱性不同。而例2大多数同学都很困惑,认为题给信息太少,难以作答。实际上,大部分教师在讲Fe2+的性质时,只讲到Fe2+易被氧化,不会细究Fe2+在不同酸碱性条件下还原性的差异。当我们审视高考题的功能价值,会认识到高考题指导教师在平时教学时不仅不能把知识“教死了”,还要带领学生的建立起“变化观”,这是化学的主要学科思想。
(二)反应物浓度
氧化还原反应中,有一些反应的产物相当程度的与反应物浓度有关,如硝酸参与的反应。由于硝酸浓度的不同,引起了还原产物的不同,硝酸常被还原为NO2、NO、N2O、NH3等。当然,硝酸的还原产物,除与硝酸的浓度有关,还与还原剂的能力、中间产物(HNO2、NO2)的催化作用有关。
例 3(2019 江苏卷第 16 题节选):N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
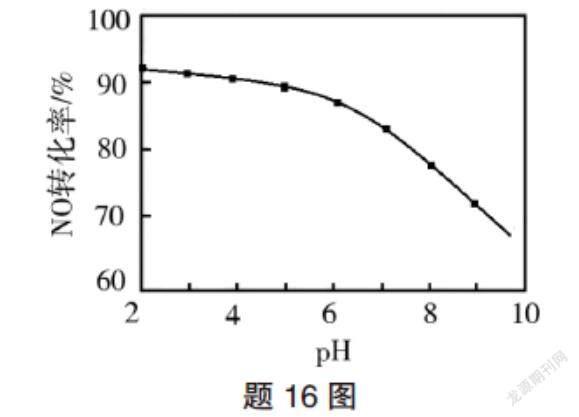
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO,其离子方程式为 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是 。
分析:该小题讨论NaClO溶液通过氧化吸收尾气NO的问题,考查学生对陌生情境下氧化还原反应的分析及应用能力。根据题给信息,在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO,根据原子守恒、电荷守恒、得失电子守恒,配平离子方程式为3HClO+2NO+H2O=3Cl-+2NO+5H+。
第二问结合题给信息“NaClO溶液的初始pH越小,NO转化率越高”,首先分析出该题所指NO转化率并非平衡转化率,若为平衡转化率,pH越小,H+浓度越大,平衡应逆向移动,NO转化率越低。接着就从影响反应速率因素的角度分析,NaClO溶液pH越小,HClO越大,氧化NO能力越强,反应速率越快。
解答此题不仅要求学生能正确选择从影响反应速率因素的角度回答,而且认识物质的性质要具备一定的变化观念。
(三)反应温度
同一氧化还原反应,产物也会因反应的环境温度高低而不同。如卤素单质中的Cl2和Br2与强碱反应,低温或常温下主要生成卤化物和次卤酸盐,而温度较高时则生成卤化物和卤酸盐。即:
Cl2+2OH-=Cl-+ClO-+H2O
3Cl2+6OH-5Cl-+ClO+3H2O
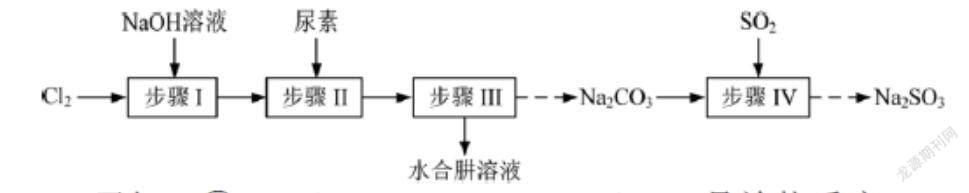
例 4(2018 江苏卷第 19 题节选):以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为 。实验中控制温度除用冰水浴外,还需采取的措施是 。
分析:该小题考查对实验原理的理解、实验条件的控制。题中给出了“若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl”的信息,注意反应条件为“△”,可写出该反应的离子方程式:3Cl2+6OH-5Cl-+ClO+3H2O。
回答该小题后一空考查如何控制反应温度的操作。首先要明确实验目的是制备NaClO溶液,为减少杂质NaClO3的生成,就得控制实验温度不超过40℃,可从两方面考虑:一是给反应体系降温,二是减缓反应放热的速率。因此,具有可操作性的控制温度的措施除了除用冰水浴给反应体系降温外,还可以通过缓慢通入Cl2降低反应速率,以减少反应的热量,从而达到减少副产品NaClO3生成的目的。
学生回答第二空有困难的原因可能是依据关键信息分析解决问题能力薄弱,或控制气体参加反应的实验条件的方法类知识缺失,但说到底,还是尚未形成“化学反应是有条件的”的观念。
三、解题感悟
以上试题列举了三种常见的影响“氧化还原反应”的因素是溶液酸碱性、浓度、温度。另外:催化剂的影响、反应物的用量均可能造成影响。“氧化还原反应”的学习贯穿于整个中学化学,具有阶段性、层次性和渐进性的特点,能力的培养、观念的形成不是一蹴而就的。但不管在哪个学习阶段,都要积极主动地参与探究活动,深刻理解核心概念和原理,不断提高頭脑中知识的系统性和概括性水平,逐步领悟并形成化学学科的主要思想。只要真正理解了化学的学科思想,在高三的复习过程中立足知识基础、增强答题体验、加强模块融合,定能从容应答各类试题。
参考文献
[1]江苏省教育考试院.2019年高考(江苏卷)试题分析[M].南京:江苏人民出版社,2019:175.
[2]江苏省教育考试院.2018年高考(江苏卷)试题分析[M].南京:江苏凤凰教育出版社,2018:166.
[3]王磊,胡久华.高中化学新课程必修课教与学化学[M].北京:北京大学出版社,2006:75.
