复方盐酸利多卡因凝胶剂中盐酸利多卡因和恩诺沙星含量的测定方法
2021-10-25金礼琴吴秋萍宋子域乔秋萍黄学林马保臣
金礼琴,金 星,吴秋萍,宋子域,乔秋萍,黄学林,马保臣,2
(1.江苏中牧倍康药业有限公司,江苏 泰州 225300;2.中国牧工商集团有限公司,北京 丰台 100070)
盐酸利多卡因(Lidocaine hydrochloride,LID)是一种常用的酰胺类中效局部麻醉药[1],具有起效较快、黏膜穿透力较强及安全范围较大等特点[2],临床上主要用于浸润麻醉、表面局麻、神经阻断、脉管给药、硬膜外麻醉及快速型抗室性心律失常[3-4],利多卡因成瘾性较低,也少有过敏反应的报道[5]。恩诺沙星(Enrofloxacin,EF)是一种广谱、高效、低毒的喹诺酮类抗菌药[6-7],由于其直接作用于细菌的核,抑制细菌的DNA旋转酶,能迅速杀死细菌而被广泛运用于各种动物感染性疾病的预防和治疗[8-9]。
目前市场上以盐酸利多卡因注射液居多[10],少部分厂家生产盐酸利多卡因胶浆剂,本试验中的复方利多卡因凝胶剂是以盐酸利多卡因和恩诺沙星为活性成分组成的复方制剂,填补了宠物临床可用的利多卡因表面麻醉剂的剂型空白,在局部麻醉的基础上增加了抗菌特性,两者联用能各自发挥原来的功效。为建立复方盐酸利多卡因凝胶剂的质量标准,本试验探讨高效液相色谱(High performance liquid chromatography,HPLC)法分别测定复方盐酸利多卡因凝胶剂中盐酸利多卡因和恩诺沙星含量的方法,为该制剂质量的控制提供理论依据。
1 材料与方法
1.1 主要试剂 盐酸利多卡因对照品(含量93.4%)、恩诺沙星对照品(含量99.5%),均购自中国兽医药品监察所;乙腈(色谱纯),购自美国DIKMA公司;磷酸二氢钾、磷酸氢二钾、磷酸、三乙胺,均购自国药集团生化试剂有限公司;复方盐酸利多卡因凝胶剂由江苏中牧倍康药业有限公司研制。
1.2 主要仪器 LC-10Avp高效液相色谱仪、LC-10ATvp双泵、SPD-10Avp可见-紫外检测器、CTO-10ASvp柱温箱,日本岛津公司;N-2000色谱工作站,浙江智达公司;AS1201全自动进样器,大连依利特公司;BS224S电子天平、BP211D电子天平,北京赛多利斯公司;TGL-16M台式高速冷冻离心机,湘仪离心机仪器有限公司;FSH-2A高速匀浆机,金坛市医疗仪器厂。
1.3 试验方法
1.3.1 复方盐酸利多卡因凝胶中利多卡因的含量测定
1.3.1.1 溶液的配制 盐酸利多卡因标准品溶液的制备:精密称取盐酸利多卡因标准品25 mg,置50 mL量瓶中,用流动相定容,混匀,即制成0.5 mg/mL的标准品溶液。盐酸利多卡因供试品溶液的制备:取本品适量(约相当于盐酸利多卡因25 mg),精密称定,置50 mL量瓶中,加流动相约30 mL,振摇溶解,超声处理20 min,冷却至室温,加流动相定容至刻度,离心(10 000 r/min,10 min,20 ℃),取上清液滤过,取续滤液,即得。阴性对照液的制备:按处方比例精密称取复方盐酸利多卡因凝胶剂中除盐酸利多卡因原料药外的其他成份,按复方盐酸利多卡因凝胶剂工艺制备,再按“盐酸利多卡因供试品溶液的制备”项下方法制备,即得阴性对照液。
1.3.1.2 系统适用性考察 以十八烷基硅烷键合硅胶为填充剂;以磷酸盐缓冲液(取1 mol/L磷酸二氢钠溶液1.3 mL与0.5 mol/L磷酸氢二钠溶液32.5 mL,用水稀释至1 000 mL,摇匀)-乙腈(50∶50)(用磷酸调节至pH 8.0)为流动相;检测波长为254 nm;流速1.0 mL/min;柱温35.0 ℃;检测浓度0.5 mg/mL;进样量20 μL;理论板数按利多卡因峰计算不低于2 000[11]。分别取对照品溶液、阴性对照溶液、供试品溶液各20 μL,进样测定。
1.3.1.3 线性范围 精密称取盐酸利多卡因对照品53.80 mg,置25 mL量瓶中,加流动相溶解并稀释至刻度,摇匀。精密吸取上述溶液0.5、1.0、2.0、3.0 mL 和5.0 mL,分别置10 mL量瓶中,加流动相稀释至刻度,摇匀,制成不同浓度的对照品溶液。精密吸取上述不同浓度的对照品溶液20 μL,分别进样测定峰面积。
1.3.1.4 精密度试验 按“盐酸利多卡因标准品溶液的制备”项下的方法制备盐酸利多卡因对照品溶液1份,精密吸取20 μL,连续进样检测6次,记录色谱图。
1.3.1.5 重复性试验 精密称取同一批号的样品6份,按“盐酸利多卡因供试品溶液的制备”项下的方法制备供试品溶液,精密吸取20 μL,进样检测,记录色谱图。
1.3.1.6 加样回收率试验 用盐酸利多卡因对照品替代盐酸利多卡因原料药,分别制备3份盐酸利多卡因含量为处方比例的80%、100%、120%的低、中、高3种浓度加样回收样品,然后每份样品制备成均为0.5 mg/mL浓度的供试品溶液,每种浓度平行配制3份,按“盐酸利多卡因供试品溶液的制备”项下的方法处理,精密吸取20 μL,进样检测,记录色谱图。
1.3.1.7 稳定性试验 精密吸取同一供试品溶液20 μL,按上述色谱条件,分别于0、2、4、6、8、10、12 h和24 h各进样1次,记录色谱图。
1.3.1.8 定量限 按信噪比10∶1为标准,精密称取盐酸利多卡因对照品适量,加流动相稀释制成相应浓度,进样检测,记录色谱图。
1.3.1.9 样品测定 取3批复方盐酸利多卡因凝胶剂样品制成供试品溶液,分别精密量取20 μL,进样检测,记录色谱图。
1.3.2 复方利多卡因凝胶中恩诺沙星的含量测定
1.3.2.1 溶液的配制 恩诺沙星对照品溶液的制备:精密称取恩诺沙星对照品25 mg,置100 mL量瓶中,用流动相定容,混匀,作为恩诺沙星对照品储备液。精密量取恩诺沙星对照品储备液5 mL置50 mL量瓶中,用流动相定容,混匀,即制成25 μg/mL的标准品溶液。恩诺沙星供试品溶液的制备:取本品适量(约相当于恩诺沙星25 mg),精密称定,置100 mL烧杯中,加入少量流动相,超声振摇至分散均匀后,转移至100 mL量瓶中,加流动相定容至刻度,混匀,精密量取5 mL置50 mL量瓶中,用流动相定容,混匀,即得。阴性对照液的制备:按处方比例精密称取复方盐酸利多卡因凝胶剂中除恩诺沙星原料药外的其他成份,按复方盐酸利多卡因凝胶剂工艺制备,再按“恩诺沙星供试品溶液的制备”项下方法制备,即得阴性对照液。
1.3.2.2 系统适用性考察 以十八烷基硅烷键合硅胶为填充剂;以0.025 mol/L磷酸溶液(用三乙胺调节至pH 3.0)-乙腈(83∶17)为流动相;检测波长278 nm;流速1.0 mL/min;柱温35.0 ℃;检测浓度25 μg/mL;进样量20 μL;理论板数按恩诺沙星峰计算不低于2 500[11]。分别取对照品溶液、阴性对照液、供试品溶液各20 μL,进样测定。
1.3.2.3 线性范围 精密吸取“恩诺沙星对照品溶液的制备”项中恩诺沙星对照品储备液0.5、1.0、2.0、3.0 mL和5.0 mL,分别置50 mL量瓶中,加流动相稀释至刻度,摇匀,制成不同浓度的对照品溶液。精密吸取上述不同浓度的对照品溶液20 μL,分别进样测定峰面积。
1.3.2.4 精密度试验 按“恩诺沙星对照品溶液的制备”项下的方法制备恩诺沙星对照品溶液 1份,精密吸取20 μL,连续进样检测6次,记录色谱图。
1.3.2.5 重复性试验 精密称取同一批号的样品6份,按“恩诺沙星供试品溶液的制备”项下的方法制备供试品溶液,精密吸取20 μL,进样检测,记录色谱图。
1.3.2.6 加样回收率试验 用恩诺沙星对照品替代恩诺沙星原料药,分别制备3份恩诺沙星含量为处方比例的80%、100%、120%的低、中、高3种浓度加样回收样品,然后每份样品制备成均为25 μg/mL浓度的供试品溶液,每种浓度平行配制3份,同“恩诺沙星供试品溶液的制备”项下的方法处理,精密吸取20 μL,进样检测,记录色谱图。
1.3.2.7 稳定性试验 精密吸取同一供试品溶液20 μL,按上述色谱条件,分别于0、2、4、6、8、10、12 h和24 h各进样1次,记录色谱图。
1.3.2.8 定量限 按信噪比10∶1为标准,精密恩诺沙星对照品适量,加流动相稀释制成相应浓度,进样检测,记录色谱图。
1.3.2.9 样品测定 取3批复方盐酸利多卡因凝胶剂样品制成供试品溶液,分别精密量取20 μL,进样检测,记录色谱图。
2 结果
2.1 盐酸利多卡因含量测定
2.1.1 系统适用性考察 阴性对照溶液无干扰,对照品和供试品溶液出峰时间基本一致,表明本方法专属性良好。见图1。

图1 盐酸利多卡因系统适用性色谱图Fig.1 Chromatograms of system applicability of lidocaine hydrochloride
2.1.2 线性范围 以对照品浓度(x)为横坐标,峰面积(y)为纵坐标,进行回归分析,得线性回归方程:y=2×106x+36 746,R=0.999 9(n=5)。结果表明盐酸利多卡因浓度在0.100 5~1.004 9 mg/mL范围内,与峰面积呈良好线性关系,结果见图2。

图2 盐酸利多卡因线性关系Fig.2 Linear relationship of lidocaine hydrochloride
2.1.3 精密度试验 结果见表1。盐酸利多卡因的RSD为0.72%。
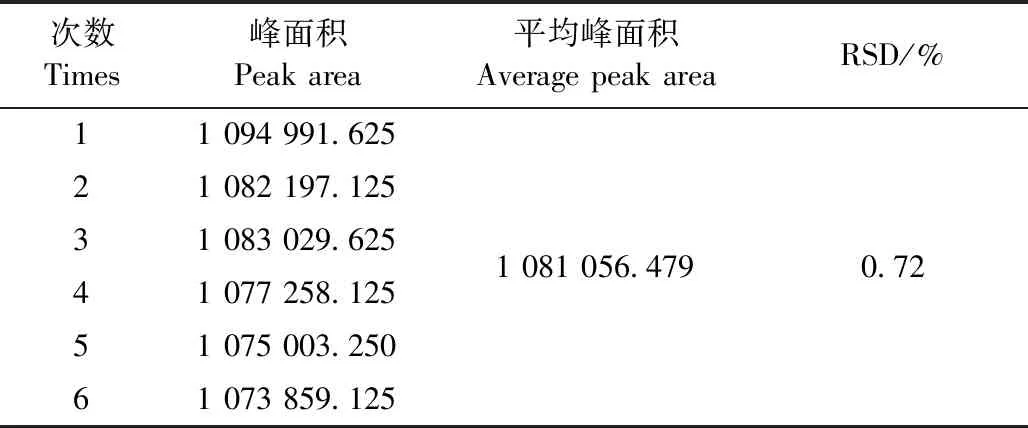
表1 盐酸利多卡因精密度试验结果Table 1 The precision test results of lidocaine hydrochloride
2.1.4 重复性试验 结果见表2。盐酸利多卡因的平均含量为标示量的101.01%,RSD为0.44%。
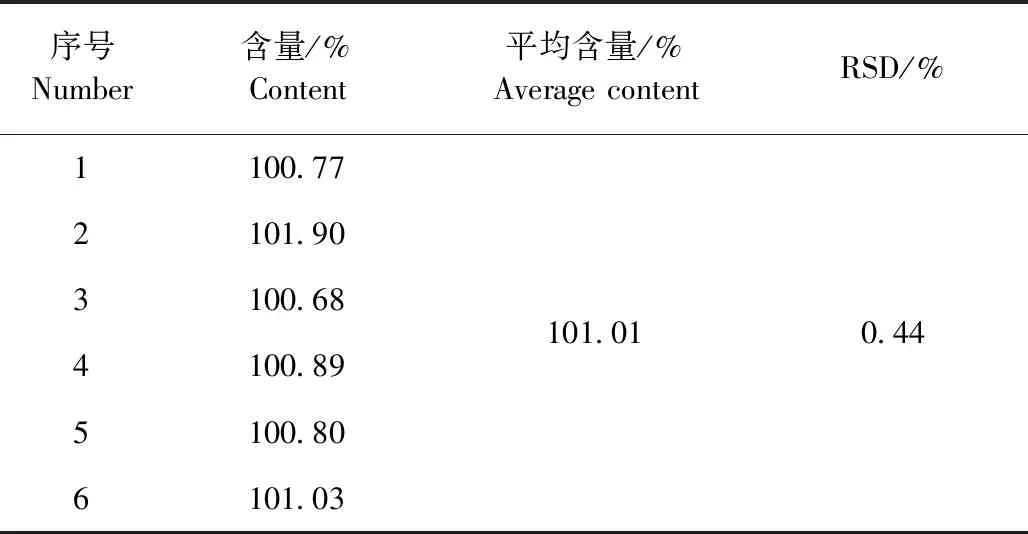
表2 盐酸利多卡因重复性试验结果Table 2 The reproducibility test results of lidocaine hydrochloride
2.1.5 回收率试验 结果见表3。盐酸利多卡因的平均回收率为99.2%,RSD为0.77%。试验结果良好,符合《中国兽药典》质量标准中回收率试验要求。
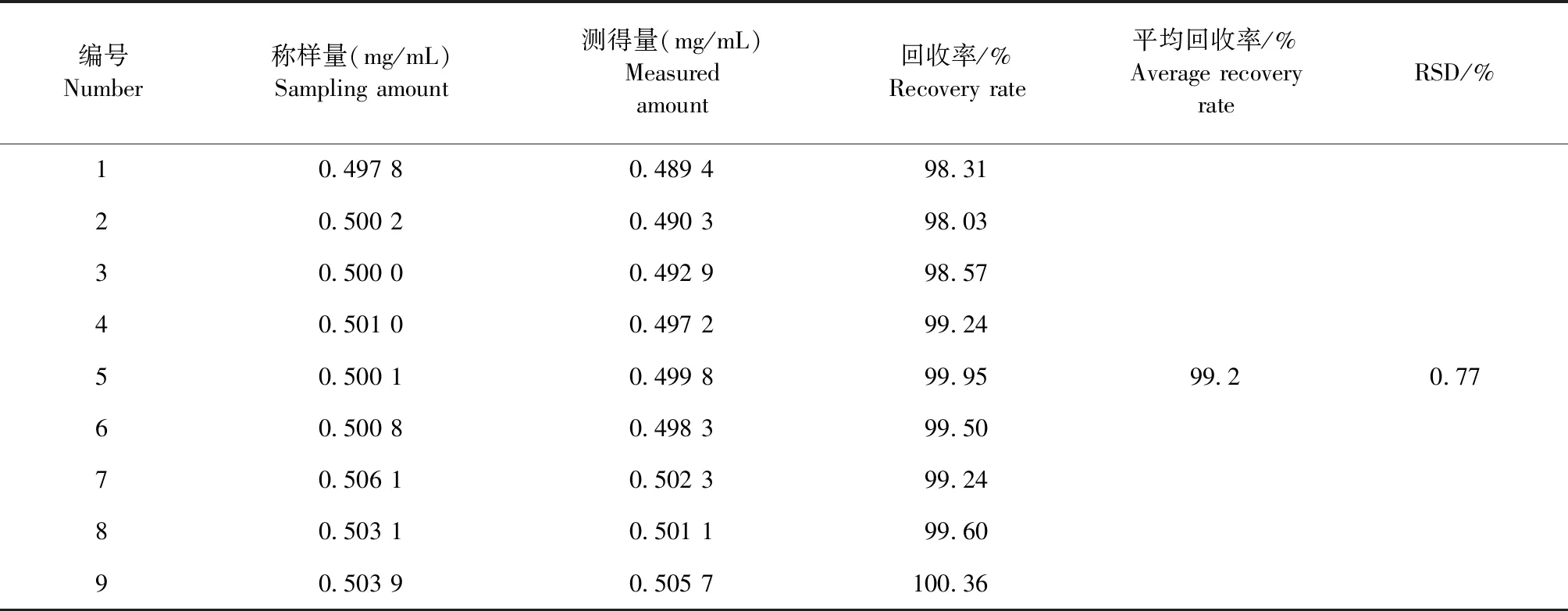
表3 盐酸利多卡因回收率试验结果Table 3 The recovery rate test results of lidocaine hydrochloride
2.1.6 稳定性试验 结果见表4。样品中盐酸利多卡因峰面积RSD为0.54%,表明样品溶液在室温下放置24 h含量稳定性良好。
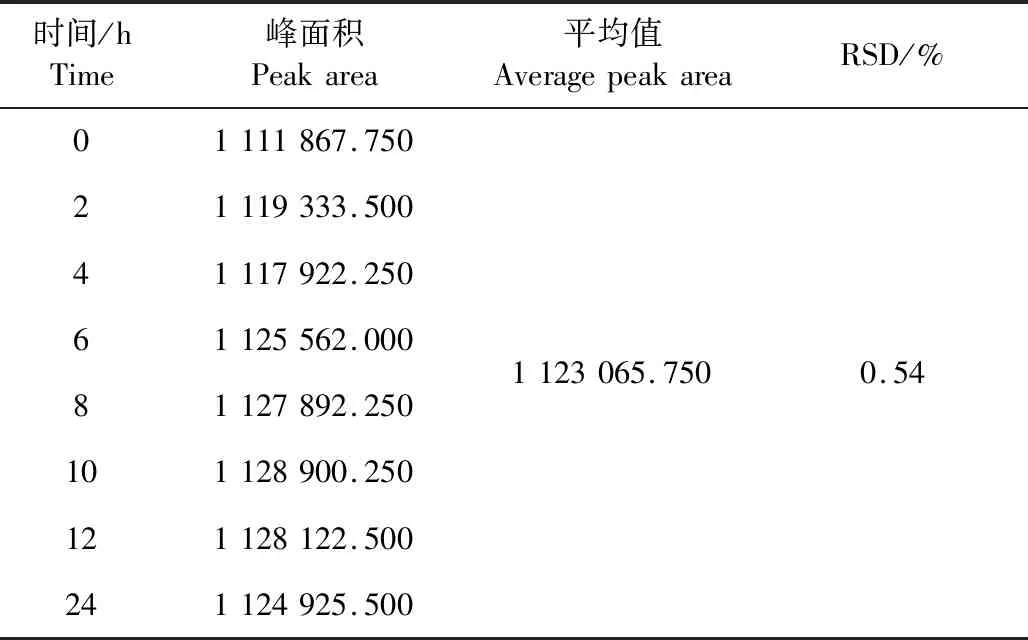
表4 盐酸利多卡因稳定性试验结果Table 4 The stability test results of lidocaine hydrochloride
2.1.7 定量限 按信噪比10∶1为标准,测得盐酸利多卡因的定量限为5 μg/mL。
2.1.8 样品测定 3批复方盐酸利多卡因凝胶剂样品中的盐酸利多卡因测定结果见表5。由表5可知,盐酸利多卡因的含量均在标示量的95.0%~105.0%,符合《中国兽药典》通常规定的含量限度范围,平均相对偏差也符合检验要求。
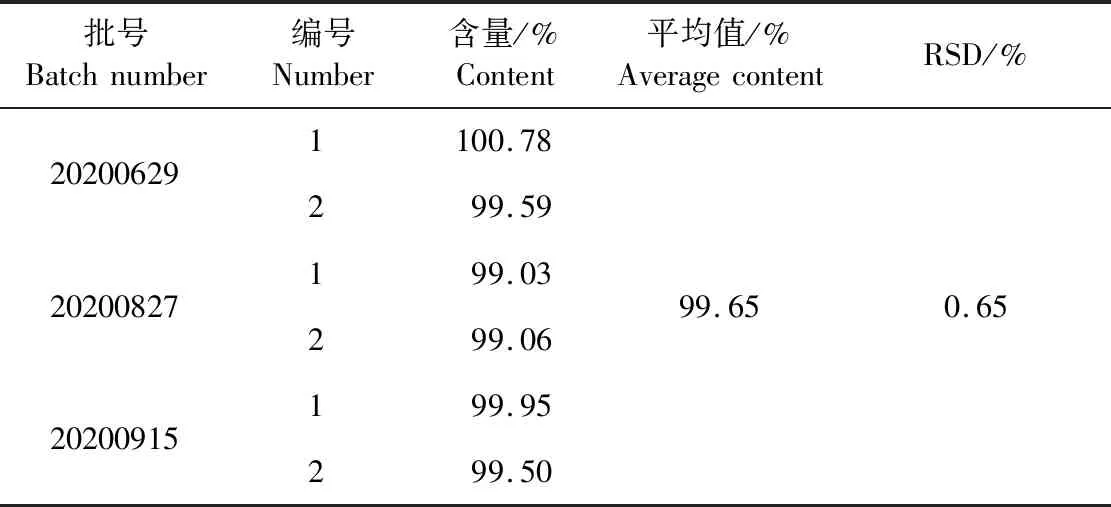
表5 样品中盐酸利多卡因含量测定结果Table 5 Determination results of lidocaine hydrochloride in samples
2.2 恩诺沙星含量测定
2.2.1 系统适用性考察 如图3所示,阴性对照溶液无干扰,对照品和供试品溶液出峰时间基本一致,表明本方法专属性良好。

图3 恩诺沙星系统适用性色谱图Fig.3 Chromatograms of system applicability of enrofloxacin
2.2.2 线性范围 以对照品浓度(x)为横坐标,峰面积(y)为纵坐标,进行回归分析,得线性回归方程:y=141 315x-1 107,R=0.999 6(n=5)。结果表明恩诺沙星浓度在4.98~49.79 μg/mL范围内,与峰面积呈良好线性关系,结果见图4。
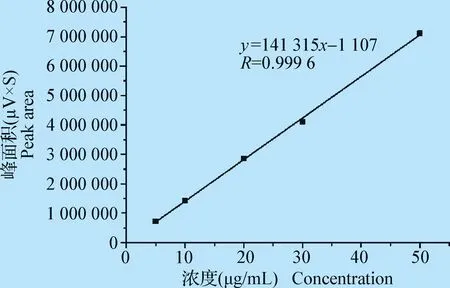
图4 恩诺沙星线性关系Fig.4 Linear relationship of enrofloxacin
2.2.3 精密度试验 结果见表6。恩诺沙星的RSD为0.24%,结果表明仪器精密度符合要求。
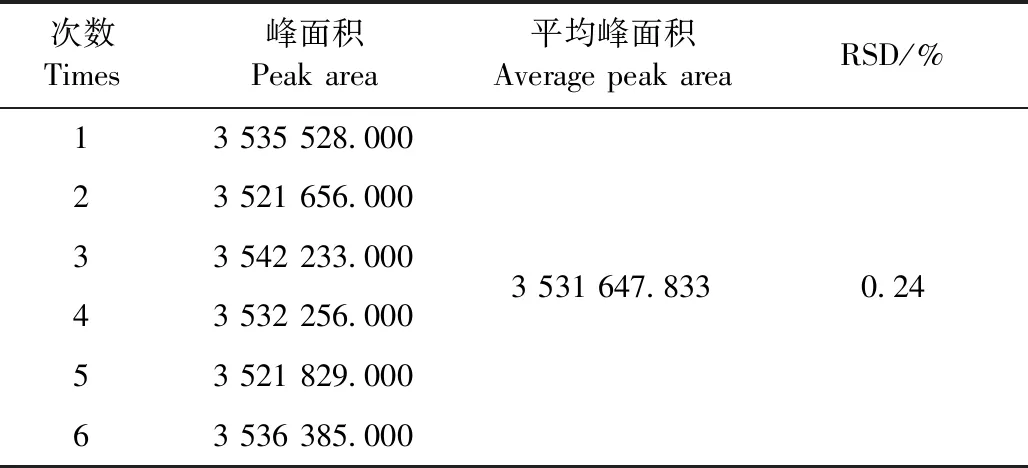
表6 恩诺沙星精密度试验结果Table 6 The precision test results of enrofloxacin
2.2.4 重复性试验 结果见表7。恩诺沙星的平均含量为标示量的99.76%,RSD为0.81%,结果表明该方法重复性良好。
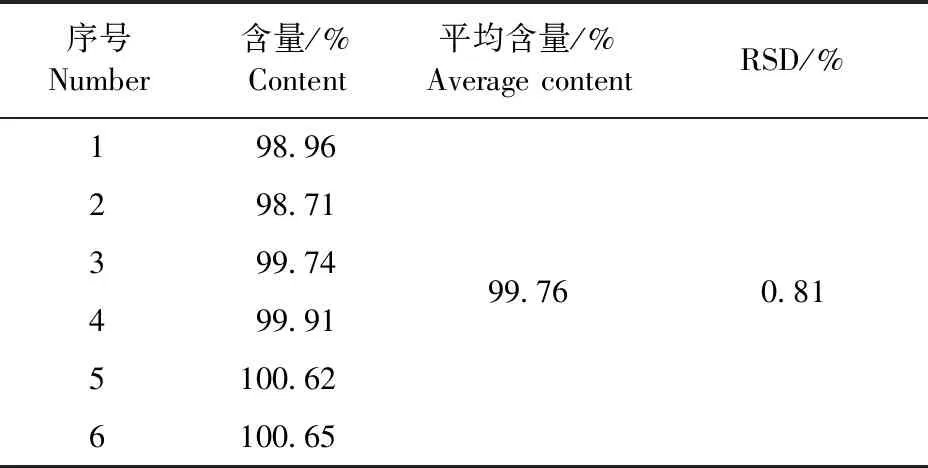
表7 恩诺沙星重复性试验结果Table 7 The reproducibility test results of enrofloxacin
2.2.5 回收率试验 结果见表8。恩诺沙星的平均回收率为100.28%,RSD为0.88%。试验结果良好,符合《中国兽药典》质量标准中回收率试验要求。
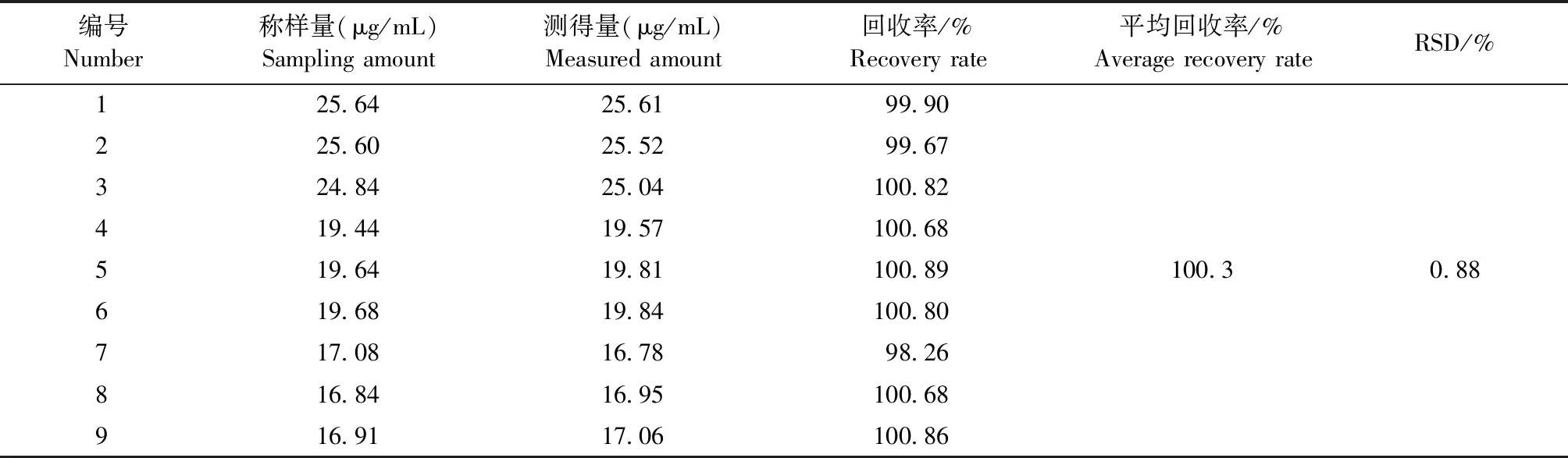
表8 恩诺沙星回收率试验结果Table 8 The recovery rate results of enrofloxacin
2.2.6 稳定性试验 结果见表9。样品中恩诺沙星峰面积RSD为0.62%,表明样品溶液在室温下放置24 h含量稳定性良好。
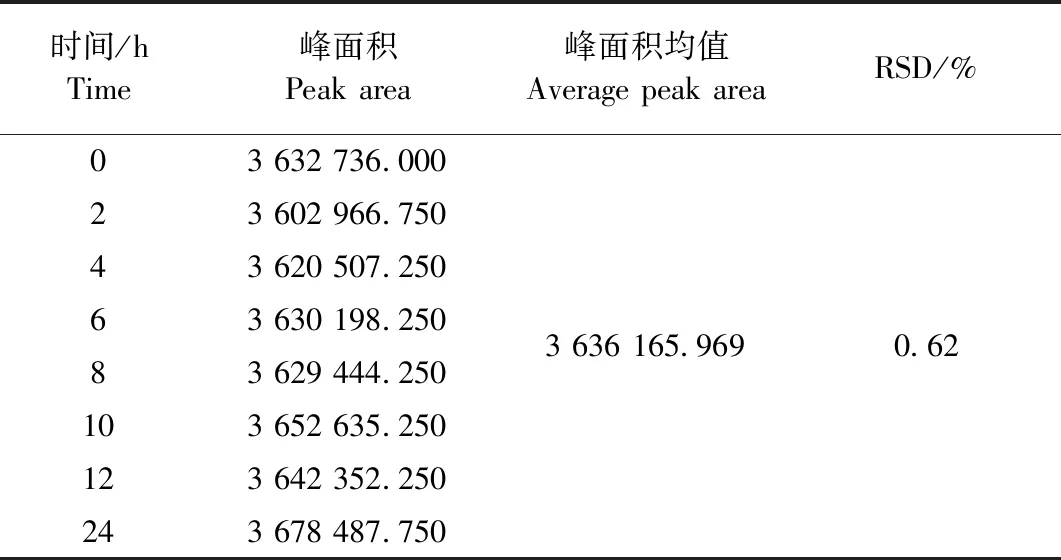
表9 恩诺沙星稳定性试验结果Table 9 The stability test results of enrofloxacin
2.2.7 定量限 按信噪比10∶1为标准,测得恩诺沙星的定量限为6 ng/mL。
2.2.8 样品测定 3批复方盐酸利多卡因凝胶剂样品中的恩诺沙星测定结果见表10。由表10可知,恩诺沙星的含量均在标示量的90.0%~110.0%,符合《中国兽药典》通常规定的含量限度范围,平均相对偏差也符合检验要求。
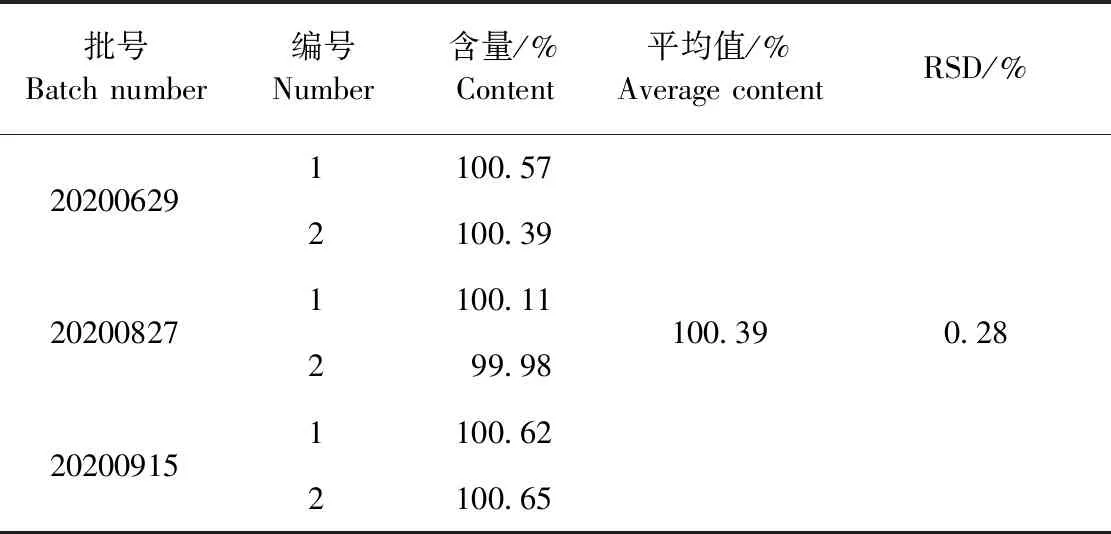
表10 样品中恩诺沙星含量测定结果Table 10 Determination results of enrofloxacin content in samples
3 讨论
《中国兽药典》2015版中规定的盐酸利多卡因测定含量的浓度为2 mg/mL[11],前期预试验中发现以该浓度配制供试品时,检测的盐酸利多卡因含量与理论值相差较大,故本方法调整进样浓度为0.5 mg/mL,克服了含量检测效果不理想的问题。
方法学考察结果表明,盐酸利多卡因色谱条件为以十八烷基硅烷键合硅胶为填充剂,以磷酸盐缓冲液-乙腈(50∶50)(用磷酸调节至pH 8.0)为流动相,检测波长为254 nm,流速为1.0 mL/min,进样量为20 μL,在此条件下,盐酸利多卡因在0.100 5~1.004 9 mg/mL浓度范围内线性关系良好,相关系数R为0.999 9;精密度试验结果为0.72%;重现性试验结果为检测的平均含量为标示量的101.01%,RSD为0.44%;平均加样回收率为99.2%,RSD为0.77%;放置24 h含量无明显变化,RSD为0.54%;盐酸利多卡因的定量限为5 μg/mL。
恩诺沙星色谱条件为以十八烷基硅烷键合硅胶为填充剂,以0.025 mol/L磷酸溶液(用三乙胺调节至pH 3.0)-乙腈(83∶17)为流动相,检测波长278 nm,流速为1.0 mL/min,进样量为20 μL,在此条件下,恩诺沙星在4.98~49.79 μg/mL浓度范围内线性关系良好,相关系数R为0.999 6;精密度试验结果为0.24%;重现性试验结果为检测的平均含量为标示量的99.76%,RSD为0.81%;平均加样回收率为100.3%,RSD为0.88%;放置24 h含量无明显变化,RSD为0.62%;恩诺沙星的定量限为6 ng/mL。
本方法在一定的浓度范围内线性、精密度、重现性、回收率和稳定性俱佳,故该方法可作为复方盐酸利多卡因凝胶剂中盐酸利多卡因和恩诺沙星的含量测定方法。
