甘草素通过AMPK/mTOR 通路对人口腔鳞癌细胞放疗敏感性的作用研究
2021-10-24耿玉东王书斌卢泰青朱保玉杨中锐
张 炜 耿玉东 王书斌 卢泰青 朱保玉 杨中锐
头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)是世界第六大常见恶性肿瘤,口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是HNSCC 的主要类型,具有增殖活力强、恶性程度高、患者预后差、生存率低的特点[1-2]。目前,OSCC 的临床治疗常采用手术联合放化疗的综合疗法,明显提高了患者生存率[3]。其中,放射治疗效果与肿瘤的放疗敏感性密切相关,放疗耐受性的出现是导致患者放疗失败的主要原因,降低肿瘤的抗辐射性对提高放疗的临床疗效具有重要意义[4]。自噬是真核细胞降解和再循环受损蛋白质或细胞器的过程,是机体保持内环境稳态的重要途径,已被证明与肿瘤细胞放疗耐受性的发生密切相关,可通过哺乳动物雷帕霉素靶标(mammalian target of rapamycin,mTOR)依赖和非依赖途径被激活[5]。甘草素(liquiritigenin,LQ)是我国传统中药甘草中的一种黄酮类化合物,具有抗炎、抗氧化应激、抗病毒、抗真菌、抗肿瘤等多种药理学作用[6]。研究表明,LQ 可增强不同肿瘤细胞对放化疗的敏感性,但LQ 对OSCC 放疗敏感性的影响及其可能的原因尚不清楚[7]。因此,本研究以细胞自噬为切入点,观察LQ 联合放疗对OSCC 细胞SCC-15 生物学功能的影响,探讨LQ 对OSCC 放疗敏感性的作用及机制。
1.材料与方法
1.1 细胞培养 人OSCC 细胞株SCC-15 购自中科院上海细胞库,细胞培养在含有10%胎牛血清的RPMI-1640 培养基中,培养条件为5%CO2、37℃。每2~3d 传代一次,取对数生长期的细胞用于实验。
1.2 试剂与仪器 甘草素(纯度99%,武汉天植生物技术有限公司,货号:CFN99156);RPMI-1640 培养基、胎牛血清、MTT、吉姆萨染色液、ANNEXIN V-FITC 检测试剂盒(北京索莱宝科技有限公司);自噬微管相关蛋白轻3 Ⅱ/ Ⅰ(microtubule-associated protein1 light chain3-Ⅱ/Ⅰ,LC3Ⅱ/Ⅰ)、Beclin-1、AMP 活化蛋白激酶(AMPactivated protein kinase,AMPK)、磷酸化的AMPK(phosphorylated AMPK,p-AMPK)、mTOR、磷酸化的mTOR(phosphorylated mTOR,p-mTOR)、核糖体S6 蛋白激酶(ribosomal S6 kinase,S6K)、磷酸化的S6K(phosphorylated S6K,p-S6K)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔源单克隆抗体,羊抗兔二抗(武汉三鹰生物技术有限公司);Varian 2100EX 直线加速器(瓦里安公司,美国);IX53 显微镜(奥林巴斯,日本);FACSCanto II 流式细胞仪(BD 公司,美国);DYCZ-24KS 型双板垂直电泳仪(北京六一仪器厂);G:BOX 多功能凝胶成像系统(Syngene 公司)。
1.3 MTT 法检测细胞增殖活力 收集对数期生长的SCC-15 细胞,以4×103个/ 孔的浓度接种于96 孔板中,37℃过夜培养后去除细胞培养基,加入含有不同浓度LQ(0.1、0.2、0.4、0.8mmol/ L)的含药培养基,置于培养箱继续孵育48h,弃培养基,用磷酸盐缓冲溶液(phosphate buffered solution,PBS)冲洗3 遍后加入5mg·mL-1MTT溶液20μL,37 ℃孵育4h 后弃上清,加入二甲基亚砜(dimethyl sulfoxide,DMSO)150μL,充分振荡混匀后在490nm 波长下检测吸光度(optical density,OD)值,计算细胞增殖率(%)和LQ 作用SCC-15 细胞48 h 后的IC50,选择对细胞抑制率约为10%的药物浓度(0.1 mmol/ L)作为后续实验中LQ 的给药浓度。
1.4 平板克隆形成实验检测细胞生存分数 将细胞分为放疗组和联合组。细胞放疗时置于Varian 2100EX 型直线加速器下进行照射,源皮距100 cm,机架角180°,6 MV-X 射线行0、2、4、6、8Gy 等中心照射,细胞培养容器下垫厚度为1cm的有机玻璃板。放疗组仅进行0、2、4、6、8Gy X 射线照射处理;联合组预先使用0.1mmol/ L 的LQ 处理48h 后再进行0、2、4、6、8Gy X 射线照射处理。照射后立即用PBS 洗涤2 次,更换新鲜培养基后放入培养箱中继续培养10d,弃培养基,甲醇固定15min,吉姆萨染液染色30min,计数大于50 个细胞的克隆数量。细胞存活分数(surviving fraction,SF)=实验组克隆数/ (接种细胞数×克隆形成率);克隆形成率=对照克隆数/ 接种细胞数×100%。
1.5 MTT 法检测LQ 对SCC-15 细胞增殖活力的影响 将SCC-15 细胞分为对照组、LQ 组、放疗组和联合组。对照组细胞常规方法培养,无干预;LQ 组细胞采用0.1 mmol/ L 的LQ 处理48h;放疗组采用4Gy X 射线照射处理;联合组采用0.1mmol/ L 的LQ 处理48h 后再进行4Gy X 射线照射处理。经过X 射线照射处理的细胞均重新放回培养箱继续培养48h。各组均按照1.3 的MTT法检测细胞增殖活力。
1.6 流式细胞术检测细胞凋亡率 按照1.5 的方法对细胞进行分组处理,收集细胞,PBS 洗涤3 次,1mL binding buffer 重悬,调整细胞密度为1×106个/ mL,每管加入100μL 细胞,再加入5μL Annexin V-FITC,室温避光孵育10min,加入5μL PI,室温避光孵育5min,加入PBS 至500μL,混匀后使用流式细胞仪检测细胞凋亡率。
1.7 Western blot 法检测LC3Ⅱ/Ⅰ、Beclin-1及AMPK/ mTOR 通路相关蛋白表达 细胞分组处理同1.5。收集细胞,加入蛋白裂解液冰上裂解20min,离心取上清液,BCA 法测定蛋白浓度,加入loading buffer,在EP 管中混匀后置于沸水中煮沸5min 使蛋白变性,按照30μg/ 孔的上样量进行SDS-PAGE 电泳,转膜、封闭,封闭结束加入各一抗稀释液(稀释比例均为1∶1000),4℃过夜,洗涤3 次,加入羊抗兔二抗孵育2h(稀释比例为1∶1000),洗涤3 次,滴加ECL 发光液,置于凝胶成像仪中显影。以Image J 软件分析各个目的蛋白对应的灰度值,计算蛋白相对表达量,蛋白相对表达量=目的蛋白灰度值/ GAPDH 蛋白灰度值。
1.8 统计学分析 应用SPSS 25.0 软件进行统计分析数据,实验重复3 次,计量资料以均数±标准差()表示,多样本比较采用单因素方差分析,两样本比较采用SNK-q 检验。P<0.05 为差异有统计学意义。
2.结果
2.1 不同浓度LQ 对SCC-15 细胞活力的影响随着LQ 给药剂量的增加,SCC-15 细胞活力降低,LQ 对细胞的抑制作用呈剂量依赖性(P<0.05)。经计算,LQ 作用SCC-15 细胞48h 的IC50为0.36mmol/ L。选择对细胞抑制率约为10%的浓度(0.1mmol/ L)作为后续实验中LQ 的给药浓度,后续实验均使用0.1mmol/ L LQ 处理SCC-15 细胞48h(图1)。
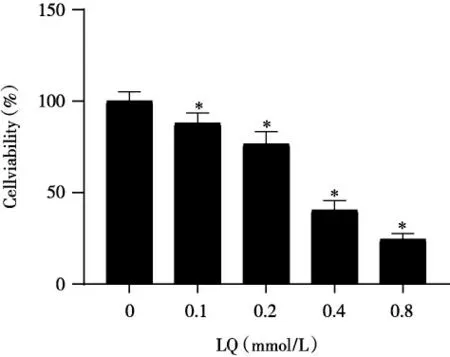
图1 不同浓度LQ 对SCC-15 细胞活力的影响
2.2 LQ 对SCC-15 细胞放疗敏感性的影响随着放射剂量的增加,放疗组和联合组SCC-15 细胞的生存分数逐渐降低(图2)。与放疗组比较,联合组SCC-15 细胞的生存分数显著降低(P<0.05)。放射生物学参数D0、Dq、N 和SF2 值均降低,增敏比(sensitization enhancement ratio,SER)为1.33。照射剂量为4Gy 时SCC-15 细胞的存活分数为0.5 左右,因此采用4Gy 的剂量开展后续实验。
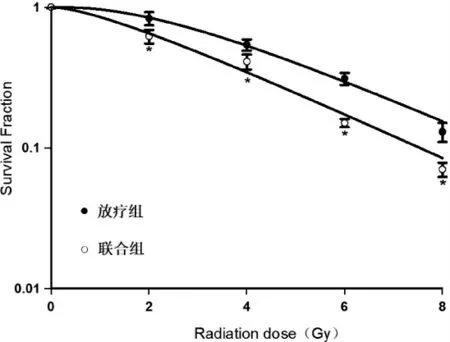
图2 不同剂量X 射线照射后SCC-15 细胞的存活曲线

表1 单击多靶模型参数
2.3 LQ 联合放疗对SCC-15 细胞活力的影响与对照组比较,LQ 组、放疗组和联合组SCC-15细胞增殖活力均降低(P<0.05),且联合组细胞增殖活力显著低于LQ 组和放疗组(P<0.05)(图3)。
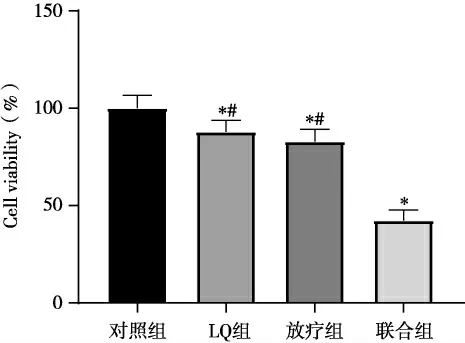
图3 LQ 联合放疗对SCC-15 细胞活力的影响
2.4 LQ 联合放疗对SCC-15 细胞凋亡的影响与对照组比较,LQ 组、放疗组和联合组SCC-15细胞凋亡率显著升高(P<0.05),且联合组细胞凋亡率显著高于LQ 组和放疗组(P<0.05)(图4)。
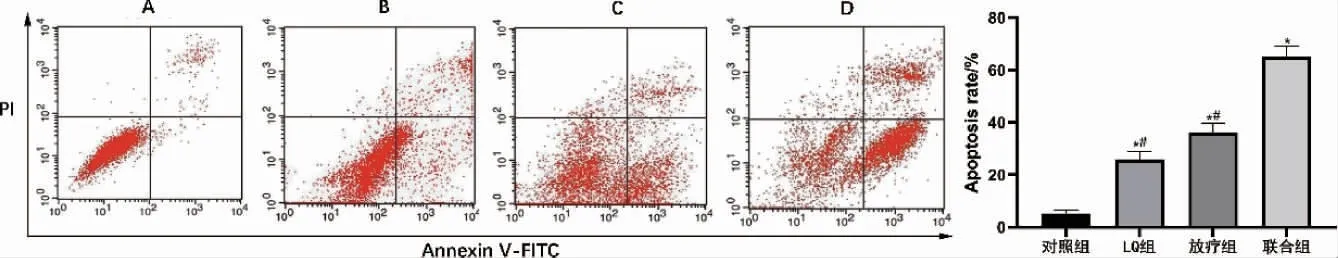
图4 LQ 联合放疗对SCC-15 细胞凋亡的影响
2.5 LQ 联合放疗对SCC-15 细胞自噬相关蛋白表达的影响 作用48h 后,与对照组比较,LQ组、放疗组和联合组SCC-15 细胞LC3Ⅱ/ Ⅰ、Beclin-1 蛋白表达均增加(P<0.05),而联合组细胞LC3Ⅱ/ Ⅰ、Beclin-1 蛋白表达显著高于LQ 组和放疗组(P<0.05)(图5)。

图5 LQ 联合放疗对SCC-15 细胞自噬相关蛋白表达的影响
2.6 LQ 联合放疗对SCC-15 细胞AMPK/mTOR 通路相关蛋白表达的影响 作用48h 后,与对照组比较,LQ 组、放疗组和联合组SCC-15细胞p-AMPK/ AMPK 水平升高,p-mTOR/mTOR 和p-S6K/ S6K 水平降低(P<0.05),其中,联合组细胞p-AMPK/ AMPK 显著高于LQ 组和放疗组,p-mTOR/ mTOR 和p-S6K/ S6K 水平低于LQ 组和放疗组(P<0.05)(图6)。

图6 LQ 联合放疗对SCC-15 细胞AMPK/ mTOR 通路相关蛋白表达的影响
3.讨论
放射治疗是恶性肿瘤临床治疗的重要方法,其疗效取决于各种肿瘤细胞的放射敏感性[8]。虽然增加放疗频率和剂量可提高放疗效果,但同时也对机体造成不同程度的损伤,因此,选择其他科学合理的药物或疗法联合放疗以提高放疗敏感性对恶性肿瘤的临床治疗具有重要意义[9]。LQ 是从中药甘草中提取的二氢黄酮类单体化合物,具有多种药理学活性[10]。Lei 等[11]研究表明,LQ 通过抑制PI3K/AKT/ mTOR 信号通路提高三阴性乳腺癌对阿霉素的敏感性。黄雨婷等[12]总结,甘草素可通过促进细胞内活性氧产生、上调p53 和Bax、下调Bcl-2,激活caspase-9 和caspase-3 等机制产生抑制肿瘤细胞增殖和促进细胞凋亡的作用。这些证据表明LQ可有效影响不同种类恶性肿瘤的发生发展,但其对HNSCC 的作用研究尚少,其作用机制尚不清晰。
本研究使用不同浓度LQ 处理人OSCC 细胞株SCC-15,细胞的增殖活力呈剂量依赖性显著降低,表明LQ 对SCC-15 细胞具有增殖抑制作用。王勇等[13]研究发现,LQ 通过调控WIG-1 基因表达抑制肺癌细胞的生物学功能,并增强其放疗敏感性。与上述研究结果相似,本研究发现,与放疗组比较,LQ 联合放疗显著降低SCC-15 细胞的生存分数,二者联合处理细胞后可显著降低细胞的增殖活力并促进细胞凋亡,表明LQ 能增加SCC-15 细胞的放疗敏感性。
自噬是一种进化保守的信号传导途径,可将有功能障碍的蛋白质或细胞器传递到溶酶体中进行降解和再循环,是机体保持内环境稳态的重要途径[14]。自噬功能障碍可导致包括癌症在内的多种疾病,该过程不仅在肿瘤抑制中起作用,也可以作为恶性肿瘤的肿瘤促进剂促进原发性肿瘤的生长[15]。LC3 是构成自噬体膜的主要成分,分为LC3-Ⅰ和LC3-Ⅱ两种类型,可溶性LC3-Ⅰ在自噬过程中被活化后转化为LC3-Ⅱ,参与自噬体膜的形成[16]。Beclin-1 是自噬小体形成早期阶段的必要分子,抑制Beclin-1可影响其下游分子LC3-Ⅰ和LC3-Ⅱ的功能[17]。Zhao 等[18]研究表明,Beclin-1 和LC3 与癌细胞的恶性生物学行为有关,Beclin-1 和LC3 的低表达可导致更具侵袭性的癌细胞表型。本研究显示,与单纯使用放疗比较,LQ 联合放疗处理SCC-15细胞后,细胞中LC3Ⅱ/Ⅰ、Beclin-1 蛋白表达显著升高,表明LQ 可提高SCC-15 细胞自噬水平。AMPK/ mTOR 信号通路在多种疾病中均发挥重要作用,其中AMPK 和mTOR 是自噬的主要调节因子,AMPK 通过直接和间接抑制mTOR 的活性正向调节自噬[19]。S6K 是mTOR 信号通路下游靶蛋白,可被mTOR 复合物1 的磷酸化而激活,活化的S6K 可进一步调控mRNA 翻译、核糖体生物合成、自噬和营养代谢等诸多过程[20]。研究表明,AMPK的磷酸化可显著降低mTOR 和S6K 的活性,从而阻断下游信号转导,调控AMPK/ mTOR/ S6K 信号通路可抑制癌细胞增殖并诱导细胞凋亡[21-22]。在本研究中,与单纯使用放疗处理细胞比较,LQ 联合放疗促进细胞中AMPK 蛋白的磷酸化,降低了mTOR 和S6K 的磷酸化水平,表明LQ 的作用可能与促进AMPK 活化,抑制mTOR 和S6K 蛋白活化水平有关。
综上所述,本研究探索了LQ 对人OSCC 细胞放疗敏感性的作用及对AMPK/ mTOR/ S6K 信号通路的影响,为LQ 治疗口腔鳞癌的机制研究、药物开发及临床研究提供理论依据。但本研究仅在细胞水平进行了初步研究,与实际临床放疗尚有差距,仍需结合体内实验及临床研究进行进一步探索。
