激光吸收光谱技术在大肠杆菌生长测量中的应用
2021-10-23卢俊城杨朝凤管祖光陈达如邵杰
卢俊城,杨朝凤,管祖光,陈达如,邵杰*
(1 浙江师范大学信息光学研究所,浙江 金华 321004;2 瑞谱医疗设备(东莞)有限公司,广东 东莞 523808;3 浙江师范大学杭州高等研究院,浙江 杭州 311200)
0 引言
微生物广泛分布在生物圈各种环境中,与众多生物体存在着各式各样的依存关系[1,2]。微生物参与了自然界中C、N、S、P 等元素的物质循环,与人类生产生活最为密切;在农业[3]、工业[4]、发酵工程[5]、生物酶工程[6]上起着重要的作用,在人类生产实践中扮演着至关重要的角色。为了了解微生物生长特性,推动农业、工业的深入发展,对微生物生长规律的研究显得尤为重要。微生物生长曲线主要反映在某一特定环境条件下的单细胞微生物在液体培养中表现出的群体生长规律。根据微生物生长速率的特性,通常将微生物生长曲线划分为调整期(Lag phase)、对数期(Exponential phase)、稳定期(Stationary phase)和衰亡期(Decline phase)[7,8],其中调整期和稳定期在实际生产中具有重要作用[9,10]。
目前,微生物生长曲线测量的传统方法有微生物平板计数法[11]、生长量测量法[12]等,然而该类方法存在一些不足,如步骤较繁、检测时间长、需要训练有素的技术人员、容易因操作人员疲劳而引入误差等,往往造成检测结果不够精确。近年来,O’Mahony 等[13]通过添加O2传感探针来测量微生物耗氧量,利用耗氧量分析法间接测量出微生物生长曲线;Mozola 等[14]利用pH 值显色技术间接测量出生长曲线,利用微生物代谢产物CO2溶解形成碳酸,溶液pH 值逐渐变化,从而导致化学指示剂的颜色随之变化的特性,依据变化量间接反映微生物生长状况。然而以上方法均添加了第三方介质,造成侵入式的操作测量,因此难以将其应用于生产实践中。
由于微生物在生长代谢过程中都会产生CO2,CO2产物释放法成为该检测技术领域中的一种“金标准”。其原理为:微生物在培养瓶培养过程中,无论是厌氧菌还是需氧菌都在新陈代谢过程中产生CO2,其增量与活体细菌数量成正比,因此通过测量微生物生长代谢产物CO2的含量能够实时监测微生物的生长情况。可调谐半导体激光吸收光谱(TDLAS)技术是一种具有高灵敏度、高选择性、高分辨率、结构简单、以及非侵入式快速在线检测等优势的痕量气体分析检测技术,因其独特优势,现已广泛应用于呼吸气体分析、化学反应过程测量、大气环境监测、工业燃烧控制、疾病的早期诊断和筛查、航空发动机稳定性测试等众多应用领域[15,16]。
本文以大肠杆菌作为非典型生物培养样本,将TDLAS 技术中的波长调制吸收光谱(WMAS)技术应用在大肠杆菌生长测量领域,通过监测大肠杆菌生长代谢产物CO2气体实现对大肠杆菌生长过程的监测。
1 实验装置及理论介绍
1.1 实验装置
搭建的实验装置如图1 所示,由函数发生器(Agilent,33220A)产生的低频锯齿波扫描信号(10 Hz,800 mV)加上锁相放大器(SR830,SRS)产生的高频正弦调制信号(20.06 kHz,0.168 V)后接入激光控制器(ModelLDC-501,SRS),其用于扫描和调制蝶形半导体激光器(DFB,Nanoplus 2004 nm)的输出波长,调节光衰(VOA50PM-APC)使激光至合适强度,并将其耦合至准直透镜(F260APC-1550,Thorlabs)中。准直透镜输出的激光打在培养液的上方,穿过培养液上方的CO2气体介质后被光电探测器(LSIPD-261,Hightsensing)接收,再将信号传输至锁相放大器和数据采集卡(USB-6351,Nation Instruments)。锁相放大器将解调出的二次谐波信号输入数据采集卡,在计算机上通过Labview 获取到两个频道信号,通过对信号数据进行分析处理后,得到大肠杆菌的实时生长曲线。其中准直透镜、培养瓶和探测器放置在恒温培养箱中(上海光地仪器设备有限公司),通过设定恒温培养箱的工作温度,使大肠杆菌生长处于适宜的恒温状态。

图1 基于波长调制技术测量微生物生长的实验装置Fig.1 Experimental device for measuring microbial growth based on wavelength modulation technology
1.2 理论介绍
Beer-Lambert 定律是吸收光谱理论中的核心定律,它描述了入射光I0(ν)、透射光I(ν)与气体吸收介质之间的关系,可表示为

式中:α(ν)为待测量的吸收系数,P为气体压强,X为气体吸收介质浓度,S为吸收谱线的线强,φ(ν)为线型函数,L表示为激光与气体吸收介质的相互作用长度。由(1)式可见,在已知气体压强、吸收谱线线强、线型函数和光程的情况下,通过测量光束与气体相互作用后强度的衰减可以计算出气体浓度。为了提高探测极限,实验中通常采用WMAS 技术对气体浓度进行测量[17,18]。当培养瓶内的气体吸收较小时[PXSφ(ν)L≤0.05],从锁相放大器解调出来的二次谐波的峰值为

式中:ν0为跃迁中心频率,m为调制幅度,θ=ωt,ω=2πf。
2 实验结果与分析
2.1 微生物接种
在开始微生物生长测量实验前需要制备已知浓度的微生物,并接种到装有液体培养基(Luria-Bertani,LB)的培养瓶里,此处接种的微生物为大肠杆菌。
1)灭菌和配置培养基:取出试管架、酒精灯、接种针和无菌试管等实验工具,摆放在无菌超净台上,打开紫外灯将实验工具和超净台灭菌30 min,然后配制LB 固体培养基和液体培养基,将配制好的培养基放入三角瓶,加上封口膜;将培养皿用牛皮纸包好,一起放入高压蒸汽灭菌锅内,在1 kg/cm2(121°C)条件下灭菌15 min。固体的培养基倒平板备用。
2)复苏:挑取大肠杆菌菌种。利用浓度为99%的酒精棉布擦拭手,点亮酒精灯,在酒精灯火焰下利用接种环取出一环大肠杆菌,在培养基上划线,将培养皿倒置,在37°C 条件下培养24 h 至长出菌落。
3)摇菌:向无菌试管内加入3 mL LB 液体培养基,挑取单菌落加入培养基中,将试管放入摇床振荡活化,其中摇床工作温度设定为37°C。
4)扩大培养:在无菌超净台上放置三管无菌水。重复上述的灭菌操作后,将振荡活化了16 h 的大肠杆菌培养液稀释,并使用移液枪取出5 mL 的大肠杆菌溶液移至装有45 mL 的LB 液体培养基的培养瓶里,摇晃均质,使培养瓶中微生物的初始浓度为3×104CFU/mL。
2.2 实时监测信号
根据2.1 中的微生物接种步骤,将大肠杆菌接种至培养瓶中,然后将培养瓶放置在恒温培养箱(设置为25°C)内进行培养和生长测量。在培养测量过程中由数据采集卡将探测到的CO2吸收信号传至计算机,培养瓶接种大肠杆菌后4 个时刻的二次谐波(2f)信号以及对应的拟合信号,如图2 所示。

图2 接种大肠杆菌后不同时刻(a)0 h,(b)12 h,(c)24 h,(d)32 h的2 f 信号及对应的拟合信号Fig.2 The second harmonic signals and fitting signals after Escherichia coli inoculation at(a)0 h,(b)12 h,(c)24 h,(d)32 h
由图2 可见,实验测量的CO2的2f信号拟合效果较好。在图2 中,根据(2)式和0、12、24、32 h时刻的2f峰值反演出对应时刻的CO2浓度分别为0.038%、0.0733%、0.727%、1.022%,对应的信噪比分别为72.18、70.97、80.96、80.98 dB。通过连续36 h 对培养瓶内CO2气体的2f信号进行监测,可获取大肠杆菌在25°C 培养条件下的生长曲线,如图3 所示。
为了分析并验证波长调制吸收光谱技术对大肠杆菌生长曲线测量的可行性,还需利用微生物生长模型对实验测量获取的大肠杆菌生长曲线进行拟合。
2.3 实验曲线拟合分析
实验测得的大肠杆菌生长曲线分为4 个时期,如图3 所示,分别为调整期、对数期、稳定期及衰亡期。现用生物学常用的Gompertz 模型[19,20]来拟合分析实验测得的大肠杆菌生长曲线,并讨论该模型的拟合情况。图4 描述了在25°C 培养条件下的大肠杆菌生长曲线在Gompertz 模型下的最小二乘法拟合结果及残差图。
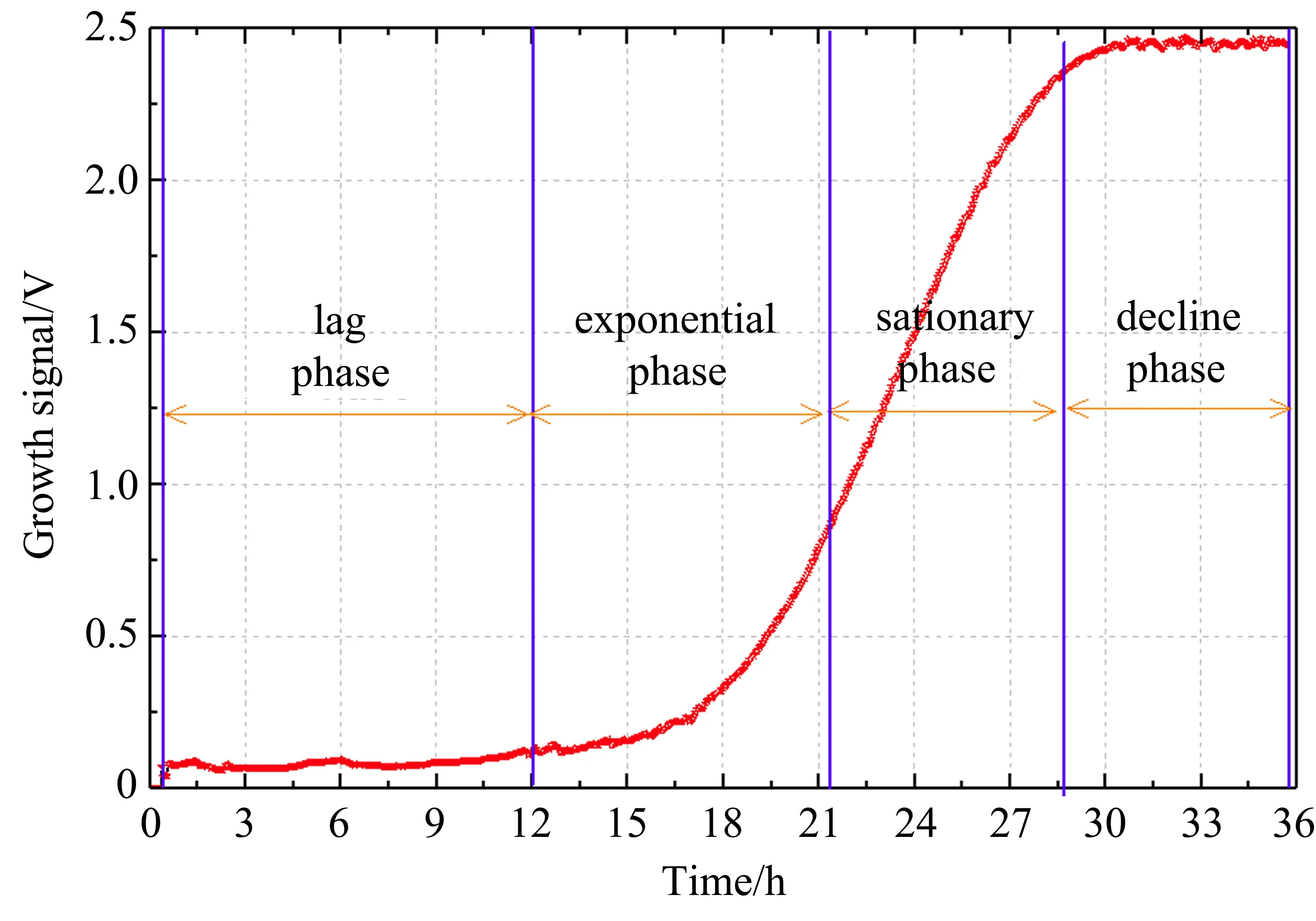
图3 25 °C 下实验测量的大肠杆菌生长曲线Fig.3 The growth curve of Escherichia coli measured at 25 °C

图4 (a)实验测量获得的生长曲线;(b)Gompertz 模型拟合的生长曲线Fig.4 (a)Growth curve obtained by experimental measurement;(b)Growth curve fitted by Gompertz model
如图4 所示,在Gompertz 模型拟合下,由残差图可以看出调整期和衰亡期的实际测量数据与拟合数据偏差较小,而对数期和稳定期的实际测量数据与拟合数据偏差相对调整期和衰亡期的偏差较大,即微生物拟合生长量要大于实际的生长量。偏差介于0.025~0.07,且较大偏差对应的时刻分别为14~19、22~24、27~29 h,不过总体拟合效果较好。
2.4 不同温度下的生长曲线测定
为了探究在不同培养温度下激光吸收光谱技术对大肠杆菌的生长测量应用,重复上述大肠杆菌的接种流程,依次取5 mL 大肠杆菌菌液至7 瓶装有45 mL LB 液体培养基的培养瓶中,大肠杆菌浓度均为3×104CFU/mL。调节恒温培养箱的工作温度,依次实现在26、29、32、34、37、39、41、43°C 培养条件下的大肠杆菌生长测量。计算机每隔3 min 采样并保存一次测量数据,并对测量数据平均100 次。
图5 是大肠杆菌在不同培养温度条件下(26、29、32、34、37、39、41、43°C)测得的生长曲线,并用Gompertz 生长模型对所测得大肠杆菌生长曲线进行拟合的结果。
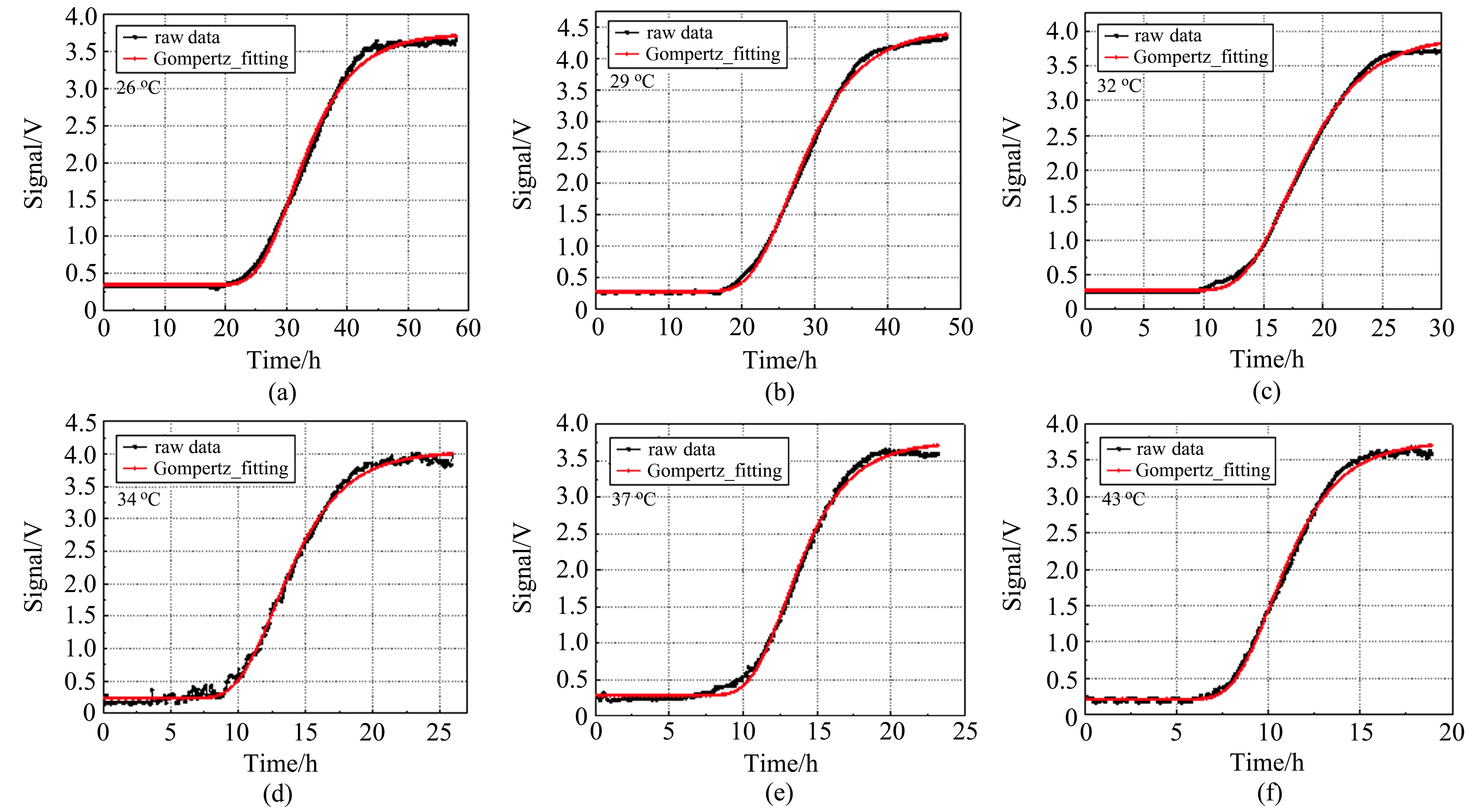
图5 实验在不同温度(a)26 °C,(b)29 °C,(c)32 °C,(d)34 °C,(e)37 °C,(f)43 °C 下测量的大肠杆菌生长曲线及Gompertz 模型拟合情况Fig.5 The growth curve of Escherichia coli and the Gompertz model measured at(a)26 °C,(b)29 °C,(c)32 °C,(d)34 °C,(e)37 °C,(f)43 °C
由图5 可见,利用激光吸收光谱技术检测微生物生长代谢产物(CO2)法所测得的生长曲线能够准确地反映大肠杆菌在不同温度下生长的调整期、对数期、稳定期及衰亡期的时间。这一结果表明,激光吸收光谱技术检测微生物生长代谢产物(CO2)法测定大肠杆菌生长曲线是可行的。传统的生长测量法测定微生物生长曲线的操作过程复杂、检测时间长、工作量大、人工干预较多、误差来源多,从而对测量结果造成较大误差,而激光吸收光谱技术检测微生物生长代谢产物(CO2)法绘制生长曲线操作过程简单,只需测定CO2含量,检测时间短,非侵入式操作,测量得到的数值更加准确,误差也更小。
3 结论
将TDLAS 技术应用于微生物生长测量,实时测量了大肠杆菌的生长曲线,同时利用生物学常用的Gompertz 模型对实验测得的微生物生长曲线进行拟合,结果显示总体拟合效果较好,能够准确反映微生物生长各个时期的状况。同时实现了在25、26、29、32、34、37、43°C 培养条件下的大肠杆菌生长曲线测量。利用TDLAS 技术测量微生物的生长误差较小,相对于现有的耗氧量分析法和pH 值显色法等,具有非侵入式测量、结构简单、操作简便、检测时间短等优势。所以,激光吸收光谱技术检测微生物生长代谢产物(CO2)法可以很好地应用于微生物生长测量领域。
