奥氮平下调SD大鼠棕色脂肪产热基因UCP1介导代谢综合征的分子机制
2021-10-22陈小英彭碧佳谢文洁邓然兮吴利玲
陈小英,彭碧佳,谢文洁,邓然兮,吴利玲
(1.川北医学院第二附属医院;2.川北医学院精神卫生学院;3.川北医学院临床医学系;4.南充市中心医院·川北医学院第二临床学院药学部·个体化药物治疗南充市重点实验室,四川 南充 637000)
奥氮平是临床治疗精神分裂症和其他严重精神疾病最常用的处方药之一。由于精神药物治疗周期长,奥氮平长期服用会显著增加体重及诱发代谢综合征[1-2],从而极大降低临床治疗依从性,导致病情反复甚至治疗抵抗,研究其介导代谢紊乱的副作用机制是临床治疗亟需解决的重要现实问题。肥胖是由于体内过量脂肪的堆积所致,脂肪组织包含两种不同类型的脂肪细胞,即白色脂肪细胞和棕色脂肪细胞。白色脂肪细胞通过甘油三酸酯的形式存储化学能,而棕色脂肪细胞能够解耦电子梯度,生成三磷酸腺苷(adenosine triphosphate,ATP)促进能量消耗[3]。在啮齿类动物中,棕色脂肪组织(brown adipose tissue,BAT)存在于肩胛间,肾周和腹主动脉区域。既往研究认为,人类仅婴儿期肩胛处存在BAT负责新生期体温维持并随着年龄的增加逐渐退化。近年热成像研究表明,在成年人颈背部也有多个离散区域存在代谢活跃的棕色脂肪组织[4]并且在维持机体能量平衡中发挥了重要作用。
棕色脂肪细胞通常比白色脂肪细胞的直径小,并且由几个小的脂滴组成,它们的细胞质中含有大量的线粒体,通过线粒体内膜上的解偶联蛋白1(uncoupling protein 1,UCP1)发挥作用。UCP1是负责棕色脂肪产热的线粒体载体蛋白,其通过催化脂肪酸激活的嘌呤核苷酸敏感的质子渗漏穿过棕色脂肪的线粒体内膜而介导机体的非颤抖性产热,棕色脂肪有助于在长期暴露于寒冷环境期间维持体温平衡,是棕色脂肪的主要生理功能[5]。研究[6]显示,UCP1消融的小鼠体重比野生型高50%以上,UCP1基因缺陷小鼠不能经高脂饮食诱导产热。棕色脂肪功能的丧失与肥胖症和代谢性疾病密切相关,奥氮平作为第二代抗精神病药物,临床应用中可出现过度镇静,打破能量平衡导致肥胖甚至严重的代谢紊乱等副作用,但其是否通过抑制棕色脂肪产热导致能量失衡性代谢紊乱目前尚未有研究证明[7]。因此,本研究通过观察奥氮平长期慢性给药后对大鼠体重、血脂生化、棕色脂组形态、产热活性的影响,结合分子生物水平分析棕色脂肪组织中UCP1、PRDM16、AMPK及β3-AR等相关产热基因的表达变化。进一步通过C3H10T1/2间充质干细胞定向分化的棕色脂肪细胞体外模型探索奥氮平对棕色脂肪细胞发育分化的影响和标记蛋白UCP1的变化等多个方面来考察奥氮平引起能量代谢紊乱的分子机制,为临床抗精神病药介导代谢综合征的干预提供新的理论靶点。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及细胞 SPF级雌性SD大鼠购自于上海国家实验动物工程中心,体重180~220 g;小鼠间充质干细胞系C3H10T1/2购自于武汉普诺赛生命科技有限公司。
1.1.2 实验药品及试剂 体内实验所用奥氮平购自江苏豪森(欧兰宁,10 mg/片);体外实验所用的奥氮平购自大连美仑生物技术有限公司(货号:MB1171)。甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、游离脂肪酸(FFA)含量测定试剂盒购自杭州联科生物技术股份有限公司。Anti-UCP1(santa cruz biotechnology,货号:SC-518024)、Anti-PRDM16(santa cruz biotechnology,货号:ab3789)、Anti-AMPK(cell signaling technology,货号:2603)、Anti-β3-AR(ybio,货号:YB-19876)、Anti-GAPDH(bioss,bs-0755R)抗体及二抗(Bioss,货号:bs-0311P-HRP)用于蛋白免疫印迹和免疫荧光实验,并通过化学发光(ECL)试剂(bio-rad laboratories,lnc)接收检测荧光信号。RIPA蛋白提取液购自北京鼎国昌盛生物公司(#WB-007);将UCP1、PRDM16、AMPK和β3-AR与GAPDH的相对蛋白表达用正常组的表达水平标准化,并使用Image J图像分析软件定量分析。MEM细胞培养基(hyclone)购自江苏凯基生物技术股份有限责任公司,澳洲胎牛血清(cellMax)购自赛澳美细胞技术有限公司。二甲基亚砜(dimethyl sulfoxide,DMSO)、0.25%胰酶消化液(含EDTA)购自北京鼎国昌盛生物公司;磷酸盐缓冲液(PBS)、青霉素-链霉素溶液、荧光二抗Anti-Mouse IgG-FITC购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 实验动物分组与处理 SD大鼠适应环境7 d,为更好地模拟临床口服药物方式,对大鼠进行主动进食训练,通过将水与载体(含有40%的玉米淀粉,30%的蔗糖,15%的明胶,13%的酪蛋白,2%矿物油)混合制成空白糖丸或与药物糖丸(奥氮平片剂粉碎后与糖丸混合)[8-10]。禁食24 h,不禁饮,第2天将空白糖丸按照后期给药时间点(8∶00、15∶00和23∶00)给药,连续训练主动进食7 d后随机分为空白对照组和奥氮平给药组,每组各12只。按上述时间点连续28 d口服奥氮平(1 mg/kg,3次/d,根据Meeh-Rubner公式按照体表面积进行等剂量换算),空白对照组同法给予等量的糖丸(以大鼠体重计算实际给药量)。给药期间,1次/4 d记录体重、摄食情况,分别于第1周和4周对大鼠肩胛处温度进行检测。动物给药方案见图1。

1.2.2 大鼠血清收集及血脂检测 给药结束后,处死前将大鼠禁食4 h,在处理之前再给予一次药丸,2 h之内将大鼠解剖,3%戊巴比妥麻醉后腹主动脉采血,4℃环境下冷冻高速离心机中1 500 rpm离心20 min,取上层血清于干净的EP管中,TG、TC、LDL、HDL及FFA的检测严格按照试剂盒说明书操作进行检测。
1.2.3 大鼠白色和棕色脂肪组织切片染色(HE染色) 取大鼠棕色脂肪、白色脂肪、肝脏及肾脏称重并记录,取一半棕色及白色脂肪组织用4%多聚甲醛固定,染色前先用二甲苯脱去切片中的石蜡,用高浓度至低浓度的酒精洗脱,并用蒸馏水洗涤1~2 s。苏木精染色(60℃)30~60 s,流水冲洗苏木精5~10 s,1%盐酸乙醇清洗1~3 s,水洗1~2 s,促蓝液反蓝5~10 s,流水冲洗15~30 s。0.5%伊红染色30~60 s,蒸馏水清洗1~2 s,80%乙醇1~2 s,95%乙醇1~2 s,无水乙醇1~2 s,石碳酸二甲苯2~3 s,二甲苯(I)2~3 s,二甲苯(II)2~3 s。将已透明的切片滴上封片剂,盖上盖玻片封固,用显微镜拍照储存。
1.2.4 Western blot 取大鼠BAT样本约30 mg,每管加入0.2 mL含1 %的蛋白酶抑制剂和1%的磷酸化酶抑制剂的RIPA(ripa lysis buffer)裂解液,置于均质破碎机使其充分破碎(4.0 M/S,20 s/次,间隔5 min,破碎3次)。将裂解产物4℃,12 000 rpm,离心10 min,取中间层蛋白液,BCA法定量蛋白质浓度,所有样品加入上样缓冲液(5×,loading buffer)后在100℃下煮沸10 min。通过SDS-PAGE分离蛋白质,并转移至PVDF膜。5%脱脂牛奶封闭2 h,加入一抗,4℃孵育过夜,TBST漂洗3次,15 min/次;加入二抗室温孵育2 h;TBST洗涤后,ECL试剂盒曝光成像,Image J软件对得到的灰度值进行分析。
1.2.5 棕色脂肪细胞的定向分化 C3H10T1/2细胞采用MEM基础培养基(含10%胎牛血清,1%青霉素-链霉素溶液),于37℃、5% CO2培养箱中培养。将C3H10T1/2细胞培养至铺满培养约70%,消化细胞后稀释至浓度为5×104个/mL接种至12孔板正常培养。将生长到100%汇合的C3H10T1/2细胞,分化经常开始于在细胞铺满后1~2 d。用含有10 %胎牛血清培养基的脂肪细胞诱导分化剂(MDI+Indo+T3+Ros):0.5 μM 3-异丁基-1-甲基黄嘌呤(IBMX)、1 μM地塞米松(Dexa)、850 nM胰岛素(insulin,Ins)、125 nM吲哚美辛(Indo)、1 μM罗格列酮(Ros)和1 nM三碘甲状腺氨酸(T3)处理48 h;之后更换含有10 %胎牛血清(FBS),850 nM Ins、1 μM罗格列酮(Ros)和1 nM三碘甲状腺氨酸(T3)的培养基(棕色脂肪培养液)继续培养,每2天更换1次。在该培养基中再过6 d左右,细胞表现出具有大量脂质积聚完全分化的表型[11]。见图2
1.2.6 油红染色 待细胞长至接触抑制时,更换为含药的诱导分化液,设置空白对照组、奥氮平组(奥氮平终浓度10 μM),即在细胞分化期慢性处理细胞6 d,1次/2 d更换诱导液,弃去培养上清,用PBS溶液洗2~3次。用4%多聚甲醛溶液在37℃下固定30 min,然后用PBS溶液洗涤两次。加入新配置过滤好的油红O溶液,于37℃下完全浸泡细胞90 min。弃去油红溶液,用PBS溶液彻底清洗残留的油红溶液。苏木素染液复染细胞核2 min,用PBS溶液彻底清洗残留的油红溶液(至少洗4次),在倒置显微镜下观察脂肪细胞的分化并拍照。弃掉孔板中的PBS,用异丙醇500 μL/孔充分溶解细胞中着色的脂滴,吸取到96孔板中,在490 nm波长下测定其吸光度值(OD),并计算细胞中储存的甘油三酯(TG)的相对含量。
1.2.7 免疫荧光染色 待细胞长至接触抑制时更换为含药的诱导分化液,设置空白对照组、奥氮平组(奥氮平终浓度10 μM),即在细胞分化期慢性处理细胞6 d,1次/2 d更换诱导液,待细胞分化结束后进行免疫荧光染色,分化结束的细胞用PBS浸泡并清洗3~4次,约5 min/次。用4%的多聚甲醛固定15 min,随后用PBST清洗细胞3次,5 min/次。配置0.25%的Triton X-100,室温下通透15 min左右,用PBST清洗3次,5 min/次,加入1%BSA,室温下封闭1.5 h。吸出封闭液,每孔加入足够量稀释好的一抗(1∶50),4℃孵育过夜。回收一抗,用PBST浸泡并清洗3~4次,约5 min/次,加入稀释好的二抗(1∶200),湿盒中37℃孵育1.5 h(随后操作全部在暗处进行)。用PBST浸泡并清洗3次,约5 min/次。滴加DAPI避光孵育5 min,使细胞核着色。随后用PBST浸泡并清洗3~4次,5 min/次,洗去多余的DAPI,加入适量的PBS保持细胞湿润,然后用高内涵细胞分析系统采集图像,并进行荧光强度统计和分析。
1.3 统计学分析
2 结果
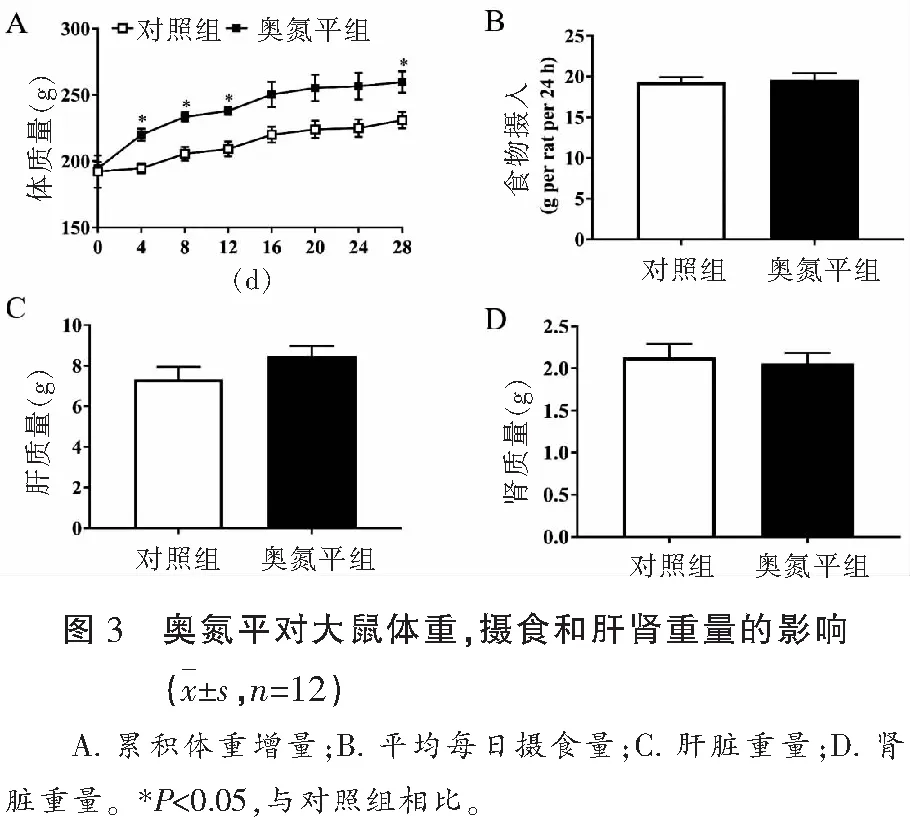
2.1 奥氮平对大鼠体重、摄食及肝肾重量的影响
与空白对照相比,奥氮平给药组体重增加(P<0.05),而对大鼠的摄食无影响(P>0.05),故而推测奥氮平导致的大鼠体重增加是独立于食物摄取的,即未影响能量摄入。肝脏及肾脏的重量变化差异无统计学意义(P>0.05)。见图3。
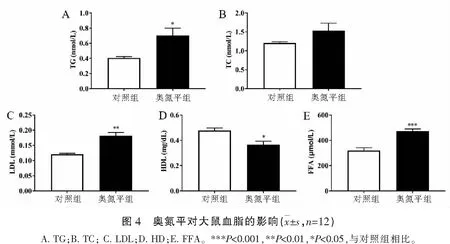
2.2 奥氮平对大鼠血脂的影响
与对照组相比,奥氮平给药组大鼠血清TG、LDL和FFA的水平增加(P<0.05),HDL的水平降低(P<0.05),部分增加TC的水平,说明奥氮平具有导致大鼠血脂异常的风险。见图4。
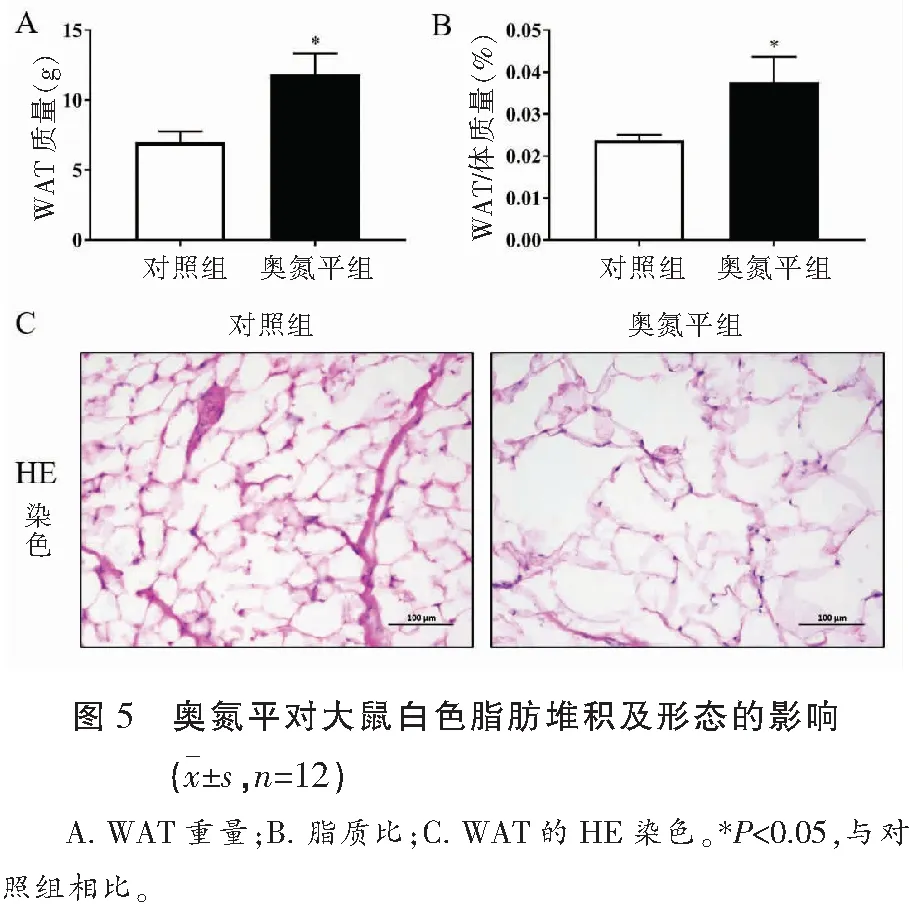
2.3 奥氮平对大鼠白色脂肪堆积及形态的影响
与对照组相比,奥氮平给药组白色脂肪组织(WAT)重量及脂质比增加(P<0.05),这是引起体重增加的主要因素。HE染色显示,奥氮平给药组脂滴的体积增大(P<0.05),引起脂肪聚积,这是肥胖的典型标志。见图5。
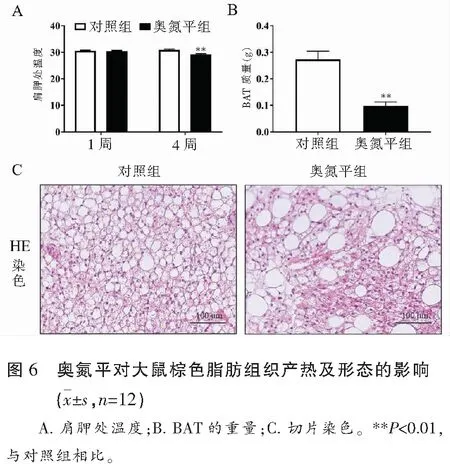
2.4 奥氮平对大鼠棕色脂肪产热及形态的影响
与对照组相比,奥氮平给药组在静息状态下肩胛处温度下降(P<0.01),表明在基础条件下药物使机体热量产生减少,棕色脂肪的产热活性降低,影响了能量输出,这是机体能量消耗的另一部分;同时奥氮平降低了BAT的重量(P<0.01);HE染色显示,奥氮平组BAT的密度更小,中间有较大脂滴的形成,表明BAT形态发生显著改变,这可能是棕色脂肪产热活性的能力降低的原因。见图6。
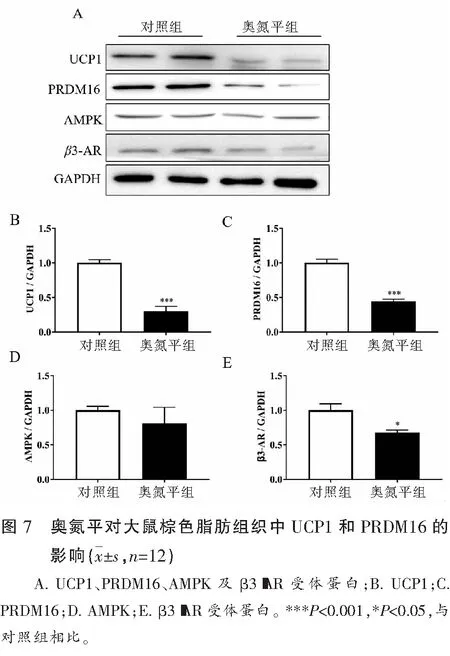
2.5 奥氮平对大鼠BAT中UCP1和PRDM16的影响
BAT蛋白检测显示,奥氮平下调了UCP1(P<0.001)和PRDM16(P<0.001)蛋白表达。同时β3-AR受体也被下调(P<0.05),AMPK蛋白有下调的趋势,但无统计学意义(P>0.05)。综上说明奥氮平引起产热降低主要是通过影响β3-AR激动的棕色脂肪的非颤栗性产热所致。见图7。
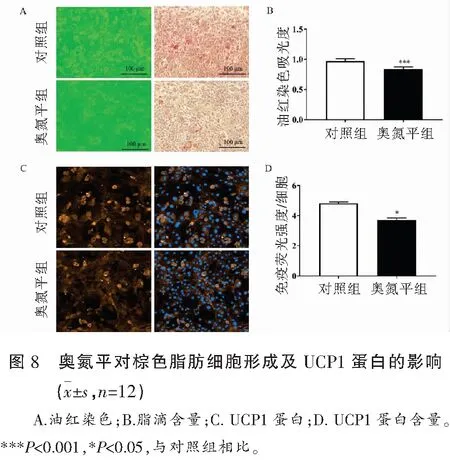
2.6 奥氮平对棕色脂肪细胞形成及UCP1蛋白的影响
选择10 μM的奥氮平作用于棕色脂肪细胞的分化期,根据油红染色发现,奥氮平显著抑制了棕色脂肪细胞的分化(P<0.001),甘油三酯相对含量分别为0.91±0.08和0.70±0.02;免疫荧光染色显示,奥氮平下调了棕色脂肪细胞特异性标记蛋白UCP1的水平(P<0.05),相对荧光强度分别为1.47±0.13和0.94±0.04。见图8。
3 讨论
精神分裂症是一种严重慢性致残性的精神疾病,患病率约为1%,是目前全球社会经济负担最重的疾病之一。药物治疗仍然是目前精神疾病治疗的基石,但是长期慢性使用抗精神病药易引发患者发生代谢综合征(如糖尿病、肥胖、高血压和高胆固醇血症)的风险。而抗精神病药影响能量代谢平衡导致代谢异常的机制尚不明确。本研究发现,奥氮平长期慢性给药引起了大鼠过量脂肪堆积和体重增加,与既往的研究[12]一致。同时,奥氮平使大鼠血清中TG、LDL、HDL和FFA水平发生变化,引起机体血脂异常和游离脂肪酸增加,这也是代谢综合征进展的关键组成部分。
除血脂代谢紊乱外,奥氮平打破机体的能量平衡,使机体患代谢疾病风险增加。越来越多研究[13]表明,代谢紊乱表型可能与棕色脂肪组织中的产热活性降低有关。棕色脂肪作为一种具有产热作用的内分泌器官,对肥胖治疗有潜在的研究价值。棕色脂肪细胞具有相当数量的代谢活性,能够以产热的形式在成年人中分散能量。本研究表明,奥氮平显著下调静息状态下大鼠的肩胛处温度,限制了机体的能量消耗。HE染色也证明了奥氮平改变了棕色脂肪组织的形态,这可能解释奥氮平产生过度镇静限制了棕色脂肪产热活性。
研究[14]表明,PRDM16蛋白控制着骨骼成肌细胞和棕色脂肪细胞之间的双向细胞命运开关。PRDM16蛋白在培养细胞或体内的白色脂肪前体中表达时,可以打开全部棕色脂肪选择性基因,同时关闭几个富含白色脂肪基因的表达[15]。本研究结果显示,奥氮平显著降低了棕色脂肪组织中β3-AR的表达,同时显著下调了PRDM16和UCP1蛋白的含量,表明奥氮平给药降低了棕色脂肪中β3-AR受体的活性,从而导致下游PRDM16和UCP1的含量减少导致产热活性降低而介导了代谢综合征的表型。
本研究参照Xue等[16]的方法通过C3H10T1/2细胞建立了棕色脂肪细胞模型,选用的奥氮平浓度10 μM作用于C3H10T1/2细胞分化期间,每2天更换诱导液,从细胞层面探索奥氮平对棕色脂肪细胞发育分化的作用。油红染色和免疫荧光结果显示,奥氮平不仅抑制了棕色脂肪细胞的分化,还了降低UCP1的表达量,进一步验证了奥氮平降低了棕色脂肪细胞产热活性从限制能量消耗引起体重增加和肥胖潜在机制。
综上,奥氮平长期应用可能通过抑制β3-AR-AMPK-PRDM16-UCP1信号通路诱发SD大鼠棕色脂肪组织重量和形态改变,减少棕色脂肪的产热活性和产热蛋白UCP1的表达;同时抑制了棕色脂肪细胞的形成,促使棕色脂肪向白色脂肪转化,导致机体代谢紊乱的表型,为临床抗精神病药引起的副作用干预,提高治疗依从性提供了理论的新策略。
