GABA抑制腹主动脉瘤小鼠未成熟树突状细胞的迁移机制
2021-10-22杨颖罗晖冯杰曾韡
杨颖,罗晖,冯杰,曾韡
(1.川北医学院附属医院心内科·川北医学院附属医院心血管疾病研究室;2.南充市中心医院心胸外科,四川 南充 637000)
腹主动脉瘤(abdominal aortic aneurysm,AAA)及其并发的动脉破裂是一类致命的血管性疾病,动脉粥样硬化(atherosclerosis,AS)是其常见的病因[1]。AAA的主要病理改变为炎症细胞浸润,血管平滑肌细胞凋亡,弹力纤维和胶原纤维断裂,细胞外基质(extracellular matrix,ECM)降解,从而导致动脉管腔扩张或膨出甚至发生破裂,造成严重出血,危及生命[2]。因此,如何抑制炎症细胞的活化,阻止ECM降解是预防AAA的主要措施,也是目前尚未解决的临床难题。γ-氨基丁酸(γ-aminobutyric acid,GABA)A 型受体是配体门控氯离子通道超家族的成员,通常是由 α,β,γ,δ,ε,π,θ,ρ 8 类亚基组成的异源五聚体。这些亚基又组成众多功能结构特异的GABA-A受体。GABA激动GABA-A受体后对脑内抑制性神经传递进行调控[3]。近年来,研究[4]发现,GABA-A受体同样表达于外周树突状细胞、巨噬细胞、T淋巴细胞等细胞膜上,抑制炎症免疫细胞的活性,延缓某些自身免疫性疾病的进展。本小组既往研究[5]发现,在AS模型中,激活外周血单核-巨噬细胞膜表面的GABA-A受体可改善巨噬细胞内失衡的胆固醇转运,抑制巨噬细胞分泌TNF-α,上调调节性T淋巴细胞的比例,减轻载脂蛋白E缺乏(apoE-/-)小鼠主动脉粥样硬化斑块的形成。该结果提示,AS 与AAA同为血管炎症性疾病,发病机制类似,炎症免疫反应贯穿始终[6]。本研究旨在探讨GABA是否能够通过其受体抑制腹主动脉瘤小鼠未成熟树突状细胞(immature dendritic cells iDCs)的迁移机制。
1 材料与方法
1.1 实验材料
C57BL/6J雄性小鼠(购于川北医学院实验动物中心),鼠龄6周,体重18~20 g。日夜节律变化条件为12 h光照和12 h黑暗,食物和饮水按需供给。实验动物的使用都严格按照川北医学院实验动物中心的动物伦理学条例执行。GABA购于美国Sigma 公司。
1.2 方法
1.2.1 动物处理 弹性蛋白酶(PPE)构建小鼠腹主动脉瘤动脉模型[7-8]:将小鼠麻醉后,打开腹腔游离出肾动脉以下髂动脉分叉以上腹主动脉段,依次结扎腹主动脉分支,先行阻断腹主动脉近端,记录阻断时间,接着阻断腹主动脉远端,在灌注段腹主动脉穿孔,接入PPE管,结扎固定,检验灌注段腹主动脉密闭性,PPE灌注浓度采用4.5 U/mL,维持灌注压100 mmHg,灌注时间为5 min,灌注完毕后拔出PPE管,修复穿刺口,检查若无出血,逐层关腹。手术时间40~60 min,建模周期14 d。腹主动脉扩张率(%)=(术后4周腹主动脉直径-灌注前腹主动脉直径)/灌注前腹主动脉直径×100%,以术后14 d腹主动脉扩张率50%以上作为诊断腹主动脉瘤的标准。病理组织学检测提示,细胞外基质降解,平滑肌细胞减少或消失,炎症细胞浸润[9]。
1.2.2 细胞培养 获取C57BL/6J腹主动脉瘤小鼠骨髓来源的未成熟树突状细胞。将小鼠脱颈处死,在无菌条件下分离小鼠股骨。用PBS将股骨中骨髓细胞冲洗出来直至股骨泛白。收集冲洗液使用细胞筛过滤。将过滤后的冲洗液移入15 mL离心管中,1 000 rpm离心5 min。倒去上清液,加入适量的红细胞裂解液轻轻吹打混匀,4℃裂解 1~2 min。加入10~20 mL PBS混匀,离心弃上清。将沉淀加入无血清培养基6 mL吹打混匀后移至6孔板中,每孔1 mL,放入37℃培养箱孵育3 h后小心倒掉上清液,每孔分别加入2 mL完全培养基及CSF和IL-4各10 μL,放入37℃培养箱中继续培养。隔天换液并加入新的CSF和IL-4,第6天收集细胞液。从而获得未成熟DCs细胞[10]。
1.2.3 细胞转染 将收集的未成熟DCs细胞接种至6孔板中,每孔加入细胞液1 mL;用移液枪吸取0.35 μL siRNA加入200 μL 1640培养基;加入15 μL转染试剂,震荡混匀后室温下静置15 min;混合液加入细胞液中后放入37℃培养箱孵育6 h,每孔加入新鲜完全培养基2 mL。Gabara5 SiRNA GGUGCGAACAGACAUCUAUTT;AUAGAUGUCUGUUCGCACCTT(购于上海生工)。
1.2.4 Transwell迁移实验观察细胞迁移能力 转染48 h后收集细胞离心,将细胞分为对照组(生理盐水组)、GABA(200 nmol/L)组、Gabara5siRNA+GABA(200 nmol/L)组;上室中各加入细胞悬液100 μL,下室中加入500 μL完全培养基,放入37℃培养箱孵育2 h;PBS淋洗,4%多聚甲醛固定15 min,DAPI染色10 min,PBS洗涤3次;待干燥后荧光显微镜下观察拍照,采用Image J软件分析,计算细胞数。
1.2.5 荧光技术观察细胞骨架 收集未成熟的DCs细胞,调整细胞浓度为106/mL,用移液枪抽吸细胞液1 mL接种于多聚赖氨酸处理过的载玻片上,放入37℃培养箱孵育48 h;经PBS清洗,4%多聚甲醛固定,0.25%Tritonx-100破膜,滴加稀释好的鬼笔环肽至载玻片上,室温避光孵育,PBS洗涤,待晾干后滴加抗荧光淬灭封片剂,荧光显微镜下观察拍照显示F-肌动蛋白染色(F-actin)。
1.2.6 蛋白免疫印迹法(Western Blot)检测 GABAA受体α5亚基的表达 收集细胞转染后iDCs,提取细胞蛋白,免疫组化BCA法测蛋白浓度,依次通过制胶、电泳、转膜、染色、封闭、抗体孵育,最后化学发光、成像、分析。
1.3 统计学分析
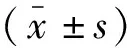
2 结果
2.1 未成熟树突状细胞(iDCs)的培养及纯度
培养的第0天光学显微镜观察显示培养液中充满大量圆形单核细胞;第2天观察发现细胞贴壁生长且有集落生成,部分细胞开始伸出突起;第4天观察发现集落数量增加,伸出突起的细胞数量增多;第6天观察发现有大量细胞悬浮在培养液中,细胞周围有长短不一的突起。因单核细胞来源的iDC表达CD11c,CD11c-FITC抗体检测iDC纯度。在第6天收集细胞液后加入CD11c-FITC抗体标记,利用流式细胞仪检测细胞纯度在80%左右。见图1。
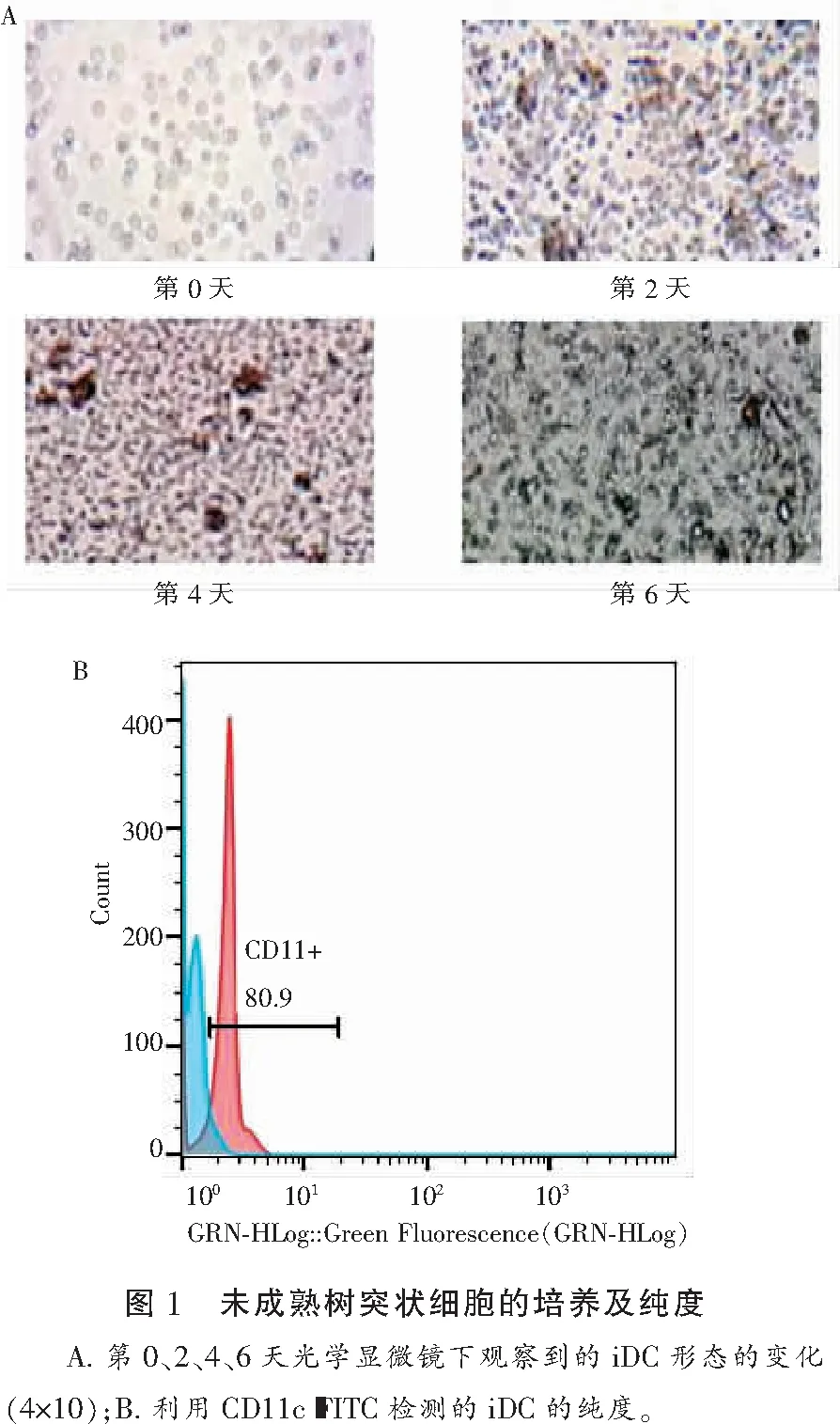
2.2 GABAA受体α5亚基SiRNA转染情况
GABAA受体α5亚基SiRNA转染率>90%。将iDCs分为空白组(生理盐水组)、GABA组、转染试剂组、NC-FAM组(NC组)、Gabara5siRNA组(SiRNA组),转染48 h后收集细胞利用Western blot检测GABA-A受体α5亚基的表达发现,GABA可以促进GABA-A受体α5亚基表达,差异无统计学意义(P>0.05),而SiRNA干扰了GABAA受体α5亚基的表达,差异有统计学意义(P<0.05)。见图2。
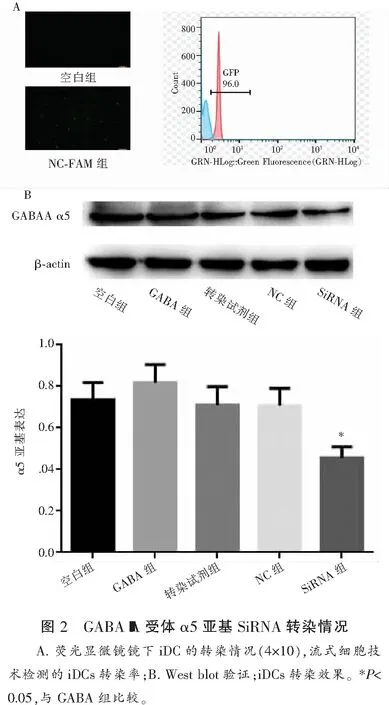
2.3 GABA通过GABA-A受体抑制iDCs的迁移
将iDCs分为空白组(生理盐水组)、GABA组、Gabara5siRNA组(SiRNA组),其中GABA组和SiRNA组分别加入200 nmol/L的GABA共孵育,利用transwell小室检测细胞迁移能力,结果显示,与对照组比较,GABA组iDCs的个数明显减少,差异有统计学意义(P<0.05)。SiRNA组iDCs的个数较对照组无明显变化,这些结果表明GABA对iDCs的迁移能力起负调节作用,并且可能是通过GABA-A受体α5亚基进行的。见图3。
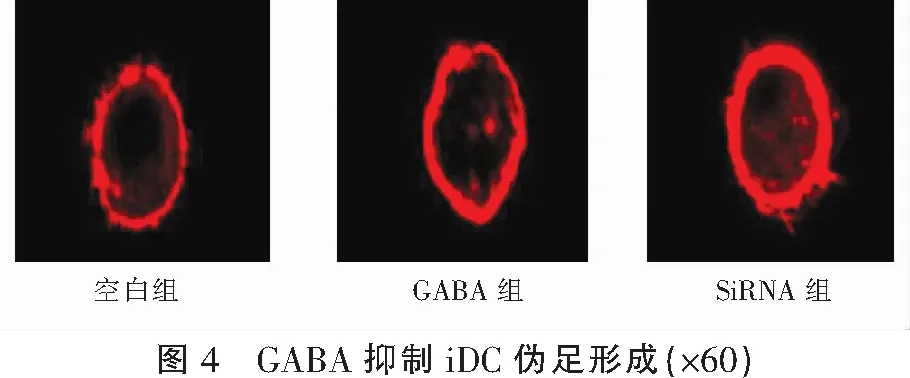
2.4 GABA/GABA-A受体通路抑制iDCs伪足的形成
将GABA加入iDCs中共孵育1 h,激光共聚焦显微镜发现,加入GABA后iDCs的伪足生成明显减少。然后利用SiRNA敲低iDCs表面的GABA-A受体α5亚基后与GABA共孵育1 h,F-actin荧光染色结果显示iDCs周围有较多的伪足形成,并不受GABA的影响。综合实验结果,说明GABA/GABA-A受体通路通过抑制iDCs伪足的形成来抑制细胞的迁移能力。见图4。
3 讨论
本研究发现,GABA/GABA-A受体通路可以抑制未成熟树突状细胞的迁移能力,当利用SiRNA敲低GABA-A受体α5亚基表达后,GABA/GABA-A受体通路则不再抑制未成熟树突状细胞的迁移。进一步研究发现,在GABA作用下,未成熟树突状细胞伪足生成明显减少,提示了GABA/GABA-A受体通路可能通过抑制未成熟树突状细胞伪足的生成来影响细胞的迁移。
研究[11]证实,敲除浆细胞样DCs 基因的AAA模型小鼠,动脉瘤的形成明显减轻。在正常主动脉,少量DCs存在于内膜下并与平滑肌细胞和内皮细胞直接接触;但在承受血流涡流压力较大的部位,如动脉扩张处,大量成熟DCs呈簇状聚集与T淋巴细胞接触,进行抗原呈递,激活T淋巴细胞的致炎活性[12]。同时,富集于病变血管处的未成熟DCs开始向血管外膜迁移,DCs胞内的运动装置骨架蛋白发生构象改变,p38MAPK信号通路被激活,细胞骨架相关蛋白丝切蛋白去磷酸化,肌动蛋白单体在肌丝末端的解聚速度增加,DCs伪足伸出,迁移开始[13-14]。随着DCs到达ECM,除借助伪足穿行外,尚需分泌相关蛋白酶降解ECM。未成熟DCs主要分泌基质金属蛋白酶(matrix metalloproteinase,MMP)-1、MMP-2、MMP-9和基质金属蛋白酶抑制剂(tissue inhibitor of metalloproteinase,TIMP)-1等,分泌过程与MAPK信号途径中p38/ERK1/2的磷酸化状态有关[15]。因此,抑制成熟DCs的抗原呈递功能,削弱未成熟DCs的迁移及分泌MMPs的能力可有效阻止动脉瘤破裂。哺乳动物骨髓来源的DCs胞内含有GABA合成酶、GABA转运蛋白和GABA-A受体亚基(α3,α5,β1,β3,ρ1)[4]。当弓形虫感染DCs后,DCs内合成的GABA通过自体分泌的方式作用于GABA-A受体,调控DCs的运动;此过程中,细胞表面GABA-A受体的亚基表达也发生变化,α3,β3 和 ρ1亚基的转录明显增加[16]。另有研究[17]发现,神经元突触表面的GABA-A受体通过胞吞和受体再循环,能够在细胞膜和细胞质之间发生迁移,如亚基α5发生膜受体内化后在埃兹蛋白-根蛋白-膜突蛋白(ezrin-radixin-moesin,ERM)家族中根蛋白的帮助下锚定肌动蛋白,从而引发抑制性突触可塑性的改变。
综上,GABA/GABA-A受体通路可以抑制未成熟树突状细胞的迁移能力。后续本研究小组将在体外实验中继续研究GABA/GABA-A受体通路对腹主动脉瘤小鼠树突状细胞抗原提呈功能的影响,从而为腹主动脉瘤的临床治疗寻找新的靶点。
