结合PI-RADSv2.1磁共振引导下PSAD和年龄建立预测前列腺癌风险的预测模型
2021-10-22高寒任冬闫九松徐光勇张俊勇姜庆
高寒,任冬,闫九松,徐光勇,张俊勇,姜庆
(重庆医科大学附属第二医院泌尿外科,重庆 400010)
前列腺癌是中国老年男性较为常见的恶性肿瘤之一,2019年中国恶性肿瘤流行情况分析报告结果显示,前列腺癌的发病率位居中国男性癌症的第6位[1]。目前,前列腺活检仍是诊断前列腺癌的金标准,但前列腺活检是一项侵入性操作,可能会引起血精症、尿潴留、血尿、感染和疼痛等并发症[2]。前列腺特异性抗原(prostate specific antigen,PSA)的出现,极大地提高了前列腺癌筛查准确率,使前列腺癌死亡率明显下降[3]。然而,前列腺增生、前列腺炎、直肠指检和尿道操作等多种因素可致PSA检测的可靠性受到一定影响[4]。因此,不能仅仅依靠PSA水平升高作为前列腺活检指征。随着前列腺影像报告与数据系统(prostate imaging reporting and data system,PI-RADS)的推广,赋予了前列腺磁共振有效的量化标准,其临床应用价值已被众多学者所认可。当前,有许多无创因素及检查可预测前列腺癌的风险,如年龄、PSA、直肠指检、前列腺特异性抗原密度(PSAD)、前列腺超声和前列腺MRI。其中直肠指检主要依靠主观临床判断,因为它高度依赖临床医生的经验,准确性欠佳。同时,有部分学者认为身体质量指数(body mass index,BMI)与前列腺癌具有一定关联性,但目前并未有确切报道证实。目前,部分前列腺癌预测模型准确性欠佳。本研究通过分析经直肠超声引导的前列腺活检的患者的临床数据、实验室检查和影像学特征,旨在建立简化前列腺癌危险因素模型来提高前列腺癌预测的准确率,减少不必要的前列腺活检及医疗资源的浪费。
1 资料与方法
1.1 一般资料
选取2019年3月至2020年6月重庆医科大学第二附属医院209例血清PSA≥4 ng/mL的患者为研究对象,患者平均年龄69.3岁。将患者随机分为实验组(n=135)和验证组(n=74)。纳入标准:(1)男性;(2)完成前列腺多参数MRI检查;(3)经直肠超声至少有12个核心的引导性前列腺活检;(4)在进行MRI及活检之前,未采取任何药物或已知会影响PSA的手术,且完成MRI与穿刺时间间隔不超过1个月。排除标准:(1)图像质量低和活检数据丢失;(2)不愿意参与本次研究者;(3)缺失完整病理报告者;(4)重复前列腺穿刺者。
1.2 方法
1.2.1 资料收集 数据收集包括患者的姓名、年龄、入院时间、血清总PSA(tPSA)、血清游离PSA(fPSA)、f/tPSA、PI-RADS v2.1分数及Gleason评分。通过多参数MRI的前列腺体积,计算前列腺特异性抗原密度(PSAD)。
1.2.2 前列腺多参数MRI和经直肠超声引导的前列腺活检 前列腺多参数MRI分别由两位具有前列腺影像诊断经验的影像学诊断医师采用双盲法以PI-RADS v2.1对受检者图像及病灶进行评分;经直肠超声引导的前列腺活检分别由两位具有丰富病理诊断经验的医师采用双盲法按2016版WHO/ISUP分级分组系统标准进行评分。
1.3 统计学分析
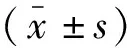
2 结果
2.1 两组患者一般资料比较及前列腺癌风险因素分析
本研究总共评估209例男性患者,135例实验组(81例非前列腺癌和54例前列腺癌)和74例验证组(45例非前列腺癌和29例前列腺癌)。经直肠超声引导的前列腺穿刺活检,实验组前列腺癌阳性检出率54例(40%),验证组阳性检出率29例(35%);≥65岁患者活检阳性率高于<65岁患者(48.8%vs.14.6%,P<0.05)。实验数据不符合正态分布采用秩和检验,单因素分析显示随着年龄、PSA、PSAD和PI-RADS v2评分增加和f/tPSA的降低,前列腺癌的风险显著增加(P<0.05)。见表1。
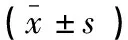
表1 两组患者一般资料比较
2.2 各影响因素与前列腺癌筛查率的相关性
为了进一步评估上述影响因素对前列腺癌筛查的影响,对所有与前列腺癌有显著关系的变量进行逐步逻辑回归分析。结果发现,年龄、MRI引导下PSAD和PI-RADS v2.1分数与前列腺癌的筛查准确率相关(P<0.05),而与PSA及f/tPSA差异无统计学意义(P>0.05),该模型的预测准确性为85.9%。见表2。
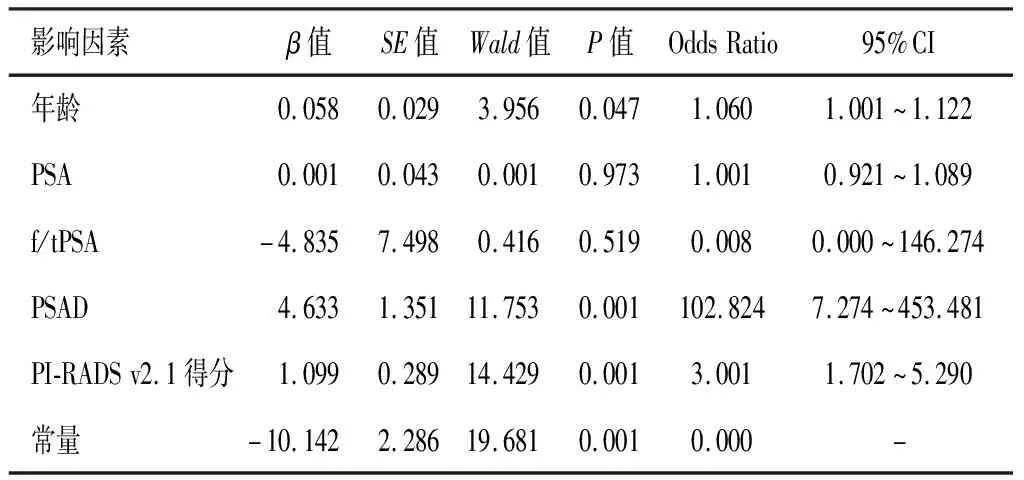
表2 各影响因素二元逻辑回归分析
2.3 预测模型建立及性能评估
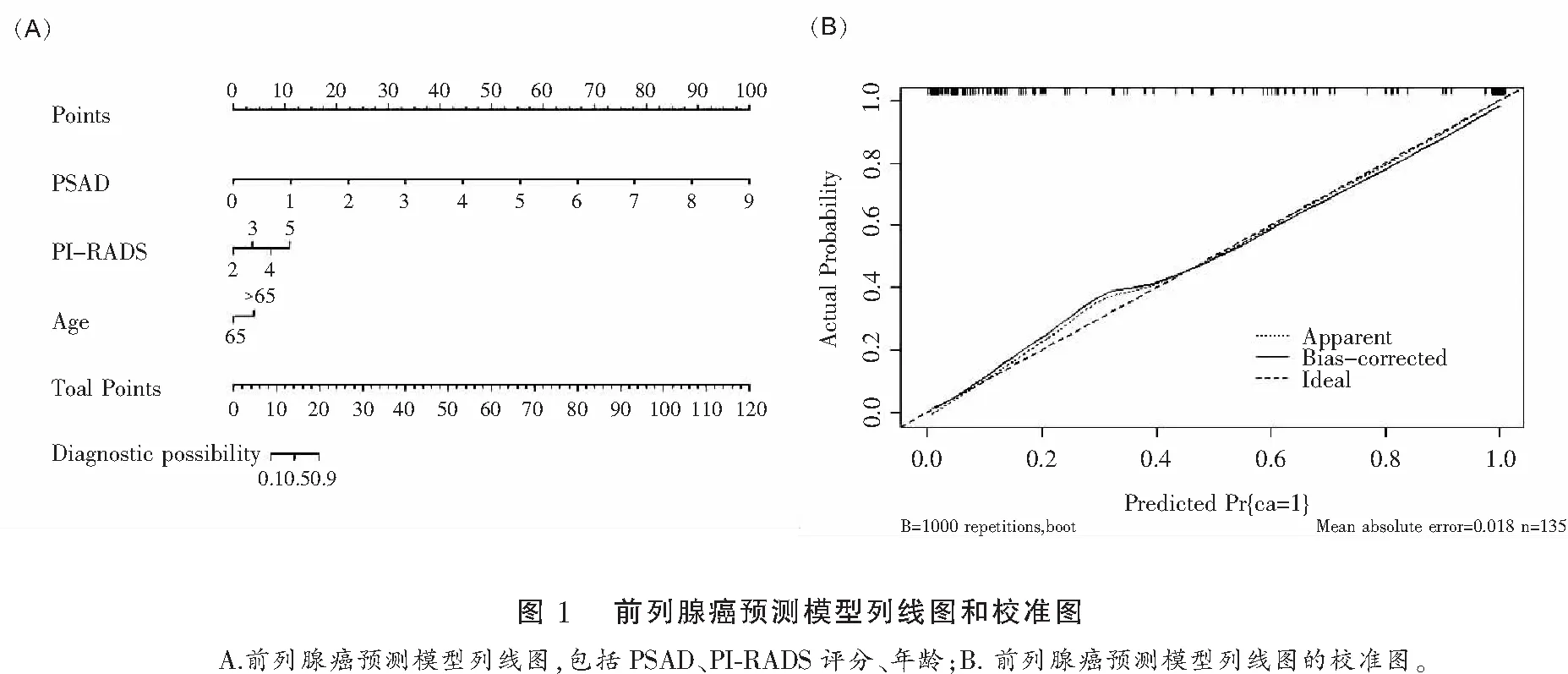
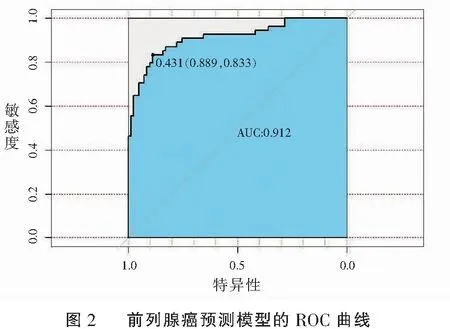
本研究通过二元逻辑回归分析建立了相应的列线图和校准图用于预测前列腺癌。为了使模型更便捷,将年龄划分为<65岁及≥65岁,最终对于预测前列腺癌的校准图感到满意。ROC曲线显示前列腺癌预测模型的AUC为0.912(95%CI=0.833~0.889)。见图1及图2。
2.4 临床决策曲线分析
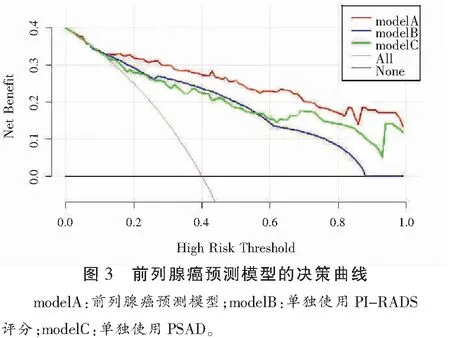
临床决策曲线分析显示,所建前列腺癌预测模型较单独使用PSAD或PI-RADS评分在整个范围内都具有较高的净收益(P<0.05)。见图3。
2.5 预测模型的验证
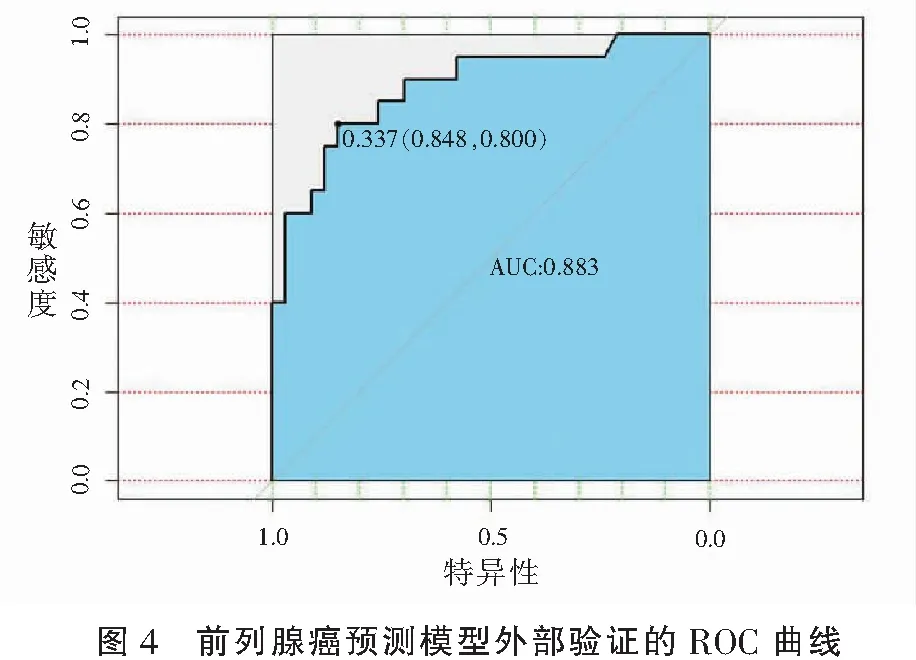
验证组外部验证显示,所建前列腺癌预测模型的AUC为0.883(95%CI:0.800~0.848),表明该预测模型有良好的效能。见图4。
3 讨论
目前,对早期前列腺癌患者的初筛主要是基于PSA检查[5],为避免前列腺癌漏诊,通常推荐PSA升高患者进行前列腺穿刺活检[6]。自20世纪90年代开始,血清PSA检测被广泛应用于前列腺癌筛查。与健康人群相比,前列腺癌患者的血清PSA通常会有所升高,但含量在前列腺炎和前列腺操作(如直肠指检、前列腺按摩和尿管插入术)的患者中也可能升高[7]。直肠指检虽也可以用作前列腺癌的筛查方法,但它过多依赖于检查者的主观判断,不利于减少误差。
目前,越来越多的学者认为PSAD能提高前列腺癌筛查和诊断能力[8],因为PSA可能受前列腺体积影响。本研究也认为,前列腺体积可能是前列腺癌的危险因素,故PSAD作为影响因子纳入研究[9-10]。同时,根据现有文献报道及临床实践,选择了目前最为广泛使用的前列腺癌检查作为影响因子[11-13]。文献表明,前列腺癌的检出率与年龄存在重要的联系,前列腺癌的风险随着年龄的增长而升高,其中40~79岁前列腺癌的发病率及死亡率呈急剧上升趋势。根据文献及目前对老年人的定义,本研究将年龄分为<65岁和≥65岁[14-15]。MRI目前已成为前列腺癌筛查的重要工具之一,前列腺的多参数MRI显示出了对于前列腺癌诊断和治疗策略的强大潜力。早前的报道表明,多参数MRI诊断前列腺癌的性能较CT和常规超声检查具有较明显优势。PI-RADS)2.1版已于2019年发布,该评分系统可用于识别临床上重要的前列腺癌和部分良性病变。大量研究者对PI-RADS v2.1也进行了深入讨论及研究,表明该评分系统有助于检测前列腺癌[16-17]。PI-RADS v2.1具有明确的前列腺活检参考标准,在使用PI-RADS进行前列腺癌的预测评估中,不同的放射线医师具有良好的重复性[18]。因此,本研究使用PI-RADS v2.1作为MRI诊断可最大程度地减少系统误差,使筛选结果更加可靠。PI-RADS v2.1提供了有关前列腺活检的重要观察结果,可据此将有不同评分的患者进行再次分组。直肠指检虽也可以用作前列腺癌的筛查方法,但它过多依赖于检查者的主观判断,不利于减少误差。本研究最终将年龄、PSA、PSAD和PI-RADS v2.1评分纳入了预测模型。
前列腺穿刺活检是有创性检查,同时会增加患者痛苦及费用,还可能会伴发疼痛、血尿和感染等并发症[19-20]。目前PSA会受多种多因素影响,使部分非前列腺癌患者也接受了前列腺活检。因此,需要寻找进一步改善前列腺癌检测的方法。此外,为了使预测模型更加准确,无创且易于使用,本研究在预测模型中减少了部分检测方法。本研究中,ROC曲线显示,预测模型的AUC在实验组中为0.912(95%CI=0.833~0.0.889),在验证组的AUC为0.883(95%CI=0.800~0.848),表明该预测模型是前列腺癌有效的筛查方法。从临床决策曲线可见,相比于单独使用PI-RADS v2.1评分或PSAD,将年龄、PI-RADS v2.1及PSAD结合的预测模型具有更高的预测效能。另外,既往研究[21]表明,PSA水平及PI-RADS v2.1评分与前列腺癌恶性程度呈正相关[22]。本研究也显示,评PI-RADS v2.1分系统与WHO/ISUP评分系统呈低正相关(r=0.502,P<0.01)。尽管该评分系统与前列腺癌的恶性程度有一定的关系,但仍不足以预测前列腺癌的恶性程度,需要更多的临床样本及数据进一步深入研究。
综上所述,本研究建立的预测模型提高前列腺癌的检测方法,减少了前列腺不必要的活检,可作为临床实践中的参考指标。
